应用酵母双杂交系统筛选LKB1相互作用蛋白
2018-03-30李洪涛
徐 卿,李洪涛,林 峰,姚 阳
LKB1(liver kinase B1)即STK11(serine/threonine protein kinase 11),首次是在黑斑息肉综合征研究中被报道的[1],其在胰腺、肝脏等机体器官组织中广泛表达。LKB1基因可编码一个由436位氨基酸组成的蛋白质,属于丝氨酸/苏氨酸蛋白激酶,N端第38~43位氨基酸残基是其核定位信号序列、第50~319位氨基酸为其激酶催化域。LKB1通过核定位信号序列主要定位于细胞核内,在胞质中表达相对较少,然而LKB1的功能主要与其胞质内的部分有关[2-3]。研究[4-5]显示,LKB1通过磷酸化其底物腺苷酸活化蛋白激酶(AMP activated protein kinase,AMPK),从而激活AMPK,负向调节mTOR的活性,在控制和调节细胞能量代谢、细胞增殖、细胞周期、细胞凋亡和细胞极性中发挥着重要作用。为更清楚了解LKB1在体内的作用机制,揭示LKB1可能存在的新功能,该研究利用酵母双杂交系统,以LKB1为诱饵,筛选人类全基因组开放阅读框酵母双杂交文库,寻找能与之相互作用的蛋白。
1 材料与方法
1.1试剂与材料GAL4酵母双杂交系统与human ORFeome Y2H library文库、转染试剂Lipofectamine 2000购自美国Invitrogen公司;Yeast Nitrogen Base、Bacto-yeast extract、Bacto-Peptone 购自美国BD公司;PEG50、葡萄糖、醋酸锂、谷胱甘肽硫转移酶(glutathione-S-transferase,GST)及GST融合蛋白、各种氨基酸购自上海拜科生物科技公司;3-氨基-1,2,4-三唑、玻璃珠购自美国Sigma公司;Glutathione Sepharose 4B beads购自上海轶沤生物科技有限公司;质粒小量提取试剂盒购自美国Promega公司;酵母质粒提取试剂盒购自北京天根生化科技有限公司;Tag酶、DNA限制性内切酶购自美国NEB公司;T4DNA连接酶购自北京全式金生物技术有限公司;XgaI、DMEM高糖培养基与胎牛血清购自美国Gibco公司;增强化学发光显色试剂盒购自美国Pierce公司;Mav203细菌感受态为实验室保存。
1.2方法
1.2.1构建Bait质粒 LKB1全长克隆到pDONR221载体,通过Gateway cloning reaction (美国Invitrogen公司)转移到含有GAL4 DNA binding domain的pDEST32载体,构建Bait载体pDEST32- LKB1,用LiAc转化法将pDEST32-LKB1转化入Mav203酵母菌株,转化成功的菌株通过SD-leu的培养基选择性筛选阳性克隆,将转化了pDEST32- LKB1的酵母菌株制成感受态细胞。
1.2.2自激活检测 用LiAc转化法将含有GAL4 activating domain的prey质粒空载 (pDEST22)转化含有Bait基因的感受态细胞,转化后同时涂布二缺板SD-2(SD-Leu-Trp)和4缺板SD-4(SD-Leu-Trp-His-Ura)的营养缺陷板,如果能在SD-4上生长说明有自激活效应,该Bait蛋白能与GAL4 activating domain相互作用。没有自激活效应再进行下一步筛选。
1.2.3文库筛选 用LiAc转化法将prey质粒(human ORFeome Y2H library)转化该菌株,转化后同时涂布SD-2和SD-4的营养缺陷板,SD-Leu-Trp的培养板可以用于转化效率的评估,阳性克隆可以在SD-4的培养板上生长并且使X-Gal(5-bromo-4-chloro-3-indolyl-beta-D-galactopyranoside,美国Sigma公司)显蓝色,抽取酵母阳性克隆质粒转化大肠杆菌,抽质粒测序,确定阳性克隆基因。
1.2.4克隆验证 将Bait和Prey载体共同转化酵母菌株Mav203并分别涂布SD-2和SD-4酵母培养板,X-Gal显色反应验证相互作用。将回转阳性的质粒送上海铂尚生物技术有限公司测序。测序结果在美国国立生物技术信息中心网站上进行序列比对分析。
1.2.5HERC3真核表达载体构建 以含HERC3全长cDNA为模板通过下游带有HA标签的引物,运用PCR方法扩增HERC3全长序列( 正向引物:5′-CGGAATTCATGTTATGTTGGGGATATTG-3′;反向引物: 5′-ATGAAGGGTTTAGTTTGGCCTACCCATACGACGTCCCAGACTACGCTTAACTCGAGCGG-3′)。PCR产物经过EcoRⅠ、XhoⅠ双酶切,与pcDNA3.1(+)载体用T4 DNA连接酶在16 ℃的条件下连接过夜。然后将连接的产物转化摇菌,用小抽试剂盒抽提质粒,PCR鉴定正确后送至上海铂尚生物技术有限公司测序。
1.2.6细胞培养及转染 HEK293FT细胞在含10%胎牛血清、0.1%青霉素和链霉素的DMEM高糖培养基中培养。待细胞生长状况良好时,胰酶消化并接种培养皿中,当细胞密度生长至70%~80%时,换成无双抗的Opti-DMEM培养基培养,并用Opti-DMEM培养基将Lipofectamine2000以及质粒以1 ∶1的比例混匀,室温孵育20 min,再均匀加入相应培养皿中,转染4~6 h后换为含10%胎牛血清、0.1%青霉素和链霉素的DMEM 高糖培养基继续培养。
1.2.7免疫共沉淀 ① 收集细胞,加500 μl细胞裂解液RIPA buffer (添加PMSF) 裂解细胞。② 裂解细胞于4 ℃、12 000 r/min 离心15 min,取上清液。其中需另外留取50 μl上清液,加入5×SDS样品缓冲液,煮沸10 min,-20 ℃保存留作Input的样品。③ 免疫共沉淀:加入1 μg抗体,4 ℃充分混匀4 h或者过夜。再加入20 μl用细胞裂解液平衡过的protein G beads,4 ℃充分混匀4 h。1 000 r/min离心3 min,弃上清液。加1 ml细胞裂解液,4 ℃轮转10 min, 1 000 r/min离心3 min,弃上清液,重复洗涤3次。④ Western blot检测:吸尽上清液,加60 μl 1×SDS样品缓冲液,煮沸10 min,12 000 r/min离心5 min,取上清液电泳,Western blot检测沉淀及共沉淀蛋白质。
1.2.8GST-Pull down 按照实验组别分别加入GST-LKB1融合蛋白(对照组用GST蛋白)和过表达HERC3的细胞裂解液,然后分别加入等量Glutathione Sepharose 4B beads,并补充GST-Pull down buffer 到总体积500 μl。4 ℃充分混匀4 h后,GST-Pull down buffer漂洗3次,煮样,Western blot检测沉淀蛋白。
1.3统计学处理数据采用 SPSS 16.0软件进行分析,两组间实验数据的比较采用t检验。
2 结果
2.1E3连接酶HERC3能够与LKB1蛋白相互作用利用已有的cDNA文库,采用酵母双杂交方法筛选到HERC3能与LKB1相互作用。HERC3属于E3连接酶,含有染色体浓缩调节因子1相似结构域和同源E6-AP羧基末端结构域。HERC3与LKB1的相互作用能够使酵母在4缺板SD-4(SD-Leu-Trp-His-Ura)上生长,并能够激活β-galactosidase活性。见图1。

图1 酵母双杂交系统检测LKB1与HERC3有相互作用
A:HERC3+LKB1共转并在SD-2上生长; B: Blank+LKB1共转并在SD-2上生长;C: HERC3+LKB1共转并在SD-4上生长; D: Blank+LKB1共转并在SD-4上生长;蓝色为阳性克隆
2.2pcDNA3.1-HERC3-HA真核表达载体的构建及鉴定构建成功的重组质粒pcDNA3.1-HERC3-HA经过PCR检测鉴定,经过DNA Marker比对后,显示与目的片段条带位置一致,证明连接是成功的。然后送测序,序列与基因库序列一致,质粒构建成功。见图2。
2.3HERC3与LKB1在细胞内的相互作用采用免疫共沉淀的实验方法,将带有Flag标签的LKB1和带有HA标签的HERC3质粒共转染HEK293FT细胞,同时分别设置pcDNA3.1-Flag +pcDNA3.1-HERC3-HA和IP:IgG作为阴性对照。结果表明,HERC3和LKB1结合,而不与Flag标签结合,说明HERC3和LKB1蛋白在细胞内存在特异性的相互作用。见图3。
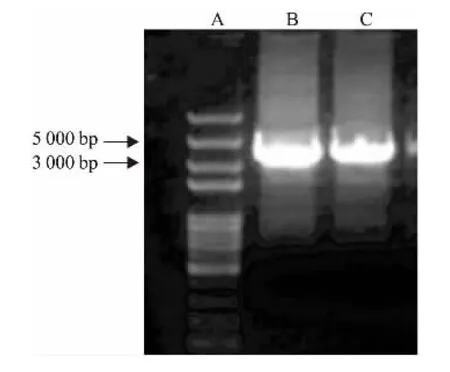
图2 重组质粒pcDNA3.1-HERC3-HA PCR鉴定电泳图
A:DNA Marker; B:以cDNA文库为模板PCR方法扩增HERC3;C:重组质粒PCR鉴定HERC3条带

图3 HERC3与LKB1在HEK293FT细胞内的相互作用
1:LKB1-Flag; 2: HERC3-HA+pCDNA3-Flag共转; 3: HERC3-HA+LKB1-Flag共转
2.4GST-Pulldown验证HERC3与LKB1的相互作用以GST-LKB1融合蛋白为诱饵蛋白,过表达HERC3的细胞总蛋白为捕获蛋白,分别设置HERC3-HA+GST蛋白组、HERC3-HA+GST-LKB1融合蛋白组,进行Pull-down实验,最后收集到的样品进行Western blot检测沉淀蛋白。结果表明,GST-LKB1能够特异性结合HERC3,而GST蛋白不能够沉淀HERC3。见图4。
3 讨论
目前研究[6]表明,LKB1参与体内多种生物学过程:① LKB1能够抑制肿瘤细胞的增殖,阻滞细胞周期在G1期;② LKB1能够抑制mTOR通路的活性,减少细胞内蛋白合成;③ LKB1在细胞的极性调控中发挥着关键性作用。Wilkinson et al[7-8]发现,LKB1通过和STRAD蛋白形成复合物而活化后,能够在没有细胞间连接和其他极性诱导因素的条件下,使单个的小肠上皮细胞自发性形成顶-基极性。

图4 GST-Pull down验证HERC3与LKB1的相互作用
A: HERC3-HA+GST蛋白;B: HERC3-HA+GST-LKB1融合蛋白
近年来有大量研究[9-10]表明,LKB1不仅仅是PJS的致病基因,也是多种肿瘤发生的重要基因,如肺癌、乳腺癌、胃癌等,LKB1在肿瘤的发生、分化、转移中发挥至关重要的作用,在前列腺癌中LKB1通过AMPK通路发挥其抑癌作用;在乳腺癌中,LKB1-AMPK通过作用于mTOR发挥其抑癌作用。
HERC3作为同源E6-AP羧基末端结构域家族的泛素连接酶E3,可以直接催化靶蛋白的泛素化。已有研究[11]显示,在胃癌、结肠癌中HERC3存在突变。HERC3与hPLIC-1和hPLIC-2相互作用并定位于晚期内涵体和溶酶体[12]。HERC3通过其E3连接酶功能泛素化并促进NF-KB RelA降解,进而负调NF-κB信号通路[13]。
泛素化修饰属于蛋白质翻译后修饰的一种,通过泛素-蛋白酶系统介导参与的调节蛋白质降解的过程,普遍存在于真核细胞中。泛素化修饰对于蛋白质的稳定性、亚细胞定位及信号转导过程等具有重要的调节功能。其中泛素连接酶E3决定了底物识别的特异性并最终催化底物蛋白的泛素化过程。HERC3属于膜转运所涉及的E3泛素连接酶家族,主要分布在胞质。该家族一般包含一个同源E6-AP羧基末端结构域和一个或多个染色体浓缩调节因子1相似结构域(RCC1-like结构域), LKB1在胞质也有分布,而且LKB1的主要功能也与其胞质部分相关[14]。
对于LKB1在疾病中的确切分子机制目前仍未明确,本研究采用酵母双杂交方法成功筛选出HERC3与LKB1在体内存在相关作用,同时利用免疫共沉淀实验以及GST-Pull down实验分别在体内外对二者的相互作用进行进一步验证。结果显示LKB1在体内外均可以有效地结合HERC3,说明了其相互作用的可靠性。提示HERC3有可能通过与LKB1特异性的结合进而影响LKB1所参与体内多种生物学过程。对于HERC3可能涉及或参与调控LKB1作用的方式还有待于进一步的研究与探索,可能对肿瘤的诊断治疗、为药物开发提供靶点及理论指导具有一定的意义。
[1] Korsse S E, Van Leerdam M E, Dekker E. Gastrointestinal diseases and their oro-dental manifestations: Part 4: Peutz-Jeghers syndrome[J]. Br Dent J,2017, 222(3):214-7.
[2] Chen C, Zhang X, Wang D, et al.Genetic screening and analysis of LKB1 gene in Chinese patients with peutz-jeghers syndrome[J].Med Sci Monit, 2016, 22:3628-40.
[3] Liemburg-Apers D C, Wagenaars J A, Smeitink J A, et al. Acute stimulation of glucose influx upon mitoenergetic dysfunction requires LKB1, AMPK, Sirt2 and mTOR-RAPTOR[J].J Cell Sci, 2016, 129(23):4411-23.
[4] Han J, Liang H, Tian D,et al. mTOR remains unchanged in diet-resistant (DR) rats despite impaired LKB1/AMPK cascade in adipose tissue[J].Biochem Biophys Res Commun, 2016, 476(4):333-9.
[5] Sundararaman A, Amirtham U, Rangarajan A.Calcium-oxidant signaling network regulates amp-activated protein kinase (AMPK) activation upon matrix deprivation[J].J Biol Chem, 2016, 291(28):14410-29.
[6] Shan T,Xu Z,Liu J, et al.Lkb1 regulation of skeletal muscle development, metabolism and muscle progenitor cell homeostasis[J]. J Cell Physiol, 2017,232(10):2653-6.
[7] Wilkinson S, Hou Y, Zoine J T,et al.Coordinated cell motility is regulated by a combination of LKB1 farnesylation and kinase activity[J].Sci Rep, 2017, 7:40929.
[8] Rungsung I, Ramaswamy A.Insights into the structural dynamics of liver kinase B1 (LKB1) by the binding of STe20 related adapter α (STRADα) and mouse protein 25α (MO25α) co-activators[J]. J Biomol Struct Dyn, 2017, 35(5):1138-52.
[9] Strazisar M, Mlakar V, Rott T, et al. Somatic alterations of the serine/threonine kinase LKB1 gene in squamous cell (SCC) and large cell (LCC) lung carcinoma[J]. Cancer Invest, 2009, 27(4):407-16.
[10] Sun A, Li C, Chen R, et al. GSK-3β controls autophagy by modulating LKB1-AMPK pathway in prostate cancer cells[J]. Prostate, 2016, 76(2):172-83.
[11] Yoo N J, Park S W, Lee S H. Frameshift mutations ofubiquitination-related genes HERC2, HERC3, TRIP12, UBE2Q1and UBE4B in gastric and colorectal carcinomas with microsatellite instability[J]. Pathology, 2011, 43(7):753-5.
[12] Hochrainer K, Kroismayr R, Baranyi U, et al. Highly homologous HERC proteins localize to endosomes and exhibit specific interactions with hPLIC and Nm23B[J].Cell Mol Life Sci, 2008, 65(13):2105-17.
[13] Hochrainer K, Pejanovic N, Olaseun V A, et al. The ubiquitinligase HERC3 attenuates NF-κB-dependent transcriptionindependently of its enzymatic activity by delivering the RelA subunit for degradation[J]. Nucleic Acids Res, 2015, 43(20):9889-904.
[14] Russo G L,Russo M,Ungaro P. AMP-activated protein kinase:a target for old drugs againstdiabetes and cancer[J].Biochem Pharmacol,2013, 86(3):339-50.
