BMP-7诱导大鼠骨髓间充质干细胞向神经元细胞分化的初步研究
2018-03-30白广超金宏亮李宽新
白广超,金宏亮,雷 堃,李宽新
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)存在于骨髓基质中,具有取材方便、来源广泛的特点,是组织工程中理想的种子细胞[1]。BMSCs是来源于中胚层的多能干细胞,在适当的诱导条件下可以向骨、软骨及心肌细胞分化。近期研究[2]表明,BMSCs还具有跨胚层分化的能力,可以向外胚层的神经细胞分化,这一发现得到了脊髓损伤研究领域的高度关注。因此,BMSCs在脊髓损伤的细胞移植治疗中具有重要的研究意义及临床应用价值。
骨形态发生蛋白7(bone morphogenetic protein 7,BMP-7)是β转化因子超级家族中的一员,最早是由于其出色的成骨诱导特性被发现的。目前研究[3]表明BMP-7在哺乳动物的神经组织中也有表达,并在神经系统的发育过程中发挥了重要的作用。胡岚翔 等[4]在研究中发现,BMP-7在正常脊髓组织中的表达量很微弱,在大鼠脊髓损伤后表达量增加,在脊髓损伤的早期起到了保护作用。该研究以BMP-7为诱导剂在适宜的条件下诱导大鼠BMSCs,探讨BMP-7是否具有诱导大鼠BMSCs向神经元细胞分化的能力,为脊髓损伤的细胞移植治疗开辟一条新的途径。
1 材料与方法
1.1实验动物SD大鼠(10只,雄性,4~6周龄,100 g左右,SPF级)由石河子大学医学院实验动物中心提供。大鼠给予标准饲料喂养,适应1周后进行实验,所有实验在符合动物实验伦理要求下进行。
1.2主要试剂BMP-7(美国R&D公司);DMEM-HG培养基(美国Gibco公司);胎牛血清(奥地利PAA公司);双抗、胰蛋白酶(美国Hyclone公司);L-维生素C、吲哚美辛(青岛捷世康生物科技有限公司);B27(北京Engreen公司);NF-200鼠抗(Mouse Anti-NF200)、SYN-1兔抗(Rabbit Anti-Synapsin 1)、SABC免疫组化染色试剂盒、DBA显色剂(武汉博士德公司);胰岛素(美国Sigma公司);地塞米松(上海永叶生物科技有限公司);CD29、CD44流式抗体(美国BioLegend公司)。
1.3主要仪器荧光倒置相差显微镜(德国蔡司公司);流式细胞仪(深圳迈瑞生物医疗电子股份有限公司);酶联免疫检测仪(美国Thermo Scientific公司);水浴锅(上海博迅公司);CO2培养箱(北京阿尔泰科技发展有限公司);纯水器(成都超纯科技有限公司)。
1.4实验方法
1.4.1大鼠BMSCs的提取、分离和培养 取1只SD大鼠,进行称重、记录,以颈椎脱臼法处死,腹部剪“十”字后,打开腹腔,逐渐分离出股骨及胫骨,分离出的股骨、胫骨放入75%酒精中浸泡5 min后再放入PBS内,转入生物安全柜,组织剪剪除股骨、胫骨两端,露出骨髓腔,2.5 ml注射器抽取完全培养液交替冲洗骨头两端,直至骨头呈现为透明。收集细胞悬液,反复吹打。细胞计数板进行细胞计数,调整细胞密度为1×107个/ml接种至25 cm2培养瓶中, 37 ℃、5% CO2培养箱中培养。
细胞培养至48 h后进行半换液,随后每3 d进行全换液。待到细胞融合至80%左右时以0.25% 胰蛋白酶进行消化,按1 ∶2进行传代培养。
1.4.2流式细胞仪检测大鼠BMSCs表面标志物 取第3代大鼠BMSCs 1×106个细胞进行CD29-PE,CD44-FITC染色,以不含抗体的细胞为阴性对照组,避光、室温环境孵育30 min,随后进行流式细胞仪检测。
1.4.3大鼠BMSCs成脂诱导及油红O染色鉴定 成脂诱导:取培养至第3代的大鼠BMSCs接种至6孔板,按2×105个/孔进行接种,培养至24 h加入成脂诱导液(94.498%DMEM+4%FBS+1%双抗+0.4%地塞米松+0.1%胰岛素+0.002%吲哚美辛),每3 d进行全换液及倒置相差显微镜下观察细胞形态。诱导至28 d,进行油红O染色鉴定脂肪细胞。
油红O染色:储备液和稀释液按照5 ∶2混匀后用漏斗过滤,以PBS洗细胞两遍,加应用液,15 min后弃去应用液,以PBS洗2遍,纯水洗2遍,加复染液进行复染,5 min后弃去复染液,PBS洗2遍,纯水洗3遍,滴加封固剂进行封片,置于倒置相差显微镜下观察。
1.4.4MTT法检测不同浓度BMP-7对BMSCs增殖的影响 取第3代BMSCs,分为调零组、对照组(DMEM+FBS)、BMP-7干预组(DMEM+FBS+25、50、75、100 ng/ml BMP-7),设置6个时间点,每个时间点设置5个复孔。调整细胞悬液密度接种到96孔板,每孔种8×103个细胞,补充培养液至200 μl,边缘孔用无菌生理盐水填充,置于5% CO2、37 ℃培养箱内培养。培养24 h后换各组对应的培养液。随后每天测定A490 nm:每孔加入20 μl MTT 溶液(5 mg/ml),继续培养4 h。弃去培养液后每孔加入150 μl 二甲基亚砜。置于酶联免疫检测仪中,设置震荡10 min,测各孔490 nm处吸光度,绘制曲线。
1.4.5大鼠BMSCs的诱导分化 取第3代大鼠BMSCs,调整密度为4×104个/ml接种到48孔板,每孔接种500 μl细胞悬液,置于5% CO2、37 ℃培养箱内培养。培养2 h后,弃去培养液,换为诱导液,细胞随机分为3组:① 阴性对照组:DMEM-HG+10%胎牛血清;② 阳性对照组:DMEM-HG+β-巯基乙醇(5 mmol/L);③ BMP-7诱导组:DMEM-HG+BMP-7(75 ng/ml)。各组细胞诱导开始后每隔1 h置于倒置相差显微镜下观察细胞形态学变化。
1.4.6免疫组化法检测各实验组神经元标志物NF-200及SYN-1的表达 取各实验孔,弃诱导液,冰的4%多聚甲醛室温下固定30 min,PBS冲洗5 min×3次。3% H2O2室温浸泡30 min,蒸馏水冲洗5 min×3次,滴加5%BSA封闭液,室温20 min,弃多余液体,加一抗(NF-200、SYN-1),4 ℃过夜。PBS冲洗2 min×3次,滴加二抗,室温孵育20 min,PBS冲洗2 min×3次,滴加试剂SABC,室温孵育20 min。随后进行DAB显色,苏木精轻度复染染核约1 min,用1% HCl酒精洗涤10 s。酒精梯度脱水,二甲苯透明,中性树脂封片,在倒置相差显微镜下观察。
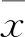
2 结果
2.1大鼠BMSCs的形态学观察骨髓细胞接种于培养瓶后,细胞呈圆型,大小不一,悬浮于培养液中。2 d半换液后可见部分细胞已贴壁,贴壁细胞呈短梭形或多角形。第5天进行全换液去除未贴壁的杂质细胞,可见短梭形、星形细胞分散贴壁生长,以梭形细胞为主,胞质丰富,胞核大、核仁清晰。培养至8 d细胞融合约90%,进行传代,消化传代后,传代细胞4 h完全贴壁生长,细胞形态均一呈梭形,细胞生长旺盛,3 d可进行下一次传代。细胞传至第3代时,细胞聚集生长呈“鱼尾纹”状,见图1。

图1 倒置相差显微镜下第3代大鼠BMSCs ×200
2.2大鼠BMSCs的鉴定
2.2.1大鼠BMSCs的细胞表型(CD29、CD44)鉴定结果 流式细胞仪检测结果显示:培养的第3代大鼠BMSCs均一表达CD29、CD44,阳性率分别为99.44%、99.17%,见图2。
2.2.2大鼠BMSCs的成脂诱导及油红O染色 诱导后细胞大小未发生明显变化,形态由原先的长梭条形变为不规则形,分散生长在培养瓶底。诱导2周后胞质中出现大小不一的圆形脂滴,聚集分布在胞质边缘,随着诱导时间的延长逐渐增大增多,经油红O染色后成橘红色,见图3。
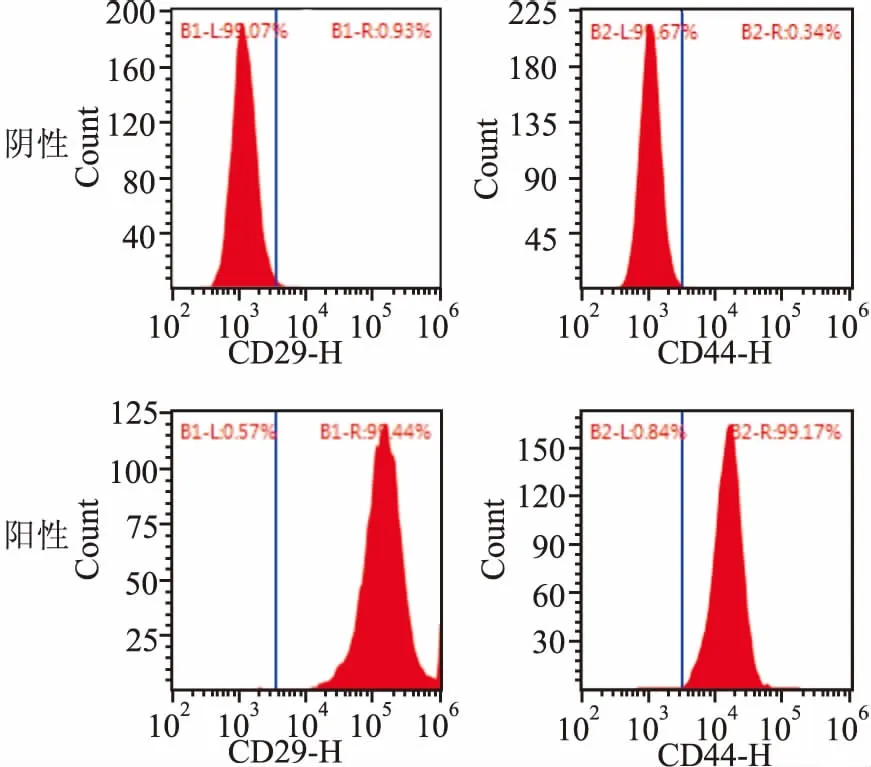
图2 流式细胞仪检测CD29、CD44的表达
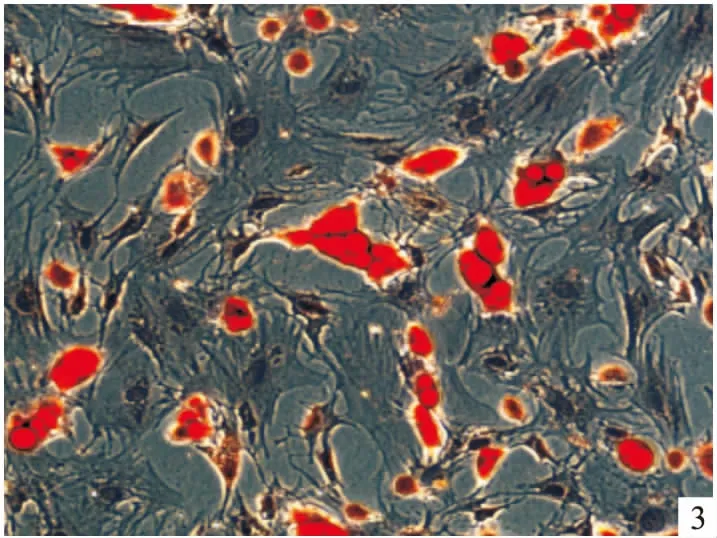
图3 大鼠BMSCs成脂诱导后油红O染色 ×200
2.3不同浓度BMP-7对大鼠BMSCs增殖的影响各组细胞接种后均出现短暂的停滞期,随后细胞生长加速,增殖明显,进入细胞生长对数期,第5天后增殖速度明显减慢,进入平台期。不同浓度BMP-7均对大鼠BMSCs增殖有促进作用,见表1,同一时间点5组细胞进行方差分析q检验,结果表明75 ng/ml BMP-7促进大鼠BMSCs增殖作用最显著,采用75 ng/ml BMP-7进行后续实验。
2.4大鼠BMSCs诱导后形态学观察① 阳性对照组:加入5 mmol/l β-巯基乙醇30 min后观察到部分细胞胞体折光性增强,细胞形成突起,随着诱导时间的延长突起的数量逐渐增多且长度逐渐增长,诱导1 h后可见典型的神经元样细胞形态改变,2 h后神经元样细胞明显增多,次级分支出现(图4B),6 h后神经元样细胞逐渐裂解、死亡。② BMP-7诱导组:与阳性对照组相比,含75 ng/mlBMP-7的诱导液加入后细胞形态学变化较阳性对照组出现早,细胞改变与阳性对照组相似,细胞突起较前者多,部分细胞突起与相邻细胞的突起形成连接(图4C红色箭头处可见),由于2 h后神经元样细胞数量达到最多,故后续观察及免疫细胞化学检测时间点均选用2 h。③ 阴性对照组绝大多数细胞无明显形态学改变,未见较典型的神经元样细胞(图4A)。
2.5各组细胞经诱导后神经元标志物的表达情况阴性对照组不表达神经丝蛋白NF-200及突触素SYN-1,阳性对照组及BMP-7诱导组均有细胞表达NF-200及SYN-1,可见NF-200及SYN-1阳性细胞胞质被染成亮棕黄色,NF-200及SYN-1阳性颗粒分布于胞体和轴突,见图5。
3 讨论
脊髓损伤的治疗与修复是当前世界性的医学难题。脊髓损伤后局部神经元细胞大量死亡,直接引起反射弧及神经传导的中断,再加上局部炎性因子的升高及细胞死亡裂解后释放的有毒物质,形成了一系列不利于神经细胞生存的内环境。传统的药物+手术的治疗方法只能减轻脊髓受损部位的水肿情况及恢复脊柱的稳定性,而受损的神经元由于其为永久性细胞则不能得到补充,在此种情景下快速直接地补充神经元细胞或干细胞显得尤为重要[5]。BMSCs来源广、取材易、排斥小,目前研究[6]证实其具有跨胚层向神经细胞分化的能力,故BMSCs是治疗脊髓损伤理想的“种子细胞”。目前在体外诱导BMSCs向神经细胞分化的方法主要有3种: 化学诱导、生长因子诱导和中药成分诱导。化学诱导剂中以β-巯基乙醇应用最为广泛,Darabi et al[7]在研究中利用β-巯基乙醇诱导大鼠BMSCs,诱导得到的细胞形态上与神经元细胞类似,且阳性表达神经元细胞标志物,因此本研究选取其为阳性对照。BMP-7是骨形态发生蛋白家族重要的一员,目前研究[8]显示骨形态发生蛋白家族几乎无所不能,其信号通路涉及细胞增殖与分化、胚胎发育、器官形成、组织修复与再生甚至癌症的发生。BMP-7最早被发现具有成骨能力,近年来越来越多的研究揭示了BMP-7与神经损伤修复关系密切,Luan et al[9]发现提高BMP-7的表达量可以减轻缺血缺氧对神经系统造成的损伤,推断BMP-7具有修复受损神经系统作用。因此本研究推测BMP-7可以诱导BMSCs向神经元细胞分化,从而在脊髓损伤中起神经保护作用。

表1 各时间点不同浓度BMP-7干预组在490 nm处吸光度值(n=5)

图4 大鼠BMSCs诱导2 h形态学观察 ×200A:阴性对照组;B:阳性对照组;C:BMP-7诱导组
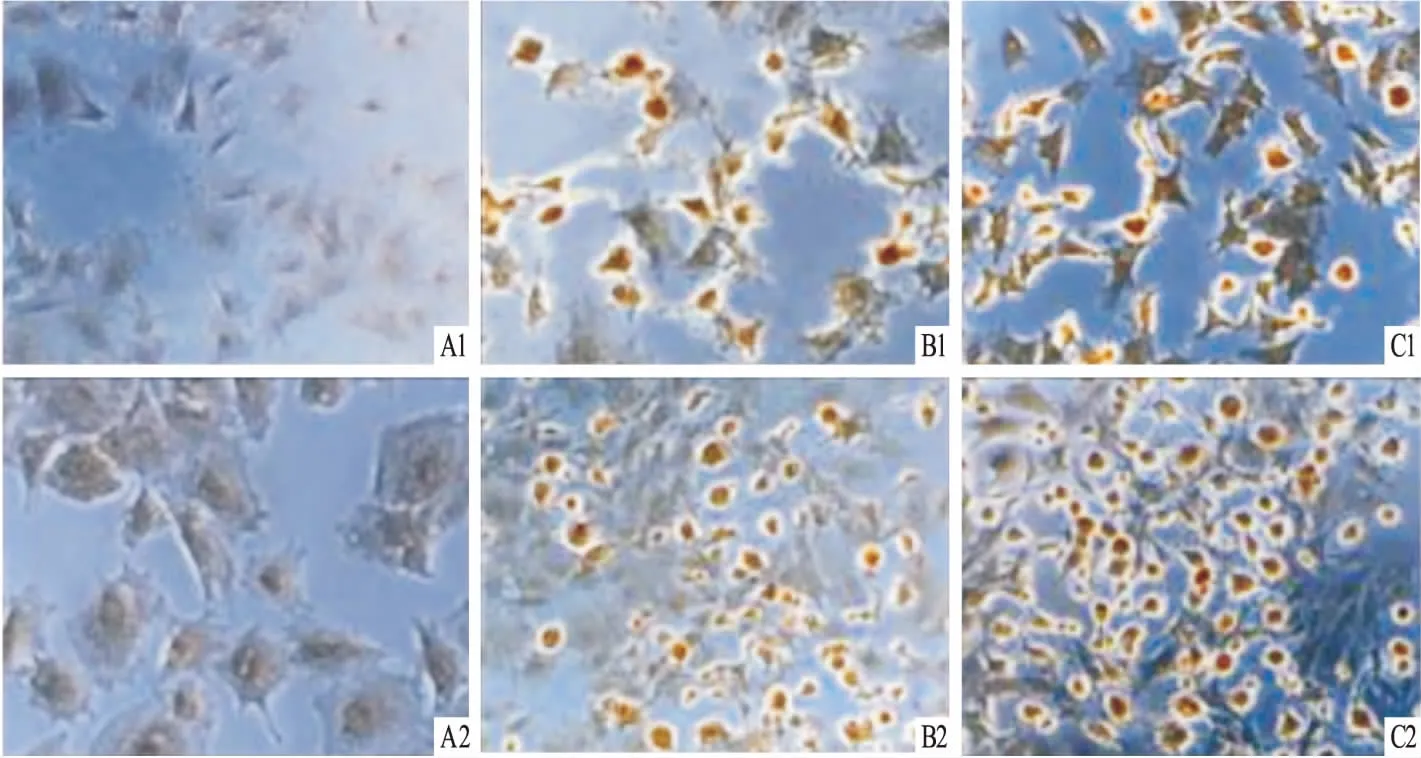
图5 各诱导组神经元标志物的表达 ×200A:阴性对照组;B:阳性对照组;C:BMP-7诱导组;1:NF-200;2:SYN-1
本实验利用全骨髓贴壁法分离、培养大鼠BMSCs,应用流式细胞仪检测第3代细胞表面标志物的表达,结果CD29、CD44阳性表达,表达率分别为99.44%、99.17%,提示所分离培养的细胞为纯度较高的BMSCs。随后对第3代大鼠BMSCs进行成脂诱导,结果为阳性,证明所得到的BMSCs具有良好的分化能力。利用MTT法测定不同浓度的BMP-7对BMSCs增殖的影响,结果显示BMP-7可以促进大鼠BMSCs的增殖,抑制其凋亡,其中75 ng/ml BMP-7效果最为显著。故本实验选取纯度较高且分化能力良好的第3代大鼠BMSCs及75 ng/ml的BMP-7进行下一步的诱导实验研究。
本实验使用75 ng/ml的BMP-7对贴壁培养2 h的大鼠BMSCs进行诱导, 诱导2 h后大部分细胞形态发生变化,形成轴突和树突,细胞之间形成联系,这些变化与阳性对照组相同,而阴性对照组无明显变化。进行免疫细胞化学实验检测神经标志物表达情况,结果显示NF-200及SYN-1均为阳性,NF-200在神经元细胞内合成、储存,是构成神经元胞体和神经轴突细胞骨架的主要成分,在维持神经元细胞独特的形态特征、轴浆运输、大脑发育以及神经元再生和可塑性方面发挥着重要作用[10-12];SYN1 是分布于突触前囊泡膜上的糖蛋白,参与神经递质的释放及突触可塑性的调节,其表达量的高低反映了突触的形成和密度[13-15]。本研究结果显示, 诱导后2 h 的NF-200表达阳性, 表明BMP-7诱导大鼠BMSCs不仅形态上发生了变化,而且在分子水平上也发生了改变,阳性表达了神经元细胞特异性标志物,证明BMP-7成功诱导大鼠BMSCs向神经元样细胞分化;突触素SYN1同样阳性表达,表明诱导得到的神经元样细胞不仅在形态上及标志物表达上与神经元细胞接近,还有可能形成了完整的突触,具有神经元细胞的神经传递功能。
近年来研究[15-17]表明BMP-2及BMP-4在BMSCs的神经元细胞分化过程中起抑制作用,而同为骨形态发生蛋白家族的BMP-7在本实验中证实其可以诱导大鼠BMSCs向神经元细胞分化。目前BMP-2及BMP-4的生理作用及相关信号通路研究较多且取得了较多成果,而BMP-7的信号通路争议点依然很多。本研究开创性的使用BMP-7诱导大鼠BMSCs向神经元细胞分化,成功诱导了大鼠BMSCs分化为神经元样细胞,为脊髓损伤的干细胞治疗提供了新的思路,但诱导得到的神经元样细胞是否具有完整的神经元细胞的神经传递功能及其具体的诱导机制尚需进一步的研究。
[1] Gu C, Li H, Wang C, et al. Bone marrow mesenchymal stem cells decrease CHOP expression and neuronal apoptosis after spinal cord injury[J]. Neurosci Lett,2017,636:282-9.
[2] Xu J, Lu H, Miao Z N, et al. Immunoregulatory effect of neuronal-like cells in inducting differentiation of bone marrow mesenchymal stem cells[J]. Eur Rev Med Pharmacol Sci,2016,20(24):5041-8.
[3] Liu F, Placzek M. Axon guidance effects of classical morphogens Shh and BMP7 in the hypothalamo-pituitary system[J]. Neurosci Lett, 2014, 562:108-13.
[4] 胡岚翔. BMP-7对大鼠(环扎法)急性脊髓损伤后GFAP的表达的影响[D]. 芜湖:皖南医学院, 2014.
[5] Badner A, Siddiqui A M, Fehlings M G. Spinal cord injuries: how could cell therapy help[J]. Expert Opin Biol Ther, 2017,17(5):529-41.
[6] Zheng Y, Huang C, Liu F, et al. Comparison of the neuronal differentiation abilities of bone marrowderived and adipose tissuederived mesenchymal stem cells[J]. Mol Med Rep, 2017,16(4):3877-6.
[7] Darabi S, Tiraihi T, Delshad A R, et al. A new multistep induction protocol for the transdifferentiation of bone marrow stromal stem cells into GABAergic neuron-like cells[J].Iran Biomed J,2013,17(1):8-14.
[8] Park Y M, Lee W T, Bokara K K, et al. The multifaceted effects of agmatine on functional recovery after spinal cord injury through modulations of BMP-2/4/7 expressions in neurons and glial cells[J]. PLoS One,2013,8(1):e53911.
[9] Luan L, Yang X, Zhou C, et al. Post-hypoxic and ischemic neuroprotection of BMP-7 in the cerebral cortex and caudate-putamen tissue of rat[J]. Acta Histochem,2015,117(2):148-54.
[10] Wang L J, Zhang R P, Li J D. Transplantation of neurotrophin-3-expressing bone mesenchymal stem cells improves recovery in a rat model of spinal cord injury[J]. Acta Neurochir (Wien),2014,156(7):1409-18.
[11] Jia Y, Wu D, Zhang R, et al. Bone marrow-derived mesenchymal stem cells expressing the Shh transgene promotes functional recovery after spinal cord injury in rats[J]. Neurosci Lett,2014,573:46-51.
[12] Okuda A, Horii-Hayashi N, Sasagawa T, et al. Bone marrow stromal cell sheets may promote axonal regeneration and functional recovery with suppression of glial scar formation after spinal cord transection injury in rats[J]. J Neurosurg Spine,2017,26(3):388-95.
[13] Manthou M, Abdulla D S, Pavlov S P, et al. Whole body vibration (WBV) following spinal cord injury (SCI) in rats: Timing of intervention[J]. Restor Neurol Neurosci,2017,35(2):185-216.
[14] Yin Y M, Lu Y, Zhang L X, et al. Bone marrow stromal cells transplantation combined with ultrashortwave therapy promotes functional recovery on spinal cord injury in rats[J]. Synapse,2015,69(3):139-47.
[15] Jiqing C, Yaqin L, Yingyin L, et al. BMP4 inhibits myogenic differentiation of bone marrow-derived mesenchymal stromal cells in mdx mice[J]. Cytotherapy, 2015,17(9):1213-9.
[16] 李海太, 申才良, 宋旆文,等. BMP-4对大鼠骨髓间充质干细胞与神经干细胞共培养转归影响的实验研究[J]. 安徽医科大学学报, 2016, 51(2):205-9.
[17] Saxena M, Prashar P, Yadav P S, et al. Mouse bone marrow stromal cells differentiate to neuron-like cells upon inhibition of BMP signaling[J]. Differentiation,2016,92(1-2):1-9.
