网膜素-1对结肠癌干细胞增殖凋亡的影响及其机制研究
2018-03-30万丽娟张群慧陈明卫
万丽娟,张群慧,陈明卫,季 华
目前已公认肥胖与结肠癌密切相关,但发病机制尚不明确。近年来有研究[1]提示脂肪组织分泌的脂肪因子可能是联系肥胖与结肠癌发生发展的关键因素。网膜素-1(Omentin-1)是脂肪细胞分泌的一种脂肪因子,前期临床研究[2]结果显示血浆Omentin-1水平与结肠癌发生密切相关,体外实验显示Omentin-1可促进结肠癌细胞株SW480的增殖。目前有研究[3]表明肿瘤干细胞与肿瘤的发生发展、复发转移以及放化疗抵抗有关,关于Omentin-1对结肠癌干细胞的作用目前国内外尚未见报道。该研究通过体外实验探讨Omentin-1对结肠癌干细胞增殖、凋亡的影响,为未来结肠癌的诊断和治疗提供新的思路。
1 材料与方法
1.1材料人结肠癌细胞株SW480(中科院上海细胞库);免疫磁珠分选器及分选架(美国Miltenyi公司);CD133间接免疫磁珠试剂盒、MS分选柱(德国Miltenyi公司);高糖DMEM培养基、DMEM-F12培养基(美国HyClone公司);胎牛血清(杭州四季青生物科技公司);重组人表皮生长因子、重组人碱性成纤维生长因子(美国Peprotech公司);B27添加物(50×)(美国Gibco公司);白血病抑制因子(南京维森特生物技术有限公司);磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/丝/苏氨酸蛋白激酶(serine-threonine kinase, Akt)信号通路抑制剂(LY294002)(上海碧云天生物技术研究所);CCK-8细胞增殖试剂盒、Annexin V-FITC细胞凋亡试剂盒(上海贝博生物公司);Omentin-1(武汉优尔生公司)。
1.2结肠癌干细胞免疫磁珠分选用含10%胎牛血清、100 U/ml青霉素、100 U/ml链霉素的高糖DMEM培养基,在37 ℃、5%CO2培养箱中培养SW480结肠癌细胞。取生长对数期的SW480结肠癌细胞,胰酶消化后细胞计数2×107个,离心后弃上清液,使用350 μl含0.5%胎牛血清、2 mmol/L 乙二胺四乙酸的缓冲液重悬,形成单细胞悬液。依次加入受体阻断剂100 μl和CD133/1(AC133)-Biotin 抗体50 μl,混匀后置于4 ℃冰箱孵育10 min,加入缓冲液5 ml清洗2遍,后以1 330 r/min离心10 min,弃去上清液,重悬于400 μl缓冲液中,加入100 μl抗Biotin微珠,4 ℃冰箱孵育15 min。再次用缓冲液清洗细胞2次,并充分重悬于500 μl缓冲液中备用。将标记好的CD133抗体的细胞悬液加入安装好的分选柱中,待细胞悬液自然流尽,PBS洗柱3次,每次均自然流尽,从磁场中取下分选柱,用1 ml PBS快速冲洗分选柱中细胞,收集于培养板中,即为CD133+结肠癌干细胞。
1.3CD133+结肠癌干细胞的培养将CD133+结肠癌干细胞接种于超低黏附6孔板中,每孔加入2 ml DMEM-F12无血清培养基,37 ℃、5%CO2温箱中孵育,采用离心换液法每3 d更换新鲜培养基,当细胞培养至对数生长期,倒置显微镜下观察多数细胞形成干细胞球时(80%)进行传代。
1.4结肠癌干细胞的鉴定结肠癌干细胞培养至对数生长期,收集细胞离心后弃上清液,用PBS清洗2次并离心,接种于96孔板中,加入含10% 胎牛血清的高糖DMEM培养基诱导细胞分化,观察干细胞分化贴壁情况。同时将对数生长期的结肠癌干细胞消化重悬为单个细胞,分为阴性对照组和CD133组,每组计数2×106个细胞,PBS清洗2次后,加入500 μl PBS重悬细胞。阴性对照组只加2 μl PE染色,4 ℃避光孵育,不加CD133抗体,而CD133组先加入CD133抗体2 μl,4 ℃冰箱避光孵育1 h后,用PBS清洗1次,再加入PE 2 μl染色,4 ℃避光孵育15 min后。立即用流式细胞仪检测两组CD133含量。
1.5实验分组观察不同浓度Omentin- 1对结肠癌干细胞增殖、凋亡的影响,并探讨Omentin- 1对PI3K/Akt信号通路的影响,实验分为5组:对照组、Omentin 1组(1 μg/ml Omentin-1)、Omentin 2组(2 μg/ml Omentin-1)、Omentin LY组(1 μg/ml Omentin-1和50 μmol/L LY294002)、LY组(50 μmol/L LY294002),每组设4个复孔。
1.6CCK-8法检测结肠癌干细胞增殖情况将对数生长期的结肠癌干细胞以1.5×105个接种于96孔板中,每孔加入100 μl培养基,按分组条件干预细胞24 h后,每孔加入10 μl CCK-8,避光孵育3 h,酶标仪450 nm处检测吸光度(optical density,OD)值,实验重复3次。为进一步了解Omentin-1对结肠癌干细胞增殖的时间效应关系,应用1 μg/ml Omentin-1分别干预0、1、6、24、48 h后,加入CCK-8试剂10 μl,避光孵育2 h,酶标仪450 nm处检测OD值,实验重复3次。
1.7流式细胞仪检测结肠癌干细胞凋亡情况取对数生长期的结肠癌干细胞以每孔2×106个接种在6孔板中,每孔2 ml DMEM-F12培养基,按分组条件干预细胞24 h后,收集细胞后800 r/min离心5 min,PBS清洗2次,细胞重悬于400 μl结合液,5 μl Annexin V-FITC混匀,4 ℃避光孵育15 min,再加入10 μl PI 4 ℃避光孵育5 min,立即用流式细胞仪检测,实验重复3次。采用Flowjo V7软件分析结果。
1.8Westernblot检测不同浓度Omentin-1干预后Akt、pAkt蛋白表达取对数生长期的结肠癌干细胞,每孔2×107个接种于6孔板中,按分组条件干预,培养24 h后收集细胞并提取总蛋白,BCA法测定蛋白浓度。加入25 μl蛋白上样缓冲液(5×)。按实验分组依次将蛋白上样,电泳1 h分离,200 mA稳流2 h转移至NC膜上。5%封闭液封闭1~2 h,TBST缓冲液洗膜3次,分别加入β-actin(1 ∶2 000)、Akt(1 ∶1 000)、p-Akt(1 ∶1 000),4 ℃孵育一抗过夜,洗膜3次,5%封闭液加入二抗1 μl(1 ∶8 000),摇床上低速室温孵育二抗1 h,再次洗膜3次后滴加显影液显影。Quantity One凝胶成像软件分析相对灰度值。
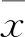
2 结果
2.1结肠癌干细胞鉴定克隆球形成:应用倒置显微镜观察,结肠癌干细胞在无血清培养基中培养,第1天可见小的干细胞球形成,数量少;第5天可见明显干细胞球形成;第10天干细胞球进一步增大且变圆;干细胞球在无血清培养基中呈悬浮生长,见图1。
分化实验结果:应用倒置显微镜观察,结肠癌干细胞接种于含10%胎牛血清培养基中,第3天仍可见干细胞球,大部分悬浮生长,小部分细胞从细胞球中逸出贴壁呈梭形;第7天大部分干细胞球逐渐贴壁,呈梭形;第9天干细胞球全部分化成为梭状的结肠癌SW480细胞,呈贴壁生长,且梭形细胞数量较第7天时增多,见图2。
流式细胞仪检测CD133结果:结肠癌干细胞表面标志物CD133+细胞群含量达80.3%,见图3。
2.2Omentin-1对结肠癌干细胞增殖的影响与对照组比较,Omentin 1组、Omentin 2组、Omentin LY组、LY组OD值均明显降低(F=37.068,P<0.05);Omentin 2组、Omentin LY组的OD值较1 μg/ml Omentin-1作用于结肠癌干细胞0、1、6、24、48 h后,随干预时间增加,OD值呈逐渐下降趋势,差异有统计学意义(F=126.009,P<0.05)。

图1 倒置显微镜下观察结肠癌干细胞球生长 ×400A:第1天;B:第5天;C:第10天
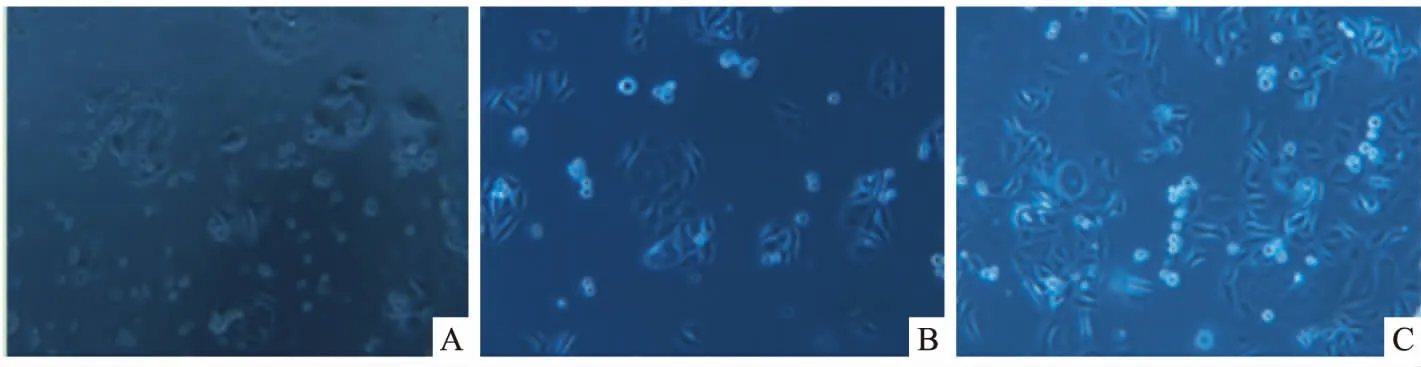
图2 倒置显微镜下观察结肠癌干细胞分化情况 ×200A:第3天;B:第7天;C:第9天
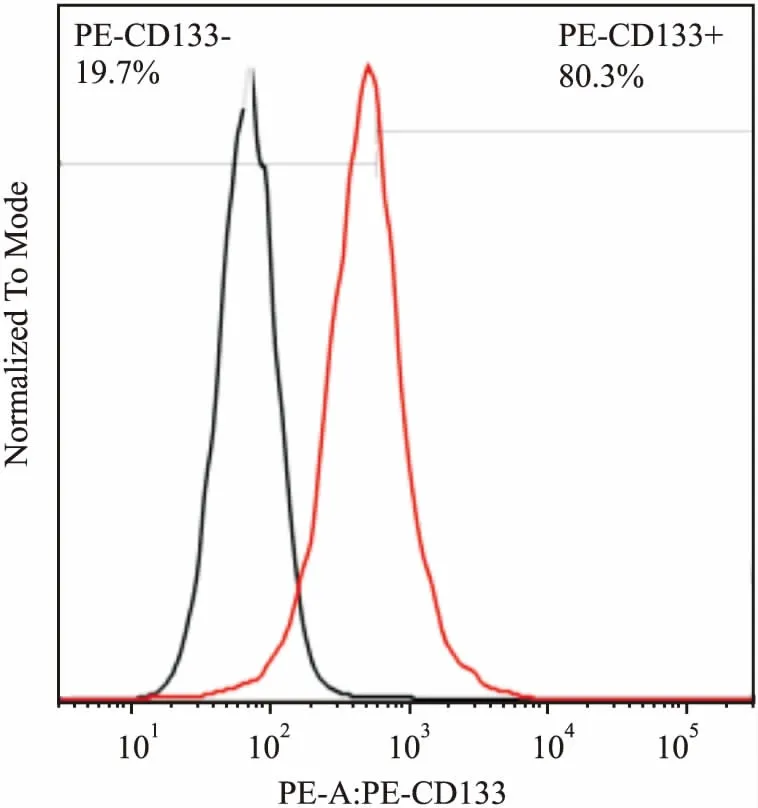
图3 流式细胞仪鉴定结肠癌干细胞表面标志物CD133PE-CD133+:CD133阳性细胞群
Omentin 1组更低,Omentin LY组 OD值低于LY组,差异均有统计学意义(F=37.068,P<0.05),见图4。
2.3Omentin-1对结肠癌干细胞凋亡的影响Omentin 1组、Omentin 2组、Omentin LY组、LY组的细胞凋亡率分别为(17.10±0.86)%、(36.52±1.26)%、(34.35±4.21)%、(23.08±4.99)%,与对照组(5.75±3.48)%比较均上升,差异有统计学意义(F=42.305,P<0.05)。Omentin 2组、Omentin LY组的细胞凋亡率较Omentin 1组更高,Omentin LY组的细胞凋亡率高于LY组,差异均有统计学意义(F=42.305,P<0.05),见图5。
2.4Omentin-1对pAkt/Akt表达的影响与对照组相比,随着Omentin-1浓度的增加, Akt蛋白表达量有所下降,pAkt蛋白表达量呈明显下降趋势, pAkt/Akt比值逐渐下降。与对照组相比,Omentin 1组pAkt/Akt表达降低,但差异无统计学意义,而Omentin 2组则显著降低(F=5.200,P<0.05),见图6。
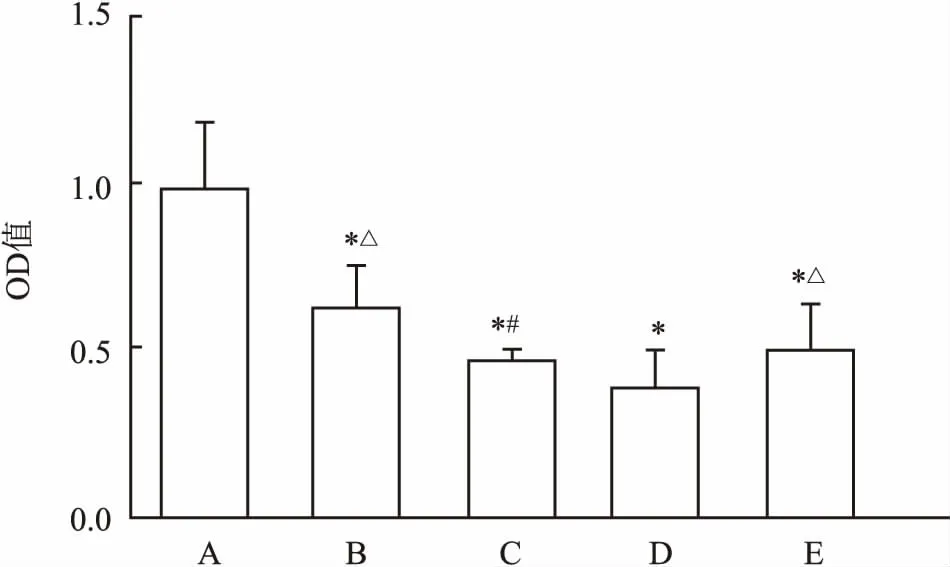
图4 不同浓度Omentin-1对结肠癌干细胞活力的影响及与LY294002的相互作用
A:对照组;B:Omentin 1组;C:Omentin 2组;D:Omentin LY组;E:LY组;与对照组比较:*P<0.05;与Omentin 1组比较:#P<0.05;与Omentin LY组比较:△P<0.05
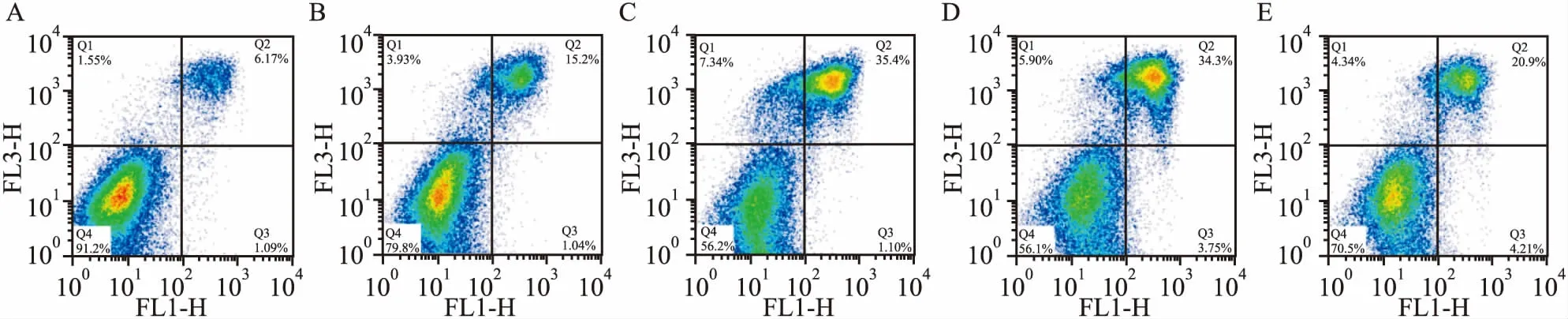
图5 流式细胞仪检测细胞凋亡A:对照组;B: Omentin 1组;C: Omentin 2组;D: Omentin LY组;E:LY组

图6 Omentin-1对pAkt/Akt表达的影响
A:对照组;B:Omentin 1组;C:Omentin 2组;与对照组比较:*P<0.05
3 讨论
Omentin-1是一种新型的分子量为34 ku的脂肪因子,主要表达于腹部脂肪组织的脂肪细胞中。已有研究[4-5]表明Omentin-1可能与一些恶性肿瘤,如胃癌、神经母细胞瘤等的发生发展存在密切联系。
Omentin-1与结直肠癌(colorectal cancer,CRC)之间也存在相关关系。本课题组前期研究[6]显示CRC患者和正常受试者血浆Omentin-1水平均与高密度脂蛋白呈正相关性,与三酰甘油、空腹胰岛素、腰臀比等呈负相关性。结肠癌患者癌组织中Omentin-1蛋白表达和mRNA水平高于癌旁组织,从结肠癌SW480细胞的细胞裂解液中检测出Omentin-1蛋白及mRNA表达,SW480细胞上清液中检测到Omentin-1蛋白表达[7]。体外实验显示Omentin-1可促进SW480结肠癌细胞增殖,抑制其凋亡[2]。CRC患者的血清Omentin-1、内脂素、丝氨酸蛋白酶抑制剂水平明显升高,并且这些脂肪因子可能通过各种机制对CRC发展直接产生作用,这种直接作用甚至有可能比通过肥胖与CRC之间联系的间接作用更重要[8]。也有前瞻性群组研究[9]表明,CRC患者血循环网膜素水平升高,提示Omentin-1与CRC风险增加有关,表明Omentin-1可以作为预测CRC风险的新型标志物。但是,有研究[10]显示无糖尿病的Ⅲ期结肠癌患者进行手术和奥沙利铂、5-氟尿嘧啶等化学药物治疗后,Omentin-1水平明显升高。TMEM207是一种不典型的跨膜蛋白,与Omentin-1的产生有关,在CRC细胞中用小干扰RNA使TMEM207基因沉默后,Omentin-1多聚泛素化增加、蛋白酶体降解,从而使Omentin-1分泌减少,结果可导致结直肠发生癌变,Omentin-1水平的下调可能导致进展期CRC患者预后不良[11]。虽然目前关于Omentin-1对结肠癌细胞的作用尚有相关报道,但对结肠癌干细胞的作用的研究未见报道。
结肠癌干细胞是结肠癌细胞中的一小部分细胞群,具有自我更新、无限增殖和多向分化的特性以及致瘤性。目前肿瘤干细胞的分选方法主要使用免疫磁珠法和流式细胞仪分选法,免疫磁珠法是国际公认的干细胞分选方法,操作简便、分选出的阳性细胞比例高。结肠癌干细胞的表面标志物包括CD133、CD44、LGR5等,其中CD133是结肠癌干细胞最具代表性的表面标志物之一。
本实验首先通过间接免疫磁珠分选法从结肠癌细胞株SW480中分选出CD133+结肠癌干细胞,采用克隆球形成实验和分化实验证实免疫磁珠分选及无血清培养基培养的CD133+干细胞具有肿瘤干细胞的无限增殖和多向分化能力,并通过流式细胞仪鉴定分选后细胞中CD133含量达80.3%,与相关研究[12-13]结果一致。通过不同浓度Omentin-1和不同时间点作用于结肠癌干细胞后显示,Omentin-1可抑制结肠癌干细胞增殖,促进其凋亡,且这种作用呈时间-浓度依赖性。此外,本研究还显示Omentin-1与LY294002共同作用于结肠癌干细胞后,抑制增殖及促进凋亡作用均较单一作用时加强,具有协同作用。
丝苏氨酸蛋白激酶/蛋白激酶B属于PI3K信号通路。PI3K信号通路是刺激生长因子的核心信号通路,PI3K通过其下游分子Akt活化后刺激各种恶性肿瘤细胞内信号,抑制肿瘤细胞凋亡,促进增殖;反之,Akt信号通路抑制可以使一些恶性肿瘤细胞凋亡。在很多肿瘤中都显示存在PI3K/Akt通路异常,如非小细胞肺癌、胃癌、胰腺癌、乳腺癌、前列腺癌,Akt信号通路激活在结肠癌细胞的增殖和凋亡中也起重要作用。LY294002是PI3K/Akt通路的抑制剂,可降低Akt蛋白的磷酸化水平,从而诱导结肠癌细胞凋亡、抑制其增殖,可能用于治疗结肠癌[14]。本实验结果显示,Omentin-1可以抑制pAkt/Akt活性,其抑制结肠癌干细胞增殖、促进其凋亡的机制可能与抑制Akt活性有关,与胃癌[4]、神经母细胞瘤[5]的研究结果一致,并且与LY294002的作用一致。然而有研究[15]显示,Omentin-1可以在胰岛素存在或缺乏的情况下,触发Akt通路,通过激活腺苷单磷酸活化蛋白激酶和Akt磷酸化途径抑制心肌细胞凋亡,从而阻止心肌细胞急性缺血性损伤。推测Omentin-1在不同细胞中对Akt途径的作用可能并不相同。
综上所述,Omentin-1抑制结肠癌干细胞增殖、促进其凋亡,呈时间浓度依赖关系,且Omentin-1与LY294002在抑制结肠癌干细胞增殖、促进其凋亡的过程中具有协同作用。另外Omentin-1对结肠癌干细胞的作用机制可能与抑制Akt通路有关。
[1] Wang D, Chen J, Chen H, et al. Leptin regulates proliferation and apoptosis of colorectal carcinoma through PI3K/Akt/mTOR signalling pathway[J]. J Biosci, 2012, 37(1): 91-101.
[2] 陈 燕,陈明卫. 脂肪因子网膜素-1与结直肠癌发病的相关性研究[D]. 合肥:安徽医科大学, 2015.
[3] Ying J, Tsujii M, Kondo J, et al. The effectiveness of an anti-human IL-6 receptor monoclonal antibody combined with chemotherapy to target colon cancer stem-like cells[J]. Int J Oncol, 2015, 46(4): 1551-9.
[4] LI D, Zhao X, Xiao Y, et al. Intelectin 1 suppresses tumor progression and is associated with improved survival in gastric cancer[J]. Oncotarget, 2015, 6(18): 16168-82.
[5] LI D, Mei H, Pu J, et al. Intelectin 1 suppresses the growth, invasion and metastasis of neuroblastoma cells through up-regulation of N-myc downstream regulated gene 2[J]. Mol Cancer, 2015, 14: 47.
[6] 陈 燕,赵晓彤,陈明卫,等. 血浆网膜素-1水平与结直肠癌的相关性研究[J].安徽医科大学学报, 2015, 1(50): 75-8.
[7] 赵晓彤,陈明卫. 脂肪因子网膜素-1的自分泌效应与结直肠癌发病的相关性研究[D].合肥:安徽医科大学, 2016.
[8] Fazeli M S, Dashti H, Akbarzadeh S, et al. Circulating levels of novel adipocytokines in patients with colorectal cancer[J]. Cytokine, 2013, 62(1): 81-5.
[9] Aleksandrova K, di Giuseppe R, Isermann B, et al. Circulating omentin as a novel biomarker for colorectal cancer risk:data from the EPIC-potsdam cohort study[J].Cancer Res, 2016, 76(13): 3862-71.
[10] Uyeturk U, Alcelik A, Aktas G, et al. Post-treatment plasma omentin levels in patients with stage III colon carcinoma[J]. J BUON, 2014, 19(3): 681-5.
[11] Maeda K, Saigo C, Kito Y, et al. Expression of TMEM207 in colorectal cancer: relation between TMEM207 and intelectin-1[J]. J Cancer, 2016, 7(2): 207-13.
[12] Ricci-Vitiani L, Lombardi D G, Pilozzi E, et al. Identification and expansion of human colon-cancer-initiating cells[J]. Nature, 2007, 445(7123): 111-5.
[13] Cui L, Ohuchida K, Mizumoto K, et al.Prospectively isolated cancer-associated CD10(+) fibroblasts have stronger interactions with CD133(+) colon cancer cells than with CD133(-) cancer cells[J]. PLoS One, 2010, 12, 5(8): e12121.
[14] Itoh N, Semba S, Ito M, et al. Phosphorylation of Akt/PKB is required for suppression of cancer cell apoptosis and tumor progression in human colorectal carcinoma[J]. Cancer, 2002, 94(12): 3127-34.
[15] Kataoka Y, Shibata R, Ohashi K, et al. Omentin prevents myocardial ischemic injury through AMP-activated protein kinase-and Akt-dependent mechanisms[J]. J Am Coll Cardiol, 2014, 63(24):2722-33.
