TLR7激活上调细胞周期蛋白表达促进Hela细胞增殖
2018-03-30顾亚男张胜权
刘 莉,李 磊,顾亚男,周 宏,罗 欣,张胜权
宫颈癌在世界上是第二个主要引起女性癌症死亡的疾病[1],引起女性宫颈癌的主要原因是人乳头状瘤病毒感染。此外,一些其他的致病因子,例如普通细菌、病毒和原生动物病原体感染女性生殖道引起黏膜炎症参与宫颈癌的发生[2]。
Toll样受体(Toll-like receptors,TLRs)是一种重要的模式识别受体广泛表达在天然免疫系统,是一类I型跨膜糖蛋白,由胞外区、跨膜区和胞质区组成。TLRs在固有免疫和获得性免疫中扮演着重要的角色。Toll样受体7(TLR7)是Toll样受体家族成员之一,位于核内体表面[3],能够识别单链RNA,包括人类免疫缺陷病毒、流感病毒、水疱性口炎病毒等[4-5]。TLRs家族的信号机制是依赖于胞质区的接头蛋白分子和激酶进行信号转导。根据接头蛋白的不同,可以分为衔接蛋白(MyD88)依赖性和非依赖性途径。定位于胞内的TLR7与配体识别后,募集TIR结构域,激活有丝分裂原激活蛋白激酶和核转录因子(NF-κB)信号途径,进而调控促炎性细胞因子基因的表达,发挥其抗病毒及抗肿瘤作用[6-7]。咪唑喹啉类(Imiquimod)是一种新型的具有核苷类似物结构的家族成员之一,可以激活TLR7信号通路,但其机制尚不完全清楚。咪唑喹啉衍生物(Gardiquimod)与Imiquimod都是TLR7激动剂,能够激活TLR7信号途径,但与Imiquimod相比较,Gardiquimod在肿瘤治疗中展现出更大的潜在发展性[8]。前期研究[9]显示Gardiquimod能够促进Hela细胞增殖,该研究进一步探讨了Gardiquimod激活TLR7通路促进Hela细胞增殖的分子机制。
1 材料与方法
1.1细胞及主要试剂Hela细胞购自美国ATCC公司;胎牛血清和DMEM购自美国Gibco公司;胰酶、RIPA裂解液、青霉素链霉素溶液及周期试剂盒购自中国上海碧云天生物公司;MTS试剂盒及Gardiquimod购自美国Sigma公司;Cyclin B1、Cyclin E及β-actin均购自美国Abcam公司;二抗购自北京中杉金桥生物技术有限公司。
1.2方法
1.2.1细胞培养 人宫颈癌细胞Hela生长于含10%胎牛血清和1%青霉素链霉素溶液的DMEM培养液中,在37 ℃、5% CO2恒温恒湿培养箱内传代培养。
1.2.2细胞增殖实验(MTS) 胰酶消化收集Hela细胞,并调整细胞悬液浓度为3×104/ml,分别接种于96孔板,每孔100 μl,培养箱贴壁24 h,加入Gardiquimod药液,使终浓度为1.0、1.5、2.0、2.5、3.0 μg/ml,并设对照组(0 μg/ml),继续培养72 h后加入MTS试剂,放入温箱孵育3 h后用酶标仪检测490 nm处吸光度。同上述方法种96孔板,加入终浓度为2 μg/ml的Gardiquimod药液,作用时间分别为1~5 d,对照组培养液加入相同浓度的PBS,5 d后加入MTS试剂,放入温箱孵育3 h后用酶标仪检测490 nm处吸光度。根据对照组数值计算每组细胞存活率。
1.2.3细胞周期检测 胰酶消化收集Hela细胞并调整细胞悬液浓度为5×104/ml,分别接种于12孔板,每孔加入1 ml,培养箱贴壁24 h,加入终浓度为2 μg/ml的Gardiquimod药液,作用时间分别为1~5 d,对照组培养液加入相同浓度的PBS。胰酶消化再次收集细胞,按照周期试剂盒操作指南,室温下避光染色30 min,流式细胞仪检测细胞周期,采用Flowjo软件分析细胞周期,实验重复3次。
1.2.4Western blot检测周期蛋白Cyclin B1、Cyclin E的表达 胰酶消化收集Hela细胞,并调整细胞悬液浓度为5×104/ml,分别接种于24孔板,每孔加入0.5 ml,待细胞长到80%汇合时加入终浓度为2 μg/ml的Gardiquimod药液,作用时间分别为0.2、0.5、1、3、6、12、24 h并设置对照组。培养后收集每组细胞总蛋白进行SDS-PAGE电泳,按10 μl/孔上样量加入10%凝胶孔中,依次进行:电泳(浓缩胶60 V,分离胶120 V约2 h)、转移(300 mA恒流1.5 h)、封闭(5%的脱脂牛奶常温封闭2 h)、孵育一抗(4 ℃孵育过夜)、孵育二抗(常温摇床孵育2 h)、Thermo Scientific SuperSignal West Pico Trial Kit化学发光底物显影,分析周期蛋白的表达。
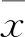
2 结果
2.1Gardiquimod促进Hela细胞增殖随着Gardiquimod药物浓度的增加,细胞相对存活率呈明显的上升趋势,当Gardiquimod药液浓度为2 μg/ml时Hela细胞相对存活率最大(130%),与对照组相比差异有统计学意义(P<0.05)。当Gardiquimod药物浓度一定时,随着作用时间的增加,细胞相对存活率增加,在第5天相对存活率最大(135%),与对照组相比差异有统计学意义(P<0.05)。见图1。
2.2Gardiquimod对Hela细胞周期的影响当Gardiquimod药物浓度(2 μg/ml)一定时,随着时间的增加,Hela细胞周期中的S期呈逐渐上升趋势,第2、4、5天实验组细胞DNA平均含量为14.85%、16.06% 和19.09%,与对照组(10.96%)相比差异有统计学意义(F=32.997,P<0.05)。G0/G1期随着作用时间的增加呈现下降的趋势,第2、4、5天实验组细胞DNA平均含量为74.36%、74.01%和73.11%,与对照组(81.85%)相比差异有统计学意义(F=54.585,P<0.05)。而G2/M期细胞无明显变化。见图2。
2.3周期蛋白CyclinB1、CyclinE的表达Western blot结果显示经Gardiquimod处理Hela细胞后,随着时间的增加,细胞内Cyclin B1、Cyclin E蛋白的含量明显增加,各实验组与对照组相比差异有统计学意义(P<0.05)。见图3。

图1 MTS分析Gardiquimod不同浓度和不同时间对Hela细胞增殖的影响
A:不同浓度的Gardiquimod作用Hela细胞72 h后对细胞增殖的影响;B:Gardiquimod(2 μg/ml)作用Hela细胞不同时间后对细胞增殖的影响;与对照组(0 μg/ml)比较:*P<0.05
3 讨论
TLRs通过识别保守的病原体相关的分子位点,例如细菌的脂多糖、脂肽,或者是细菌和病毒的DNA、RNA 等,诱发获得性免疫反应。此外TLR7还广泛表达于多种组织和细胞,包括DC、B、T 细胞等。

图2Gardiquimod作用Hela细胞不同时间后对细胞周期的影响
A:Gardiquimod作用Hela细胞不同时间后对细胞周期的影响;B:分析Gardiquimod作用Hela细胞不同时间后各细胞周期所占比例;1:对照组;2:第1天;3:第2天;4:第3天;5:第4天;6:第5天;与对照组比较:*P<0.05
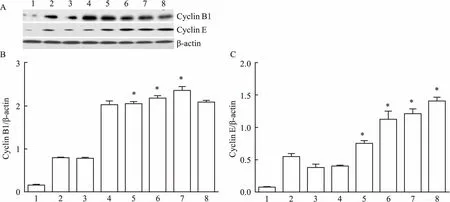
图3 Western blot分析Cyclin B1、Cyclin E的表达
A:Gardiquimod作用Hela细胞不同时间后对Cyclin B1、Cyclin E表达的影响;B:分析Cyclin B1的表达;C:分析Cyclin E的表达;1:对照组;2:0.2 h;3:0.5 h;4:1 h;5:3 h;6:6 h;7:12 h;8:24 h;与对照组比较:*P<0.05
TLR7激活后可诱导多种炎症因子表达,包括白介素-10、白介素-12、白介素-23、干扰素γ、白介素-2等。研究[10]显示TLR7的激活在人乳头状瘤病毒感染引起的癌症治疗中通过增加巨噬细胞和NK细胞的活性从而抑制肿瘤的增殖。Gardiquimod,TLR7激动剂,在鼠科动物前列腺癌和膀胱癌中对肿瘤的增殖具有抑制作用并且在细胞周期的G2/M期产生阻滞作用[11]。然而,本研究显示:当Gardiquimod作用Hela细胞后,S期DNA增加明显,细胞增殖旺盛。国外研究[12]显示,Cyclin E经常在肿瘤细胞中过度表达,这种过度表达与乳腺癌患者的生存率下降有关。本研究显示:细胞周期蛋白Cyclin B1、Cyclin E随着Gardiquimod作用时间的增加而增加, TLR7信号通路激活后引起细胞周期的改变,周期蛋白水平也随之改变。Cyclin B1、Cyclin E 的上调可能参与TLR7信号通路的激活从而促进Hela细胞增殖。这一研究结果提示Gardiquimod对不同的肿瘤可能存在不同的作用,甚至是相反的结果,具体机制待进一步研究。
综上所述,Gardiquimod引起Hela细胞周期和周期蛋白发生了变化,并对Hela细胞的增殖起到了一定的促进作用,首次发现了TLR7的激活与宫颈癌细胞增殖的相关关系,为研究宫颈癌提供了一个新的思路。
[1] Siegel R L,Miller K D,Jemal A,et al.Cancer Statistics,2017[J]. CA Cancer J Clin,2017,67(1):7-30.
[2] Ogilvie G,Nakisige C,Huh W K,et al.Optimizing secondary prevention of cervical cancer:Recent advances and future challenges[J]. Int J Gynaecol Obstet,2017,138 (Suppl 1):15-9.
[3] Maeda K,Akira S. TLR7 Structure:Cut in Z-Loop[J]. Immunity,2016,45(4):705-7.
[4] Sepehri Z,Kiani Z,Alavian S M,et al.The link between TLR7 signaling and hepatitis B virus infection[J]. Life Sci,2016,158:63-9.
[5] Lebold K M,Jacoby D B,Drake M G,et al. Toll-like receptor 7-targeted therapy in respiratory disease[J]. Transfus Med Hemother,2016,43(2):114-9.
[6] Ntoufa S,Vilia M G,Stamatopoulos K,et al. Toll-like receptors signaling:A complex network for NF-kappaB activation in B-cell lymphoid malignancies[J]. Semin Cancer Biol,2016,39:15-25.
[7] Landström M.The TAK1-TRAF6 signalling pathway[J]. Int J Biochem Cell Biol,2010,42(5):585-9.
[8] Ma F,Zhang J,Zhang J,et al. The TLR7 agonists imiquimod and gardiquimod improve DC-based immunotherapy for melanoma in mice[J]. Cell Mol Immunol,2010,7(5):381-8.
[9] 李 磊,程丰伟,王 芳,等.TLR7激活对Hela细胞增殖的影响[J]. 安徽医科大学学报,2014,49(7):910-2.
[10] Chi H,Li C M,Zhaol F S,et al.Anti-tumor activity of toll-like receptor 7 agonists[J]. Front Pharmacol,2017,8:304.
[11] Han J H,Lee J,Jeon S J,et al.Invitroandinvivogrowth inhibition of prostate cancer by the small molecule imiquimod[J]. Int J Oncol,2013,42(6):2087-93.
[12] Samai P,Pyenson N,Jiang W,et al.Co-transcriptional DNA and RNA cleavage during type III CRISPR-cas immunity[J]. Cell,2015,161(5):1164-74.
