少孢节丛孢菌XJ-A1几丁质酶基因AO-587和AO-31的克隆及分子特征分析
2018-03-29钟文强孟庆玲贡莎莎王熙凤才学鹏
钟文强,孟庆玲*,乔 军,陈 英,贡莎莎,王熙凤,才学鹏
(1.石河子大学 动物科技学院,新疆 石河子 832003;2.中国农业科学院 兰州兽医研究所,兰州 730046)
少孢节丛孢菌是目前研究最多的一种捕食线虫性真菌[1],在自然界中广泛分布。研究表明,几丁质(Chitin)是许多线虫体壁和虫卵外壳的主要成分[2],来源于致病性真菌的几丁质酶能催化几丁质水解,而捕食线虫性真菌在侵染线虫过程中分泌的胞外水解酶中就含有几丁质酶,可能参与线虫表皮的侵入和宿主细胞的降解[3-6]。研究显示,少孢节丛孢菌几丁质酶在侵染线虫过程中发挥重要作用[3-8]。从新疆地区分离到的捕食线虫性真菌主要为少孢节丛孢菌[9-11],因此,对少孢节丛孢菌几丁质酶的结构及其在侵染线虫过程中的研究具有重要意义。
本研究根据GenBank中公布的少孢节丛孢菌标准株(ATCC 24927)全基因组[12],从少孢节丛孢菌新疆分离株中对几丁质酶基因AO-587和AO-31进行克隆、测序,对基因及其编码氨基酸序列的分子进行特征性分析,并将这2个基因与致病性相关的真菌几丁质酶进行同源性比对以及系统进化分析,为进一步研究少孢节丛孢菌几丁质酶在侵染线虫过程中的功能奠定了基础。
1 材料与方法
1.1 菌株、试剂、及培养基
捕食线虫性真菌少孢节丛孢菌新疆分离株XJ-A1(ArthrobotrysoligosporaXJ-A1)和E.coliDH5α菌株由石河子大学寄生虫实验室保存;2×Taq PCR 反应试剂、5 000 bp DNA Marker均购自索来宝生物工程(大连)有限公司;质粒小提试剂盒、琼脂糖凝胶回收试剂盒、pMD19-T载体与Biospin真菌基因组DNA提取试剂盒均购自天根生化科技(北京)有限公司。YPSSA(yeast-phosphate-sulfate-soluble starch-agar)培养基:0.8 g酵母提取物、0.2 g K2HPO4·3H2O、0.1 g MgSO4、4 g可溶性淀粉、4 g琼脂,加蒸馏水至200 mL,经高压灭菌后倾注于灭菌玻璃培养皿,4 ℃保存备用。
1.2 基因组DNA的提取
向YPSSA培养基中加入适量少孢节丛孢菌新疆分离株XJ-A1,在20 ℃霉菌培养箱中培养6~8 d。取适量菌丝,用Biospin真菌基因组DNA提取试剂盒提取DNA。
1.3 引物设计与合成
根据GenBank发表的少孢节丛孢菌标准株(ATCC 24927)全基因组序列,利用Primer 5.0 引物设计软件设计几丁质酶基因AO-587和AO-31的特异性引物:AO-587(上游):5' ATGAAAACAATTACTATCGC 3';AO-587(下游):5' CTAATCATAACTAGGGGATC 3';AO-31(上游):5' ATGGAAGCTCAAG 3';AO-31(下游):5' CTACCGCTGATTTCTAA 3',引物由北京六合华大基因科技股份有限公司合成。
1.4 几丁质酶基因的PCR扩增和克隆
PCR扩增体系为20 μL:其中DNA模板2 μL、PCR Mixture 8 μL、上下游引物各0.5 μL、ddH2O 9 μL。AO-587基因PCR扩增反应条件:95 ℃ 5 min;94 ℃ 40 s,55 ℃ 40 s,72 ℃ 120 s,共32个循环;72 ℃ 10 min。AO-31基因PCR扩增反应条件:95 ℃ 5 min;94 ℃ 40 s,62℃ 40 s,72 ℃ 90 s,共35个循环;72 ℃ 10 min。得到的DNA产物进行胶回收。将回收的目的基因片段克隆到pMD18-T载体上,16 ℃过夜连接后转入到E.coliDH5α菌株中,涂布在含有100 mg/ml Amp的固体LB培养基上,挑单菌落扩增培养,提质粒后经PCR鉴定,将提取的质粒交送北京六合华大股份有限公司测序。
1.5 几丁质酶基因及其编码氨基酸序列生物信息学分析
测序结果利用生物在线软件ProParam (http://web.expasy.org/protparam/)计算蛋白质的分子质量、等电点等;通过(http://www.expasy.org/tools/,http://www.ebi.ac.uk/interpro/)分析几丁质酶结构域、氨基酸活性位点;通过SignalP (http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;通过Predictprotein和Phyre2预测二级、三级结构。采用DNAMAN和MEGA5.0软件NJ法(Neighbor-joining Method,bootstrap为1000)进行氨基酸序列的同源性比对和进化分析。
2 结 果
2.1 PCR扩增结果
少孢节丛孢菌XJ-A1的DNA为模板,通过PCR扩增,琼脂糖凝胶电泳分析。结果表明,少孢节丛孢菌XJ-A1几丁质酶AO-587基因约为1 930 bp,AO-31基因约为1 171 bp,与GenBank中已公布的少孢节丛孢菌标准株(ATCC 24927)AO-587和AO-31基因大小相近(图1)。

图1 少孢节丛孢菌XJ-A1几丁质酶基因AO-587和AO-31的PCR扩增M1. DNA分子质量标准DL-5000;M2.DNA分子质量标准DL-2000;1-3. PCR扩增产物Fig.1 Amplification products of chitinases AO-587 and AO-31 gene of Arothrobotrys oligospora XJ-A1 by PCRM. DL-5000 DNA Marker;M2. DL-2000 DNA Marker;1-3. PCR amplified product
2.2 少孢节丛孢菌XJ-A1几丁质酶AO-587和AO-31基因及其编码氨基酸序列分析
测序结果表明,少孢节丛孢菌XJ-A1几丁质酶AO-587基因全长为1 930 bp,与已公布的少孢节丛孢菌标准株(ATCC 24927)的几丁质酶AO-587核苷酸序列的同源性为94.43%。序列中包含4个内含子和一个1 560 bp的开放阅读框(ORF),内含子都以GT开头,AG结尾,分别位于319~419、549~690、929~999、1696~1780位核苷酸,具有真菌内含子的共同特征;外显子编码519个氨基酸,与已公布的氨基酸序列同源性为93.25%。通过SignalP软件分析发现,AO-587氨基酸序列有信号肽序列,位于氨基酸序列的第1~22位。Protparam软件预测几丁质酶AO-587的分子量为55.86 kD,等电点为4.94;Interpro和Scanprosite软件分析发现,AO-587存在2个几丁质酶保守的区域SVGG和DGLDLDWE,属于糖苷水解酶18家族,主要催化活性区域位于105~364位,并且存在一个水解酶催化活性位点DGLDLDWE,位于234~241位(图2)。
AO-31基因全长为1 173 bp,与已公布的少孢节丛孢菌标准株(ATCC 24927)的几丁质酶AO-31核苷酸序列的同源性为99.64%;序列中包含3个内含子和一个900 bp的开放阅读框(ORF),内含子都以GT开头,AG结尾,分别位于166~233、251~324、723~788位核苷酸,具有真菌内含子的共同特征序列;外显子编码299个氨基酸,与已公布的氨基酸序列同源性为100% 。经SignalP软件分析发现,AO-31氨基酸序列没有信号肽。Protparam软件预测几丁质酶AO-31的分子量为34.6 kD,等电点为5.86;Interpro 和Scanprosite软件分析发现,AO-31存在2个几丁质酶保守区域ICFVG和IRRDWEY,属于糖苷水解酶18家族,几丁质酶主要催化的活性区位于10-275位,存在一个水解酶催化活性位点IRRDWEY,位于53~59位(图3)。

图2 不同真菌来源几丁质酶主要催化活性区域氨基酸序列比对*表示几丁质酶的结合区域(ENGVMDYKA,GLCCGMWWETSG)与糖基水解酶18家族保守的水解区域(SXGG,DGXDXDWE);灰色的部分为高度同源(100%)区域Fig.2 Comparison of amino acid sequence of major catalytic active regions of chitinase from different fungi* indicates the binding region of chitinase (ENGVMDYKA, GLCCGMWWETSG) and the conserved hydrolysis zone of the sugar-based hydrolase 18 family (SXGG, DGXDXDWE);grey part is part of the highly homologous (100%) region
2.3 几丁质酶二级和三级结构预测分析
Predictprotein软件预测结果显示,几丁质酶AO-587和AO-31的二级结构主要以无规则卷曲(loop)、α螺旋(alpha-helix)和β折叠(beta-sheet)为结构元件,在AO-587二级结构中分别占17.7%、15.6%、66.7%,在AO-31二级结构中分别占28.1%、16.4%、55.5%。SWISS-MODEL软件预测结果显示,几丁质酶AO-587和AO-31三级结构都具有(α/β)8的圆桶形结构,其外部由α螺旋形成外桶,中心部分由β折叠形成内桶,内外桶紧密连接(图4)。

图3 少孢节丛孢菌几丁质酶AO-587和AO-31基因编码蛋白的结构域模式图Fig.3 Domain pattern of chitinase AO-587 and AO-31 gene encoding protein of Arthrobotrys oligospora
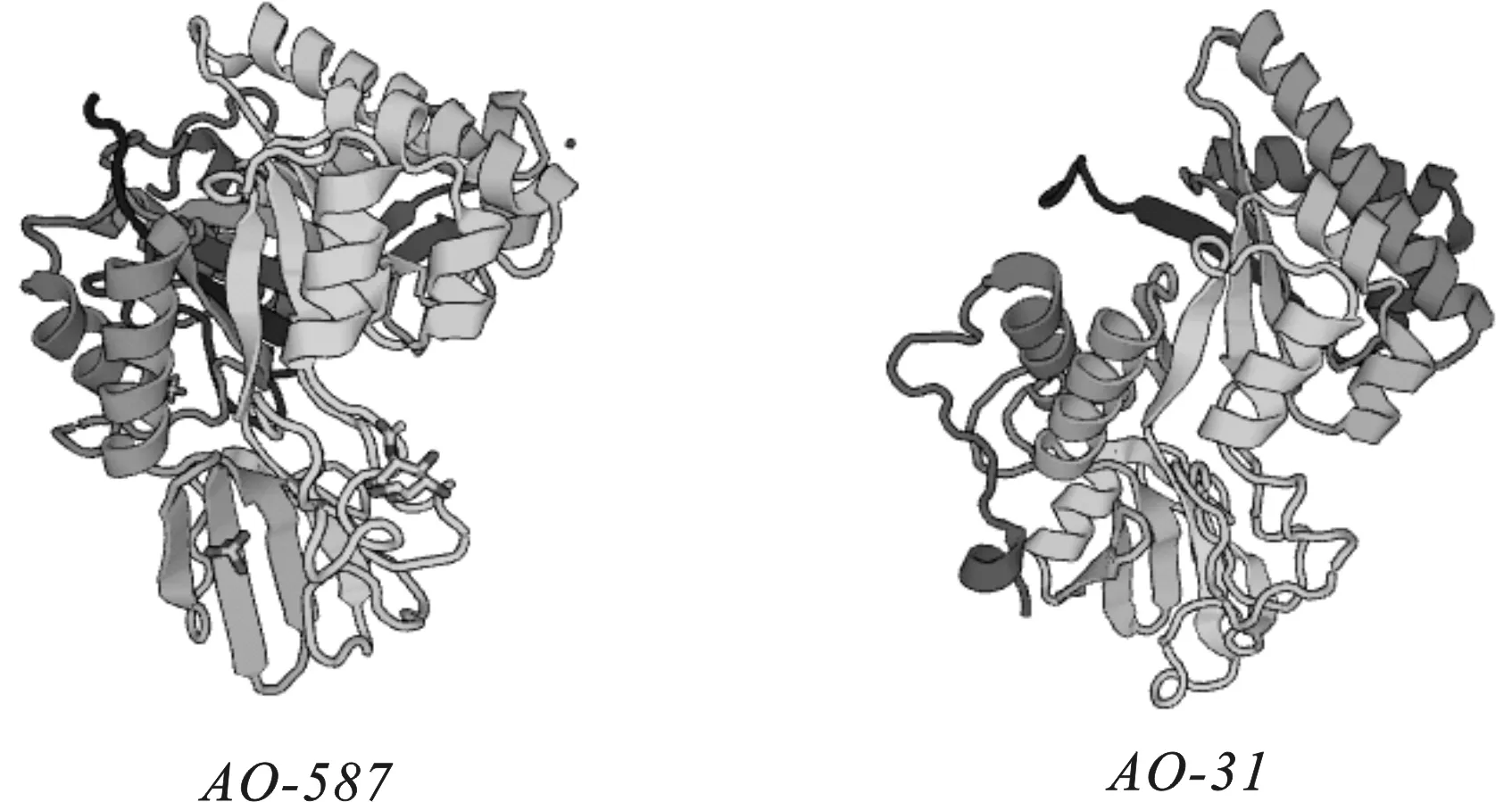
图4 AO-587和AO-31几丁质酶三级结构的预测Fig. 4 Prediction of the tertiary structures of AO-587 and AO-31 chitinase
2.5 不同物种来源几丁质酶的系统进化分析
采用MEGA5.0软件对28个不同来源的几丁质酶氨基酸序列绘制系统进化树。结果显示(图5),各菌株序列形成3个明显的分枝,其中,第1个分枝的几丁质酶分子质量约为47 ku,第2个分枝的几丁质酶分子质量约为41 ku,第3个分枝的几丁质酶分子质量约为52 ku。少孢节丛孢菌新疆分离株几丁质酶AO-31分为单独的一个小分枝,AO-587位于第3个分枝和Drechslerellsstenobrocha以及Dactylellinahaptotyla的几丁质酶亲缘关系最接近说明他们具有相似的结构和功能。
3 讨 论
目前,多种侵染性分子(毒素、胞外酶、病原物激素、病原物胞外多糖等)在捕食线虫性真菌——线虫相互作用的过程中被先后发现,尤其是丝氨酸蛋白酶和几丁质酶在侵入线虫表皮和降解宿主细胞的过程中发挥着重要作用[3-8]。有关捕食线虫性真菌产生胞外蛋白酶及其酶学性质的研究于20世纪80年代才开始出现[14],之后对蛋白酶基因的研究较多,而国内外对捕食线虫性真菌几丁质酶相关基因的报道却比较少。少孢节丛孢菌(Arthrobotrysoligospora)是捕食线虫性真菌的代表菌[1],在自然界中广泛分布。现有研究资料表明,少孢节丛孢菌几丁质酶在侵染线虫过程中发挥重要作用[3-8]。几丁质(Chitin)是许多线虫体壁和虫卵外壳的主要成分,是由N-乙酰-β-D-氨基葡萄糖以β-1, 4糖苷键连接而成的高分子生物多聚体,而几丁质酶能催化几丁质β-1, 4糖苷键水解[2]。因此,研究少孢节丛孢菌几丁质酶在侵染线虫过程中发挥的作用具有重要意义。
本研究以捕食线虫真菌的模式菌-少孢节丛孢菌新疆分离株XJ-A1为研究对象,对少孢节丛孢几丁质酶AO-587和AO-31进行克隆,成功获得两个全长编码基因序列,与少孢节丛孢菌标准菌株(ATCC 24927)的几丁质酶AO-587和AO-31基因核苷酸序列同源性分别为94.43%、99.64%,氨基酸序列同源性分别为93.25%和100%。可知不同分离株的捕食线虫性真菌少孢节丛孢菌之间存在一定的差异。现有的研究发现,大多数不同来源真菌的几丁质酶具有相似的几丁质酶催化域、信号肽、几丁质结合域等结构域[13,15-16]。本研究利用Interpro和Scanprosite软件进行几丁质酶AO-587、AO-31氨基酸序列分析时发现,AO-587的几丁质酶主要催化活性区域位于105~364位,AO-31的几丁质酶主要催化活性区位于10~275位。并且XJ-A1几丁质酶均具有典型的几丁质酶催化区保守序列SXGG和DGXDXDWE,与Wright等[17]和Cantarel等[18]的研究结果一致。从几丁质酶的系统进化分析可以看出,少孢节丛孢菌新疆分离株几丁质酶AO-587、AO-31和Drechslerellsstenobrocha以及Dactylellinahaptotyla的几丁质酶亲缘关系最接近。目前,在Drechslerellsstenobrocha以及Dactylellinahaptotyla中已报道有多种糖苷水解酶18家族几丁质酶或假定的几丁质酶基因[21],参考这些在进化上存在相关性的几丁质酶将更有利于深入开展少孢节丛孢菌相关几丁质酶功能研究。

图5 不同真菌来源几丁质酶的系统进化树*为新疆分离株少孢节丛孢菌几丁质酶AO-31、AO-587Fig.5 Phylogenetic tree of chitinase from different fungi sources* means the Xinjiang isolates, respectively, and the chitinase AO-31 and AO-587
新疆是我国主要的牧区,家畜线虫病对新疆养羊业造成极大的经济损失。采取化学药物防控该病时产生的抗药性、药物残留、环境污染等问题日益严重,利用寄生性线虫的天敌-捕食线虫性真菌进行生物防治具有良好的应用前景,因此开展捕食线虫性真菌的研究至关重要。随着对少孢节丛孢菌胞外蛋白酶分子生物学研究的深入,为研究和开发基于其胞外蛋白酶(几丁质酶和丝氨酸蛋白酶)的生物防控制剂提供科学依据。
[1]NORDBRING-HERTZ B, JANSSON H B, TUNLID A. Nematophagous fungi[J]. John Wiley & Sons,2001,51(7):157-163.
[2] BARTNICKI-GARCIA S. Cell wall chemistry, morphogenesis, and taxonomy of fungi[J]. Annual Review of Microbiology, 1968, 22(1): 87-108.
[3] LI Juan, YU Li, YANG Jinkui, et al. New insights into the evolution of subtilisin-like serine protease genes in Pezizomycotina[J]. BMC Evolutionary Biology, 2010, 10(1): 68-82.
[4] ANDERSSON K M, MEERUPATI T, LEVANDER F, et al. Proteome of the Nematode-Trapping cells of the fungus monacrosporium haptotylum[J]. Applied and Environmental Microbiology, 2013, 79(16): 4 993-5 004.
[5] GAN Zhongwei, YANG Jinkui, TAO Nan, et al. Cloning and expression analysis of a chitinase gene Crchi1 from the mycoparasitic fungus Clonostachys rosea (syn. Gliocladium roseum)[J]. Journal of Microbiology (Seoul, Korea), 2007, 45(5): 422-430.
[6] YANG Jinkui, GAN Zhongwei, LOU Zhiyong, et al. Crystal structure and mutagenesis analysis of chitinase CrChi1 from the nematophagous fungus Clonostachys rosea in complex with the inhibitor caffeine[J]. Microbiology (Reading, England), 2010, 156(Pt 12): 3 566-3 574.
[7]TIFFIN P. Comparative evolutionary histories of chitinase genes in the Genus zea and Family poaceae[J]. Genetics, 2004, 167(3): 1 331-1 340.
[8] NORDBRING-HERTZ B. Morphogenesis in the nematode-trapping fungus Arthrobotrys oligospora-an extensive plasticity of infection structures[J]. Mycologist, 2004, 18(03): 125-133.
[9] 王为升. 捕食线虫性真菌的分离鉴定及高效菌株的筛选[D].新疆石河子:石河子大学,2013.
[10] 陈双庆. 捕食线虫性真菌的分离鉴定及少孢节丛孢菌黏附分子与线虫相互作用初步研究[D].新疆石河子:石河子大学,2014.
[11] ZHAO Hailong, QIAO Jun, MENG Qingling, et al. Expression of serine proteinase P186 of Arthrobotrys oligospora and analysis of its nematode-degrading activity[J]. Antonie Van Leeuwenhoek, 2015, 108(6): 1 485-1 494.
[12] YANG Jin-kui, WANG Lei, JI Xing-lai, et al. Genomic and proteomic analyses of the fungus arthrobotrys oligospora provide insights into Nematode-Trap formation[J]. PLOS Pathogens, 2011, 7(9): e1002179.
[13] 赵海龙. 少孢节丛孢菌胞外蛋白酶基因的克隆, 表达及生物学活性研究[D]. 新疆石河子:石河子大学, 2015.
[14] SCHENCK N C, KINLOCH R A. Incidence of mycorrhizal fungl on 6 field crops in monoculture on a newly cleared woodland site[J]. Mycologia, 1980, 72(3): 445-456.
[15] 冯俊丽,朱旭芬.微生物几丁质酶的分子生物学研究[J].浙江大学学报(农业与生命科学版),2004,30(1):102-108.
[16] PHILLIPS D C. The hen egg-white lysozyme molecule[J]. Proceedings of the National Academy of Sciences, 1967, 57(3): 483-495.
[17] WRIGHT H T, SANDRASEGARAM G, WRIGHT C S. Evolution of a family of N-acetylglucosamine binding proteins containing the disulfide-rich domain of wheat germ agglutinin[J]. Journal of Molecular Evolution, 1991, 33(3): 283-294.
[18] CANTAREL B L, COUTINHO P M, RANCUREL C, et al. The Carbohydrate-Active EnZymes database (CAZy): an expert resource for glycogenomics[J]. Nucleic Acids Research, 2009, 37(Database issue): D233-D238.
[19] JORIS B, ENGLEBERT S, CHU C-P, et al. Modular design of the Enterococcus hirae muramidase-2 and Streptococcus faecalis autolysin[J]. FEMS Microbiology Letters, 1992, 70(3): 257-264.
[20] ANDRE G, LEENHOUTS K, HOLS P, et al. Detection and localization of single LysM-peptidoglycan interactions[J]. Journal of Bacteriology, 2008, 190(21): 7 079-7 086.
[21] SMITS G J, VAN DEN ENDE H, KLIS F M. Differential regulation of cell wall biogenesis during growth and development in yeast[J]. Microbiology (Reading, England), 2001,147(4):781-794.
