逆神经走行方向探寻并摘取大鼠背根神经节的改进方法
2018-03-29马理元姜劲挺张伦广李祥雨郑吉元王强强
马理元,姜劲挺,*,张伦广,李祥雨,郑吉元,徐 欣,王强强
(1.甘肃中医药大学,兰州 730000; 2.甘肃中医药大学附属医院,兰州 730000; 3.兰州大学第二医院,兰州 730000)
背根神经节(dorsal root ganglion,DRG)作为感觉传入的第一级换能神经元的集中位置[1-2],在外周信号的产生和传导过程中有着至关重要的作用,是神经、疼痛、骨科等多领域的研究对象,因此获取完好无损的DRG成为相关研究的必要前提,但由于其特殊的解剖位置:体积小、位置深、被脊椎椎间孔所嵌顿,同时周围有大量结缔组织包绕[3],给相关研究人员获取DRG带来一定难度。为短时间获得完好DRG,本研究通过比较两种DRG的取材方法,证明逆神经走行方向探寻并摘取DRG这一新方法的高效性和实用性,期为背根神经节研究提供保障。
1 材料和方法
1.1 实验动物
SPF级SD大鼠30只,雌雄各半,体重(200±10) g,由甘肃中医药大学实验中心提供[SCXK (甘) 2015-0002],[SYXK (甘) 2015-0005]。本实验福利伦理审批IACUC号:2017-095。实验过程中按实验动物使用的3R原则给予人道主义关怀。
1.2 主要试剂与仪器
水合氯醛,4%多聚甲醛;剃毛器,手术刀,直头止血钳,弯头止血钳,手术剪,咬骨钳,眼科剪,眼科镊。
1.3 实验方法
1.3.1 术前麻醉
大鼠术前不限制食水,10%水合氯醛按0.3 mL/kg腹腔注射。
1.3.2 传统方法取材
待大鼠麻醉成功后,将其俯卧位固定于平木板上,剃毛器剔除腰部毛发,用碘伏棉球擦拭手术区,在腰部正中线和髂后上棘连线处作一纵行切口,切口向上下方向各延长2.5~3 cm,逐层切开筋膜至肌肉层,用止血钳轻提起棘突旁的肌肉,用手术刀作一纵行小切口,用弯钳钝性分离脊柱两旁的肌肉,至棘突、乳状突、横突充分暴露,暴露范围根据所需DRG决定,剪掉棘突,用咬骨钳自棘突根部蚕食性地向椎体两旁咬去椎板,使脊髓后侧、外侧充分暴露后(如图1A),用眼科镊将脊髓从上端缓慢、轻巧地提起后即可见到脊神经后根分支和其在椎体的出口,咬开椎间孔后即可看到淡黄色、卵圆形的DRG,长约1.5 mm,充分暴露后,用眼科剪剪断其两端的神经,将其置于盛有4%多聚甲醛溶液的离心管中。记录每只大鼠从L3~5节段取出的完好DRG数目及其所消耗时间。
1.3.3 新方法取材
同上麻醉后切开皮肤、筋膜,暴露肌肉,分离脊柱两旁肌肉,暴露脊柱乳状突、横突,同时密切观察横突旁肌肉中走行的神经,并将其分离出来(如图1B),逆神经走行方向,从下向上寻得神经从椎体的出口,即横突后缘处,用咬骨钳将出口上下的骨质咬去,即可暴露DRG,用眼科镊将之前暴露的神经镊起,轻缓地向后外方用力,即可拉出DRG,减去其两端的神经,将其置于盛有4%多聚甲醛溶液的离心管中。记录每只大鼠从L3~5节段取出的完好DRG数目及其所消耗时间。

注:A:传统方法摘取大鼠背根神经节;B:坐骨神经走行。① 脊髓;② 背根神经节;③ 坐骨神经。图1 大鼠神经解剖图Note. A: DRG extracted with the traditional method. B: Sciatic nerve running direction. ① Spinal cord; ② DRG; ③ Sciatic nerve.Fig.1 Anatomy of the rat nerves
1.3.4 石蜡切片及HE染色步骤
(1)取新鲜的DRG于4%多聚甲醛液固定24 h后,流水冲12 h。
(2)依次用75%~100%的乙醇连续脱水,二甲苯透明3次,浸入60℃石蜡中进行包埋;石蜡包埋的标本连续切片4张,厚度为4 μm,室温干燥。背根神经节行苏木素-伊红染色(HE染色)。
1.4 统计学方法
2 结果
2.1 DRG数目和耗时差异
两种方法均可将L3~5的DRG取出,逆神经走行方向探寻并摘取DRG这一新方法相对于传统方法更为高效,且其取得的DRG形态更为完整,数目也明显增多(P< 0.05)。见表1。
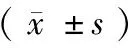
Tab.1Comparison of the traditional method and the new method for DRG extracting

方法Methods大鼠数量Numberofrats每只大鼠取得的完整DRG数量NumberofintactDRGsextractedfromeachrat摘取每个DRG耗时(min)TimeconsumptionforextractionofaDRG传统方法Traditionalmethod15308±131558±121新方法Newmethod15429±108∗169±091∗
注:与传统方法比较,*P< 0.05。
Note. Compared with the traditional method,*P< 0.05.
2.2 形态差异
正常大鼠经两种方法取得DRG经石蜡包埋、切片、HE染色后如图2:传统方法所取得的DRG(图2 A)边缘毛糙不清,着色不均,可能是由于取材时对DRG结缔组织分离不彻底和挤压性损伤所导致。新方法所取得的DRG(图2B)组织光滑、着色均匀、结构清晰。

注:A:传统方法所取得的DRG;B:新方法所取得的DRG。图2 正常大鼠背根神经节石蜡切片(HE,× 40)Note. A: DRG obtained by the traditional method. B: DRG obtained by the new method.Fig.2 Histology of normal rat DRGs. HE staining
3 讨论
位于外周神经系统的DRG作为感觉信息传导通路的第一站,位于其内的中、小型神经元与痛觉信息的感受和传递有着极为密切的关系,所以又将DRG形象地称为痛觉感受器或伤害性感受器[4]。相关研究表明DRG在损伤或炎症条件下因阈值下降、适应性减弱而处于兴奋状态,这是其产生慢性疼痛的根本原因[5]。长期积累的慢性疼痛信号则会通过中枢神经元形成中枢敏化,中枢敏化又会造成痛觉过敏,如此形成恶性循环[6]。因此只有深入研究DRG,才有望从根源上解决慢性疼痛。综上,高效的DRG取材方法的探寻是极为必要的。
目前背根神经节的取材方法有传统的单独摘取法[7]、连同脊髓同时提取法[7]、直接固定打开椎管取材法[8],以上方法的操作中均需打开椎板、暴露脊髓后才能分离神经根及背根神经节,但椎板质硬、脊髓易碎的特点导致采用传统方法摘取DRG具有难度大、耗时长、易挤压损伤DRG的弊病,而本文研究采用逆神经走行方向探寻并摘取DRG的新方法,先分离神经,然后沿神经从下向上寻得神经从椎体的出口,暴露并摘取DRG,避开打开椎板、暴露脊髓的环节,相对传统取材方法不仅在取得的DRG数量上有所增加,且缩短了取材时间,同时弥补了传统取材方法取得的DRG结缔组织剔除不彻底、易挤压损伤DRG等不足之处,值得在相关实验中推广使用。
[1] 罗放, 毕好生. 神经病理性疼痛的背根神经节机制 [J]. 国外医学麻醉学与复苏分册, 2003, 24(2): 68-70.
[2] 芮海涛, 张庆国, 徐世元. 大鼠蛛网膜下腔置管及背根神经节分离方法的改进 [J]. 广东医学, 2007, 12(28): 1915-1917.
[3] 熊南翔, 赵洪洋, 张方成. 从大鼠活体取背根神经节及交感神经节的方法 [J]. 中国比较医学杂志, 2006, 16(6): 367-368.
[4] 褚文广, 杜祎康, 王旭, 等. 外周伤害性感受神经元在体特异性表达GCaMP6f蛋白方法的构建及细胞内钙活动的监测 [J]. 神经解剖学杂志, 2017, 33(3): 323-328.
[5] Sun W, Miao B, Wang XC, et al. Reduced conduction failure of the main axon of polymodal nociceptive C-fibres contributes to painful diabetic neuropathy in rats [J]. Brain, 2012, 135(Pt 2): 359-375.
[6] Kuner R. Central mechanisms of pathological pain [J]. Nat Med, 2010, 16(11): 1258-1266.
[7] 陈海亮, 黄飞, 张璐萍, 等. 背根神经节摘取方法的研究 [J]. 中外医疗, 2008, 28(20): 1, 3.
[8] 王士杰, 黄丽辉, 雷雳, 等. 胚胎大鼠背根神经节摘取方法的研究 [J]. 听力学及言语疾病杂志, 2010, 18(6): 596-597.
