B超引导下猕猴肝脏及肾脏组织的活体穿刺方法
2018-03-29李哲丽叶尤松王陈芸唐东红
李哲丽,叶尤松,张 庶,冯 蕾,王陈芸,陈 倩,唐东红*
(1.中国医学科学院/北京协和医学院医学生物学研究所,昆明 650118; 2.昆明医科大学第二附属医院,昆明 650101; 3.云南省中医学院,昆明 650200)
猕猴(Macacamulatta),又名恒河猴(rhesus monkey),在形态学、生理生化代谢等方面与人类非常相似,是较为理想的实验动物,常用于许多重要的科学研究。肝是脊椎动物最大的实质性器官,有代谢、贮存糖原、分泌胆汁及吞噬防御等重要功能。在正常猕猴体内肝位于右上腹,上界在右锁骨中线第五肋骨上缘,下界与右季肋缘平齐,一般不超出右侧肋弓。肝脏血液供应丰富,呈红褐色,可分为左、右、前、后四个缘和两个面(膈面和脏面)。肾是脊椎动物的重要器官,属于泌尿系统的一部分,负责过滤血液中的杂质、维持体液和电解质的平衡,最后产生尿液经由后续管道排出体外;同时也具备内分泌的功能以调节血压等,在维持机体酸碱平衡、机体的代谢、废物排泄等方面起着重要作用。在猕猴体内,正常猕猴具备两枚肾,位于腰部两侧后方,肾为暗红色实质性器官,表面光滑,可分为上、下两端,前、后两面,内、外侧两缘。成年雄性猕猴肾重量约16~32 g,雌性猕猴肾重量约15~33 g,雌雄猕猴肾重量差异不大。左肾较右肾稍大,肾纵轴上端向内、下端向外,因此两肾上极相距较近,下极较远,肾纵轴与脊柱所成角度为30°左右。
肝和肾是猕猴的重要器官,随着医学研究的发展,在人类疾病动物模型的建立及相关机理研究实验中,常需要观察其疾病状态下基因在转录水平及蛋白表达水平方面的变化,获得相关实验数据[1-2]。常规方法取材是直接处死动物来获取相应的组织,采用活体取材的方式获得肝、肾组织以提取RNA及蛋白样品[3],可以实时获得药物代谢不同阶段的组织样品,进行相关分析,符合实验动物福利制度,降低实验成本[4-5]。
近年来,超声技术被应用于人类肝、肾活体穿刺术,具有定位准确、成功率高、并发症少等特点,弥补了传统手术定位不准、成功率低等不足[6]。B超引导的活体穿刺方法应用于猕猴获取新鲜组织样品少有报道,现通过B超引导对猕猴肝、肾进行活体穿刺取材,建立一套简单、快捷的获取肝、肾组织取材方法,为猕猴肝、肾代谢研究奠定基础动物实验技术。在实施穿刺术时,需要使用B超探查猕猴的肝、肾并进行定位,再通过穿刺引导架引导穿刺针进行穿刺取材,定位的准确与否是成功的关键[7]。
1 材料和方法
1.1 实验动物
普通级成年猕猴4只,体重8~12 kg,雄性,来源于中国医学科学院医学生物学研究所[SCXK (滇) K2014-0001],实验在中国医学科学院医学生物学研究所完成[SYXK (滇) K2014-0007]。动物实验由中国医学科学院医学生物学研究所动物实验伦理审查委员会通过,批准号为2017-004。同时按照实验动物的3R原则给予人道主义关怀。
1.2 主要试剂与仪器
盐酸氯胺酮麻醉剂,每支2 mL(0.3 g),购于江苏中牧倍康药业有限公司;医用碘伏,购于德州默霖消毒科技有限公司;TriPure,购于Roche公司;琼脂糖,购于硕阳科技有限公司。彩色电脑声像仪(MyLab 30CV,意大利百胜);巴德活检枪(MG15-22,上海库丰实业有限公司);活检穿刺针(100 mm,河南省圣吉安医疗器械有限公司);穿刺引导架(ABS421,上海卉力生物科技有限公司);B超介入手术包,购于昆明宝利康医疗卫生用品有限公司;沙袋、布腹带(自制);剃毛器(宝润P6大功率宠物电推剪);高速冷冻离心机(Sigma公司);ND-1000紫外分光光度计(美国NanoDrop公司);电泳仪(美国Bio-Rad公司);凝胶成像分析系统(美国Bio-Rad公司)。
1.3 实验方法
1.3.1 动物的准备
根据动物体重进行肌肉注射盐酸氯胺酮对动物进行麻醉,麻醉剂量为5~10 mg/kg,注射后约5~10 min,待其麻醉后,用剃毛器剃去其右上腹肋间至侧腰部肋缘下区域的被毛,以便于B超探头的探查。将手术垫巾铺在动物手术台上,将已剃好被毛的猕猴置左侧卧位摆放在手术台上,用碘伏进行消毒,并加盖无菌手术洞巾待手术。
1.3.2 B超的准备及穿刺针的安装
从B超介入手术包取出一次性塑料探头套子将3.5 Hz彩色电脑声像仪(MyLab 30CV)探头套上,以避免探头被交叉污染。将ABS421 B超穿刺引导架安装在B超探头上,见图1,将穿刺针安装在活检枪上待用。

注:A:穿刺引导架。图1 安装完成穿刺引导架的3.5 Hz的B超探头Note. A: Puncture guiding frame.Fig.1 A 3.5 Hz transducer fixed with a guiding frame
1.3.3 肝穿刺取材
将3.5 Hz的B超探头于猕猴右上腹肋间区域进行探查,取腋前线的第八肋间以及腋中线的第九肋间作为穿刺点[8]的参考位置,穿刺点的主要依据是在B操引导下,通过B超的定位尤其在穿刺引导架的引导下进行,穿刺者立于猕猴左侧,配合影像操作人员操作[9],当B超探查到穿刺目标并锁定时,根据B超实时图像,注意避让胆囊,将活检枪的射程调为15 mm,将穿刺针在穿刺引导架的引导下垂直经皮肤插入腹部约1 cm,经腹穿刺进针点见图4中的“1”(箭头所示),观察动物的呼吸,轻微移动B超探头,观察B超实时影像,使穿刺目标与穿刺针位置在引导线内,即穿刺目标与穿刺针为垂直部位,并避开胆囊,按动穿刺针扳机按钮进行穿刺,如图2A中“4”显示的白色回声影像为肝脏穿刺针瞬间到达回声,图2B中“3”为猴体内的胆囊,“2”代表整个肝脏回声区域。穿刺后迅速拔出穿刺针。

注:A:进入肝脏的穿刺针超声回声图;B:肝脏超声回声图;C:B超引导下肝脏穿刺示意图。1:穿刺引导线;2:整个肝脏回声区域;3:胆囊;4:穿刺针。图2 肝脏穿刺B超影像及示意图Note. A: Ultrasonic image of the puncture needle into the liver. B: Ultrasonic image of the liver. C: Schematic sketch. 1: Puncture guide line; 2: Whole liver echo area; 3: Gallbladder; 4: Puncture needle.Fig.2 Images and schematic diagram of B-mode ultrasonography of liver puncture
1.3.4 肾穿刺取材
将3.5 Hz的B超探头于猕猴侧腰部肋缘下腹部区域进行探查,当B超探头探到穿刺目标肾时,进一步调整探头的方向以便于确认所要穿刺的肾器官,穿刺目标为右肾下脊实质,穿刺的时候根据B超实时图像,注意避让肾下腔静脉及门静脉,将活检枪的射程调为15 mm,将穿刺针在穿刺引导架的引导下垂直经皮肤插入腹部约1 cm,经腹穿刺进针点见图4中的“2”(箭头所示),观察动物的呼吸,轻微移动B超探头,观察B超实时影像,使穿刺目标与穿刺针位置在引导线内,即穿刺目标与穿刺针为垂直部位,并避开肾血管,按动穿刺针扳机按钮进行穿刺,如图3A中“5”显示的白色回声影像为肾穿刺针瞬间到达回声,图3B中“3”、“4”分别为猴体内靠近肾脏的两大血管,肾腔静脉和门静脉,“2”代表整个肾脏回声区域。穿刺时间为1/1000 s,肾穿刺深度在12~15 mm之间[2],穿刺后迅速拔出穿刺针。
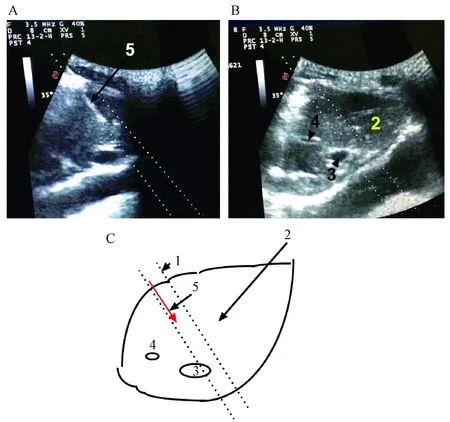
注:A:进入肾脏的穿刺针超声回声图;B:肾脏超声回声图;C:B超引导下肾脏穿刺示意图。1:穿刺引导线;2:整个肾脏回声区域;3:肾腔静脉;4:门静脉;5:穿刺针。图3 肾穿刺B超影像及示意图Note. A: Ultrasonic image of the puncture needle into the kidney. B: Ultrasonic image of the kidney. C: Schematic sketch. 1: Puncture guide line; 2: Whole kidney echo area; 3: Vena cava of kidney; 4: Portal vein; 5: Puncture needle.Fig.3 Images and schematic diagram of B-mode ultrasonography of kidney puncture
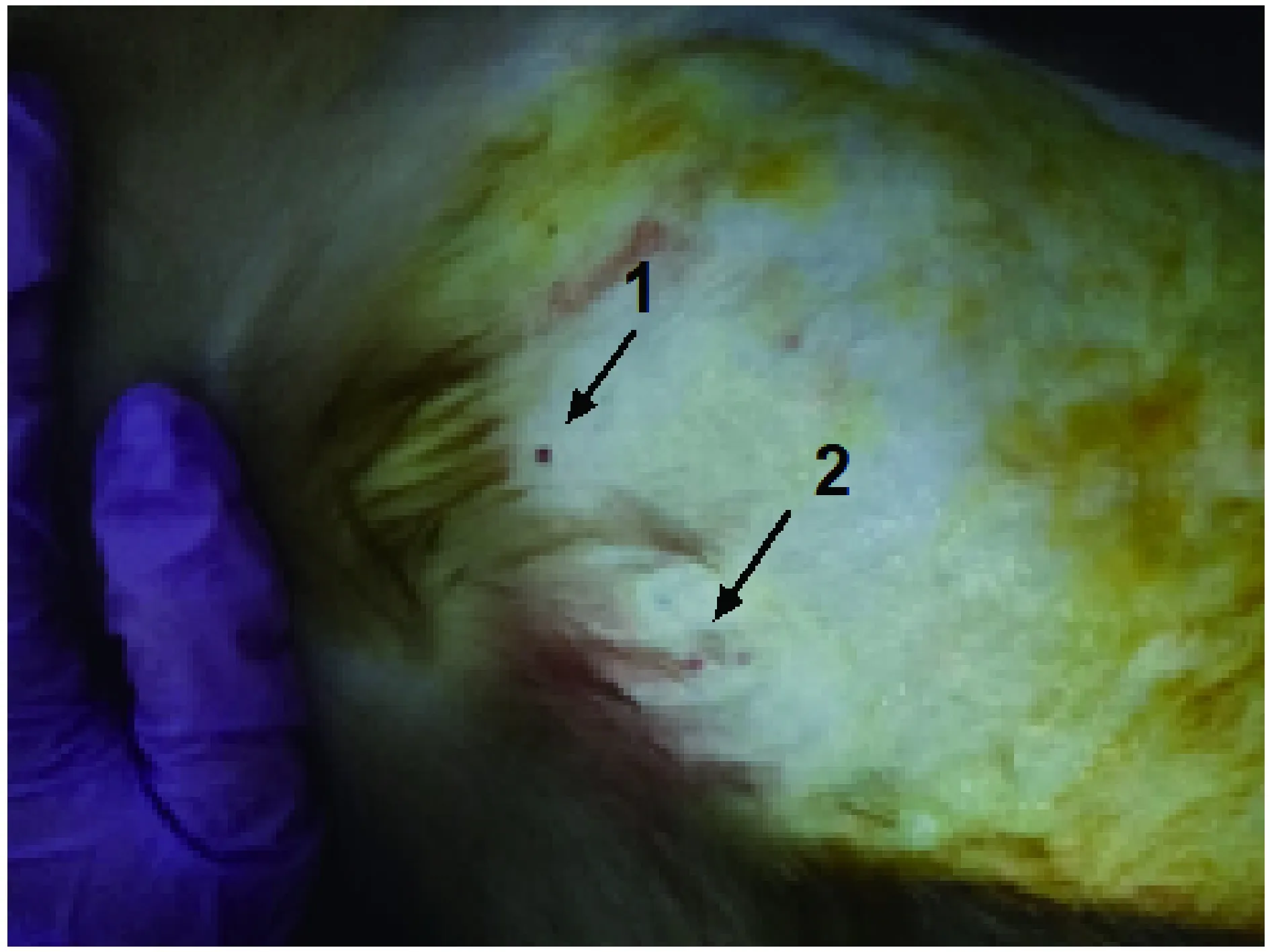
注:1:肝穿刺点;2:肾穿刺点。图4 肝、肾穿刺伤口Note. 1: Puncture site of the liver; 2: Puncture site of the kidney.Fig.4 Puncture sites of the liver and kidney
1.3.5 样品的处理
穿刺后将穿刺针迅速拔出后,肝、肾组织样品已采集到针头的凹槽中,凹槽内腔每枪可获得组织样品约10~14 mg。经测量计算,穿刺针的凹槽内腔体积为13.35 mm3,经肝、肾的质量及体积初步计算得猕猴肝的密度ρ肝=1.0029 mg/mm3,肾的密度ρ肾=0.9923 mg/mm3,故若取样刚好填满穿刺针凹槽内腔,则穿刺取到的样品质量分别为m肝=13.39 mg,m肾=13.25 mg,因取样误差,所取到的样品质量约为10 mg(所取到的样品未填满穿刺针凹槽内腔)~ 14 mg(穿刺非常成功,样品塞满甚至溢出穿刺针凹槽内腔)。将所获得的肝、肾组织置入分装好1 mL TriPure试剂的离心管中,加盖颠倒使组织浸泡在TriPure液体中,标记好样品编号待用。
1.3.6 穿刺术后动物的护理
在穿刺完成后,须再用B超探头扫查腹腔,观察有无腹腔积液,排除大出血情况。为动物的穿刺部位盖上无菌纱布并将小沙袋压在纱布之上,并用布腹带把穿刺部位扎好即可,见图5。为防止动物苏醒后动物大幅度动作引起穿刺部位出血,在动物即将苏醒时根据其状态再次注射相应剂量麻醉剂,可适当延长动物安静休息时间。术后禁食3 h,穿刺术后护理应连续观察动物6 h以上,以防出现需紧急处理的异常情况,次日清晨后可进食[10]。

图5 自制裹腹带包扎穿刺部位Fig.5 The self-made abdominal belt
1.3.7 猕猴肝、肾组织总RNA的提取
将装有新鲜肾组织(10~14 mg)的离心管,放入组织研磨仪(50 Hz,45 s),充分研磨,静置5 min,直至管内为澄清液体,将液体转移至1.5 mL的离心管内,再静置5 min,加入200 μL氯仿,并漩涡振荡,充分静置15 min,再以11 441 r/min于4℃离心25 min,吸取上清液450 μL于另一离心管,加入等体积异丙醇,充分混匀,静置10 min,以11 441 r/min于4℃离心10 min,弃上清液,待管内壁稍干,加入1 mL -20℃预冷的75%乙醇洗涤沉淀,9045 r/min于4℃离心5 min,弃上清液,待内壁充分干燥,加入30 μL DEPC水(无RNA酶水)溶解沉淀。
1.3.8 RNA浓度测定及完整性检测
(1)所提取的RNA浓度测定:取RNA提取液2 μL于ND-1000紫外分光光度计测定RNA浓度。
(2)所提取的RNA完整性检测:取RNA提取液2 μL于1.5%琼脂糖凝胶以90 V、400 mA的条件进行电泳20 min,并于凝胶成像分析系统下观察28s、18s和5s RNA条带,分析RNA的完整性。
2 结果
2.1 穿刺术后观察及动物恢复状况、成活率
在穿刺完成后,用B超探头扫查腹腔,未见腹腔积液,排除大出血情况,经后续观察,动物的呼吸正常、恢复情况良好,动物无一例死亡,成活率100%。
2.2 RNA浓度测定
对所提取的总RNA经ND-1000紫外分光光度计测定RNA浓度,数据如下:其中A260 nm/A280 nm介于1.8~2.0之间,说明所获得的RNA纯度高。见表1。
2.3 RNA检测结果
图6可见5s、18s、28s RNA条带明亮,证明提取得到RNA无降解,可用于后续实验。

表1 所获得的RNA浓度及A260 nm/A280 nm、A260 nm/A230 nm比值Tab.1 Concentration and A260 nm/A280 nm, A260 nm/A230 nm ratios of the extracted total RNA by ultraviolet spectrophotometry

注:1~4:4只动物肾组织;5~8:4只动物肝脏组织。图6 RNA电泳凝胶成像图Note. 1-4: Kidney tissues of 4 animals. 5-8: Liver tissues of 4 animals.Fig.6 Image of RNA gel electrophoresis
3 讨论
近年来,超声技术作为一种非侵入性手段,已应用于人类肝、肾活体穿刺术,定位准确、成功率高、并发症少,弥补了传统手术定位不准、成功率低等不足。目前尚未见利用B超引导,尤其在穿刺引导架定位下,对猕猴进行肝、肾活体穿刺获得组织样品的报道。由于肝内有门静脉之类的大血管,胆囊也离肝比较近,左肾的内侧有腹主动脉,右肾的内侧有下腔静脉,两肾的内后方分别有左、右腰交感干,肾活体穿刺难度大,传统的活体穿刺取材方式只能凭借理论上的解剖位置操作。穿刺针穿刺的深度不能过深,肝穿刺时穿刺过深容易穿透肝或刺破肝大血管甚至刺破胆囊,肾穿刺时穿刺过深容易穿刺到髓质部分,若穿刺到髓质部位将可能导致肾间质的血管损伤而出血,然解剖位置只是在标准体位下的一个参考位置,会因不同的体位和呼吸的急促性而发生改变。用传统的活体穿刺取材方法凭借理论解剖位置和经验在不可视的情况下进行取材,定位可能不准确,容易扎破猕猴的脏器和体内大血管、胆囊等,引起猕猴死亡,存活率没有保障,而且该方法对操作者的要求非常高,必须有丰富的操作经验。相对于传统的穿刺方法,利用B超引导,尤其在穿刺引导架定位下,可对猕猴肝、肾进行较为准确的活体穿刺,以获得组织样品,可有效的避开胆囊、大血管,如下腔静脉及门静脉等重要的致命的大血管,防止动物大出血,避免因为扎破胆囊、大出血等造成的动物死亡,该方法为可视性操作,安全、定位准确、方便、快捷[11],对操作者的要求也没有传统穿刺方法那么高。
与传统的取材方式相比,活体穿刺取材的核心是“精准、快捷”[12],活检枪穿刺后,由于创伤小,取材速度快,只要未刺到大血管,只需为穿刺部位盖上无菌纱布并用布腹带把穿刺部位扎好即可。人体活检需在穿刺结束后予穿刺处无菌纱布覆盖按压5~10 min,再用多头腹带加压包扎[13],而本方法在穿刺位置上用自制沙袋加压,可避免发生皮下渗血,同时使用布腹带包扎,能够降低由于呼吸造成的脏器活动,避免出现肝、肾出血[14]。在术后护理过程中大大节约了人力和操作时间。
通过B超定位,尤其在穿刺引导架的引导下对猕猴进行肝、肾活体穿刺取材,定位准,可有效地避开大血管,无一例死亡,存活率达到100%,此外动物损伤小、出血少,实时、可见,所获得的新鲜组织可直接用于提取RNA,为实验研究的取材方式提供方便、快捷、有效手段。本方法能降低研究成本,并提高实验室非人灵长类动物的生活质量和动物福利,同时保证实验结果的准确性。
[1] 周志强, 杨志伟, 雍伟东.Fkbp51基因敲除对小鼠肝脏转录组基因可变剪接的影响 [J]. 中国比较医学杂志, 2017, 27(5): 31-36.
[2] 刘练, 张高福, 李秋, 等. 阿霉素肾病小鼠的肾脏病理转变过程 [J]. 中国实验动物学报, 2014, 22(2): 13-16.
[3] 武光东, 邱彬, 王婷婷, 等.Fkbp51基因敲除小鼠心脏与肝脏RNA表达谱系的分析比较 [J]. 中国比较医学杂志, 2017, 27(7): 1-5.
[4] 王冬平, 孙岩松, 杨晓, 等.Smad3基因剔除对小鼠肾脏功能的影响 [J]. 中国比较医学杂志, 2003, 13(4): 227-230.
[5] 徐凯旋, 李宁宁, 管磊剑, 等. 孕前炔雌醇暴露对大鼠子代糖代谢变化和肝脏糖代谢相关基因表达的影响 [J]. 中国实验动物学报, 2016, 24(3): 221-227.
[6] 邓虔玉, 劳燕冰, 叶佩仪. 经皮肾脏穿刺活检术在B型超声引导下的效果及护理 [J]. 医疗装备, 2015, 28(17): 185-186.
[7] 黄淇, 金晓明, 毕延忠. 肾脏活体组织穿刺取材几点体会 [J]. 哈尔滨医科大学学报, 2002, 36(2): 114.
[8] 张维龙. 经皮肝脏穿刺活检的技巧及临床分析 [J]. 中外医疗, 2015, 34(7): 70-71.
[9] 黄志寅, 张琼英, 王玉芳, 等. 猕猴全结肠内镜检查方法与观察 [J]. 中国比较医学杂志, 2016, 26(4): 68-71.
[10] 王新华. 148例肝脏活检术患者的护理体会 [J]. 中国医药指南, 2016, 14(21): 240.
[11] 张虹雨, 范晓娜, 黄敏, 等. 猕猴结肠镜下活检组织病理学观察 [J]. 中国比较医学杂志, 2010, 20(6): 66-68, 84.
[12] 代小伟, 朱华, 刘颖, 等. 非人灵长类动物胃镜检测技术的建立 [J]. 中国比较医学杂志, 2008, 18(9): 75-77.
[13] 戴瑞如, 郁晓梅, 季冬梅. 老年患者行超声引导下肝穿刺活检术的观察与护理 [J]. 南通大学学报(医学版), 2015, 35(5): 475-476.
[14] 王全楚, 申德林, 焦栓林, 等. 肝穿组织学检查在非病毒性肝病诊断中的价值 [J]. 实用肝脏病杂志, 2006, 9(1): 46-47.
