超声三维斑点追踪技术检查肝硬化患者左心室收缩功能初步研究
2018-03-28余珊珊孙露韩东刚乞艳华姜珏周琦
余珊珊,孙露,韩东刚,乞艳华,姜珏,周琦
常规超声心动图检查对心脏功能判断的敏感性不高,不易早期发现左心室收缩功能异常[1-3]。超声斑点追踪成像技术(3-dimensional speckle tracking imaging,3D-STI)是在超声二维图像基础上追踪心肌运动、评价心脏功能的新方法[4,5]。据报道[6],3D-STI可实时记录心室力学参数变化,准确评价心脏收缩功能。本研究采用该技术评价了68例肝硬化患者的左心室收缩功能,现将结果报告如下。
1 资料与方法
1.1 一般资料 2013年1月~2014年12月西安交通大学第二附属医院感染病科收治的肝炎肝硬化患者68例,男37例,女31例;年龄42~68岁,平均年龄(52.69±7.24)岁。符合肝硬化临床诊断标准,肝脏超声声像图表现符合肝炎肝硬化改变。Child-Pugh A 级 25例,Child B 级 33例,Child C级10例。排除标准:①伴有心、肺、肾原发性疾病者;②合并糖尿病、高血压、甲状腺功能亢进症者;③检查前2周内使用过影响心脏功能的药物者。另选择同期门诊健康体检者30例,男18例,女12例;年龄37~65岁,平均年龄(50.47±8.07)岁。肝硬化患者与健康人性别和年龄差异无统计学意义(P>0.05),具有可比性。
1.2 超声检查 使用美国GE公司生产的Vivid E9超声诊断仪。受检者取左侧卧位,连接心电图,常规测量左室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左室收缩末期内径(left ventricular end systolic diameter,LVESD)、左室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左室收缩末期容积(left ventricular end-systolic volume,LVESV)、左室射血分数(left ventricular ejection fraction,LVEF)。于心尖部启动三平面成像模式,调整探头位置和角度,以获取心尖四腔、三腔、二腔切面,帧频>35帧/s。启动自动功能成像模式,系统自带的4D TEE成像方法自动将左心室各壁分为17个节段,即基底段(前间隔、后间隔、前壁、后壁、侧壁、下壁6个节段)、中间段(6个节段同基底段)、心尖段(前壁、侧壁、间隔、下壁4个节段)和心尖帽,在三维斑点追踪分析环境下,选取心尖四腔、二腔和三腔的清晰图像,手动描绘出左心室心内膜边界,调节曲线,使所有回声斑点位于心肌内,用3DQ软件计算应变数值。
1.3 随访 对68例入选患者进行随访,随访形式为电话结合门诊复查,截止至2017年4月,了解患者预后情况。
1.4 统计学方法 应用SPSS 19.0软件处理数据,计量资料以(±s)表示,采用独立样本 t检验;采用ROC曲线分析指标的预测价值,P<0.05为差异有统计学意义。
2 结果
2.1 常规超声参数检测情况 肝硬化患者LVEDV和LVESV均显著高于健康人(P<0.001),而LVEDD、LVESD和LVEF与健康人的差异无统计学意义(P>0.05,表1)。
2.2 3D-STI检测左心室收缩期峰值应变情况 肝硬化患者基底段、中间段、心尖段、心尖帽的收缩期峰值应变指标均显著低于健康人(P<0.001,表2)。
2.3 肝硬化患者左心室收缩期峰值应变与预后的关系 在68例患者中,失访3例,65例完成随访。在随访期间死亡21例(30.9%)。将65例患者心脏基底段、中间段、心尖段、心尖帽的收缩期峰值应变值输入SPSS 19.0软件中,对随访结果取二分变量(死亡为“1”、生存为“0”)。采取 ROC 模型对 3D-STI检测的左心室收缩期峰值应变值进行预后预测,结果显示基底左心室收缩期峰值应变值预测死亡的ROC面积为0.857,应变值为18.85,敏感度为78.6%,特异度为82%;中间左心室收缩期峰值应变预测死亡的ROC面积为0.893,应变值为20.05,敏感度为69%,特异度为91%;心尖左心室收缩期峰值应变预测死亡的ROC面积为0.869,应变值为16.25,敏感度为85.7%,特异度为66.7%;心尖帽左心室收缩期峰值应变预测死亡的ROC面积为0.866,应变值为18.05,敏感度为74.7%,特异度为84.5%。肝硬化患者基底段、中间段、心尖段、心尖帽收缩期峰值应变对患者预后的ROC预测模型见图1。
表1 两组常规心脏超声参数(±s)的比较

表1 两组常规心脏超声参数(±s)的比较
例数 LVEDD(cm) LVESD(cm) LVEDV(ml) LVESV(ml) LVEF(%)肝硬化 68 4.4±0.8 2.4±0.5 122.7±16.3 46.2±6.2 65.0±7.7健康人 30 4.2±0.7 2.2±0.4 102.6±12.2 35.3±5.2 67.6±7.8 t值 - 0.355 0.212 6.042 8.407 1.535 P值 - 0.724 0.833 0.000 0.000 0.128
表2 两组3D-STI检测的左心室收缩期峰值应变指标(±s)比较

表2 两组3D-STI检测的左心室收缩期峰值应变指标(±s)比较
例数 基底 中间 心尖 心尖帽肝硬化 68 18.8±4.3 19.2±4.2 18.6±3.5 19.2±4.1健康人 30 21.3±5.2 23.8±3.9 22.4±4.1 23.9±4.3 t值 - 2.485 5.104 4.696 5.153 P值 - 0.015 0.000 0.000 0.000
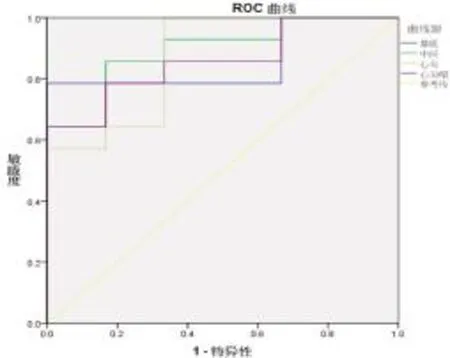
图1 基底段、中间段、心尖段、心尖帽收缩期峰值应变对患者预后的ROC预测模型
3 讨论
据报道[7,8],肝硬化患者左心室收缩功能减退的原因可能包括长期处于高动力循环、相关信号通路异常、容量负荷增加、受到毒性物质作用等。心肌纤维排列方式独特,且心肌运动呈复杂三维立体模式[9],故而对心脏功能的评价也需从多角度进行。多项研究显示[10-12],肝硬化心脏功能异常患者在肝移植或介入性手术治疗过程中,可能会诱发心力衰竭。早期发现肝硬化患者的左心功能异常可通过有效预防措施阻止其进一步发展,避免不利的有创治疗操作。
传统超声心动图是心脏超声的技术基础,但有研究指出,其所采用的心功能指标所反映的心肌运动存在一定的片面性,对结果的解读也会出现一定的主观性。目前认为,超声心动常规检查可发现左心室舒张功能改变,但难以早期检测收缩功能异常。组织多普勒成像技术对心肌收缩具有定量评价作用,但结果易受到角度、运动伪像及相邻节段运动等多种因素的影响。3D-STI是建立在二维斑点追踪成像技术基础上的超声新技术,通过逐帧追踪三维灰阶图像中均匀分布于心肌内的散射斑点,并利用空间-时间图像处理算法获取心肌组织的运动信息,从而对心肌整体和局部真实运动状态与功能进行全面评价。有研究称,3D-STI的优势在于其不受声束方向与室壁运动方向夹角的影响,对心室几何学形态无依赖,可弥补传统超声心动图与组织多普勒成像技术的不足,是评估心肌收缩功能的有效手段。
本研究将肝硬化患者与健康人的常规超声参数进行对比,结果显示肝硬化患者LVEDV、LVESV均显著高于健康人 (P<0.001),LVEDD、LVESD、LVEF等参数与健康人则无明显差异,可见常规超声参数对左心室收缩功能异常的检测敏感性较低。3D-STI将心肌分为基底段、中间段、心尖段及心尖帽4个部分共17个节段,利用自带软件计算不同部位的应变数值,结果显示肝硬化患者基底段、中间段、心尖段、心尖帽的收缩期峰值应变较之健康人均明显偏低,差异显著,表现为肝硬化患者基底段、中间段、心尖段、心尖帽的收缩期峰值应变均低于健康人(P<0.001),提示3D-STI对肝硬化患者左心室收缩功能异常的检测具有较高的敏感性。
有研究认为,肝硬化患者心脏超声3D-STI检测结果异常的理论基础在于:①肝功能减退引起肝短路循环及血容量增加;②体内扩血管物质增多,对缩血管物质的敏感性降低,外周血管发生广泛性扩张。心脏运动主要由局部纤维的缩短及周围区域的牵拉共同控制正常节段的速度。因而有时部分节段即便已经出现活动障碍,但受到邻近组织的牵拉,仍可具有正常节段的运动速度。STI是建立在心肌应变及应变率成像基础上的诊断技术。由于心肌应变基本不受周围心肌牵拉和心脏整体运动的干扰,故而对心肌收缩的判定具有较高的准确性,有利于对左心室收缩障碍的判断。二维斑点追踪对心肌运动的观察局限于二维平面,心脏的真实运动被忽略,所追踪的运动轨迹可能与真实运动轨迹存在偏差[13,14]。3D-STI在三维空间上对心肌回声斑点进行实时追踪及测量,有助于全面分析心脏功能,早期发现心脏收缩异常。有研究证实[15-19],3D-STI可在左心室构型发生改变前检测出左心室收缩功能异常,是早期诊断心脏收缩功能异常的有效手段。本研究通过ROC预测模型分析了基底段、中间段、心尖段、心尖帽收缩期峰值应变对患者预后的预测价值,结果显示,基底段、中间段、心尖段、心尖帽的收缩期峰值应变对肝硬化患者死亡预测模型的曲线下面积分别为 0.857、0.893、0.869、0.866,且具有较高的敏感度和特异度。有研究也证实,超声3D-STI的检测结果对患者预后有一定的预测价值,与本研究结论一致,但基底段、中间段、心尖段、心尖帽的收缩期峰值应变的临界值存在一定的差异,推测与样本量有关,有待进一步扩大样本量以消除个体差异对研究结果的影响,为肝硬化患者左心室收缩功能评估提供更精确的信息。
综上所述,肝硬化患者左心室局部收缩功能减退,3D-STI检测有利于早期发现肝硬化患者左心室收缩障碍,对患者预后也有一定的预测价值。
[1]张文忠.155例肝硬化患者流行病学特征分析.实用肝脏病杂志,2012,15(1):55-56.
[2]Nazar A,Guevara M,Sitges M,et al.LEFT ventricular function assessed by echocardiography in cirrhosis:relationship to systemic hemodynamics and renal dysfunction.J Hepatol,2013,58(1):51-57.
[3]Ruíz-del-Arbol L,Achécar L,Serradilla R,et al.Diastolic dysfunction is a predictor of poor outcomes in patients with cirrhosis,portal hypertension,and a normal creatinine.Hepatology,2013,58(5):1732-1741.
[4]Wong F,Raina N,Richardson R.Molecular adsorbent recirculating system is ineffective in the management of type 1 hepatorenal syndrome in patients with cirrhosis with ascites who have failed vasoconstrictor treatment.Gut,2010,59(3):381-386.
[5]陈春,伍思国,杨智娟,等.肝硬化上消化道出血患者预后因素分析. 实用肝脏病杂志,2015,18(3):300-301.
[6]Sattarzadeh-Badkoubeh R,Geraiely B,Nassiri-Toosi M,et al.E-valuation of cardiac systolic function in cirrhotic patients undergoing liver transplantation.Acta Med Iran,2015,53 (8):476-481.
[7]Mottram PM,Leano R,Marwick TH.Usefulness of B-type natriuretic peptide inhypertensive patients with exertional dyspnea and normal left ventricular ejection fraction and correlation with new echocardiographic indexes of systolic and diastolic function.Am J Cardiol,2003,92(12):1434-1438.
[8]Hung KC,Huang HL,Chu CM,et al.Evaluating preload dependence of a novel Doppler application in assessment of left ventricular diastolic function during hemodialysis.Am J Kidney Dis,2004,43(6):1040-1046.
[9]Miyashita T,Okano Y,Takaki H,et al.Relation between exercise capacity and left ventricular systolic versus diastolic function during exercise in patientsaftermyocardialinfarction.Coron Artery Dis,2001,12(3):217-225.
[10]任秀昀,徐惠,舒清明,等.超声弹性成像评估离体肝硬化标本结节性病变性质的初步研究.中华超声影像学杂志,2010,19(1):29-31.
[11]Mindikoglu AL,Dowling TC,Wong-You-Cheong JJ,et al.A pilot study to evaluate renal hemodynamics in cirrhosis by simultaneous glomerular filtration rate,renal plasma flow,renal resistive indices and biomarkers measurements.Am J Nephrol,2014,39(6):543-552.
[12]Gassanov N,Caglayan E,Semmo N,et al.Cirrhotic cardiomyopathy:acardiologist'sperspective.World JGastroenterol,2014,20(42):15492-15498.
[13]钱嵘,熊爱民,杨唯衷,等.超声三维斑点追踪技术评价肝硬化患者右心室心肌功能. 肝脏,2016,21(12):1030-1032.
[14]ZalewskiP,JonesD,Lewis I,etal.Reduced thoracic fluid content in early-stage primary biliary cirrhosis that associates with impaired cardiac inotropy.Am J Physiol Gastrointest Liver Physiol,2013,305(6):393-397.
[15]Altekin RE,Caglar B,Karakas MS,et al.Evaluation of subclinical left ventricular systolic dysfunction using two-dimensional speckle-tracking echocardiography in patients with non-alcoholic cirrhosis.Hellenic J Cardiol,2014,55(5):402-410.
[16]Goyal S,Dixit VK,Jain AK,et al.Intrarenal resistance index(RI)as a predictor of early renal impairment in patients with liver cirrhosis.Trop Gastroenterol,2013,34(4):235-239.
[17]Bellot P,García-Pagán JC,Francés R,et al.Bacterial DNA translocation is associated with systemic circulatory abnormalities and intrahepatic endothelial dysfunction in patients with cirrhosis.Hepatology,2010 ,52(6):2044-2052.
[18]Chen Y,Chan AC,Chan SC,et al.A detailed evaluation of cardiac function in cirrhotic patients and its alteration with or without liver transplantation.J Cardiol,2016,67(2):140-146.
[19]Mandorfer M,Bota S,Schwabl P,et al.Nonselective β blockers increase risk for hepatorenal syndrome and death in patients with cirrhosisand spontaneousbacterialperitonitis.Gastroenterology,2014,146(7):1680-1690.