消黄利胆汤联合穴位电刺激治疗对急性黄疸型肝炎患者肝功能及血液流变性的影响*
2018-03-28万晓燕白雪峰
万晓燕 白雪峰
(延安大学附属医院,陕西 延安 716000)
急性黄疸型肝炎属于临床常见急性消化道传染病,多由肝炎病毒所致,临床表现为黄疸、肝损害等,部分患者伴有食欲不振、上腹不适等症状,治疗不及时,可转化为慢性肝炎、肝炎肝硬化,严重时可诱发肝癌,危及患者生命健康[1]。目前临床多采用护肝、降酶、退黄等方式治疗急性黄疸型肝炎,但整体治疗效果欠佳[2]。中医根据急性黄疸型肝炎发病机制进行辨证论治,不良反应少,安全性高[3]。穴位电刺激属于中医特色疗法,通过刺激穴位可平衡阴阳、调理脾胃,达到缓解胃肠症状的目的。消黄利胆汤属于本院经验方剂,具有疏肝利胆、清利湿热之功效[4]。目前关于二者联合用于治疗急性黄疸型肝炎的资料较少,基于此,本研究采用消黄利胆汤联合穴位电刺激治疗急性黄疸型肝炎患者,旨在为此类患者寻求高效、安全的治疗方案。现报告如下。
1 资料与方法
1.1 病例选择 1)诊断标准:西医诊断标准参考《病毒性肝炎防治方案》[5]中关于急性黄疸型肝炎诊断标准,并经肝功能试验确诊。中医诊断标准参考《中医病证诊断疗效标准》[6]中关于急性黄疸型肝炎诊断标准,结合临床表现,制定诊断标准。(1)主症脘闷腹胀、身目俱黄、便溏不爽、肢体困重。(2)次症胁肋疼痛、口渴少饮、倦怠乏力、食欲不振。(3)舌红,苔黄腻,脉滑或弦。需同时具备主症≥1项和次症≥2项,结合舌脉象,可确诊为急性黄疸型肝炎。2)纳入标准:符合下述西医、中医诊断标准者;年龄18~70岁;均未接受其他药物治疗者;肝炎类型均为乙型肝炎;经医院伦理委员会批准,患者均知情同意。3)排除标准:中毒性、自身免疫性或其他类型肝炎;穴位电刺激或中药禁忌证;妊娠及哺乳期妇女;胆囊炎、胆总管扩张等肝外病变;肝癌或合并其他恶性肿瘤;严重心、脑、肝、肾等器质性疾病;失代偿期肝硬化、肝衰竭、慢性肝炎;血液、免疫、内分泌等系统性疾病;视听、失语、认知等功能障碍;胆道结石或狭窄所致黄疸。
1.2 临床资料 选取2016年6月至2017年6月笔者所在医院收治的急性黄疸型肝炎患者126例作为研究对象,按照随机数字表法分为观察组和对照组各63例。观察组男性41例,女性22例;年龄24~65岁,平均(35.68±5.21)岁;病程 1~6 d,平均(3.85±1.20) d。 对照组男性44例,女性19例;年龄23~67岁,平均(35.79±5.32)岁;病程 1~7 d,平均(3.78±1.14) d。 两组性别、年龄、病程等资料比较,差异均无统计学意义(均P>0.05)。
1.3 治疗方法 1)基础治疗:两组均给予常规保肝治疗[7],包括静脉滴注复方甘草酸苷和还原型谷胱甘肽;同时进行健康教育,禁止抽烟和饮酒,注重补充高蛋白、维生素和微量元素,适当运动。2)对照组:给予穴位电刺激治疗。穴位选择:肝俞、三阴交、脾俞、足三里、期门、章门、天鼎、中脘、涌泉穴。使用酒精清洁上述穴位,干燥后粘贴一次性电极贴片,并将其与3对电极连接,采用双向对称方波,设置频率、刺激强度分别为2/15 Hz、25 mA,30 min/次,每日2次,共治疗4周。3)观察组:在对照组基础上联合消黄利胆汤治疗。组方:茵陈、金钱草各30,当归、鸡内金、桃仁、厚朴各20 g,苍术、赤芍、陈皮、柴胡、泽泻、金银花各15 g,大黄、芒硝各5 g。上述药物加水高出药面3 cm,浸泡30 min后使用大火煮沸,改为文火煎煮30 min,加水复煎,两次药汁混合,分别于早晚饭后温服,每日1剂,共治疗4周。
1.4 观察指标 1)中医证候积分。按照症状正常、轻度、中度、重度将主症和次症依次记为0~6分和0~3分[8],并计算主症:脘闷腹胀、身目俱黄、便溏不爽积分,症状随分值升高而越严重。2)临床疗效。参照疗效判定标准。3)肝功能。分别于治疗前、治疗后检测总胆红素(TBil)、谷草转氨酶(GOT)、直接胆红素(DBil)、谷丙转氨酶(ALT),均采用全自动分析仪检测。4)血液流变性。分别于治疗前、治疗后检测全血高切黏度、血浆黏度、血小板黏附率、全血低切黏度,均采用全自动血液分析仪检测。5)炎症因子:分别于治疗前、治疗后检测血清肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)水平,采集空腹时外周静脉血5 mL,离心并分离血清,均按照试剂盒说明书采用酶联免疫吸附试验法检测,试剂盒购于天津市赛瑞达生物工程有限公司。
1.5 疗效标准 参照《中药新药临床研究指导原则》[9],并结合采用尼莫地平法计算的疗效指数进行判定。显效:黄疸、乏力等临床症状基本消失,肝功能轻度异常,疗效指数≥70%;有效:黄疸、乏力等临床症状有所缓解,肝功能较治疗前有所改善,疗效指数为40%~70%(不包括70%);无效:未达到上述标准。总有效率=(显效+有效)/总例数。
1.6 统计学处理 应用SPSS18.0统计软件。计量资料以(±s)表示,采用 t检验。 计数资料用“率”描述,用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗前后中医证候积分比较 见表1。治疗前两组脘闷腹胀、身目俱黄、便溏不爽积分比较,差别均不大(均P>0.05)。治疗后两组脘闷腹胀、身目俱黄、便溏不爽积分均低于治疗前(均P<0.05),且观察组均低于对照组(均 P<0.05)。
表1 两组治疗前后中医证候积分比较(分,±s)

表1 两组治疗前后中医证候积分比较(分,±s)
与本组治疗前比较,*P<0.05;与对照组治疗后比较,△P<0.05。
组 别 时间 便溏不爽脘闷腹胀 身目俱黄观察组 治疗前 4.5 1±1.4 5(n=8 0) 治疗后 1.8 9±0.3 0*△对照组 治疗前 4.4 6±1.2 7 4.3 9±1.1 2 4.3 6±1.1 5 1.9 5±0.4 7*△ 1.8 7±0.4 1*△4.3 2±1.0 5 4.2 9±1.0 1(n=8 0) 治疗后 2.2 8±0.4 3*2.6 8±0.5 4* 2.5 3±0.4 5*
2.2 两组临床疗效比较 见表2。观察组总有效率高于对照组(P<0.05)。

表2 两组临床疗效比较[n(%)]
2.3 两组治疗前后肝功能比较 见表3。治疗前两组TBil、AST、DBil、ALT 水平比较差异差别均不大(均 P>0.05)。治疗后两组 TBil、GOT、DBil、ALT 水平均低于治疗前(均 P<0.05),且观察组均低于对照组(均 P<0.05)。
表3 两组治疗前后肝功能比较(±s)
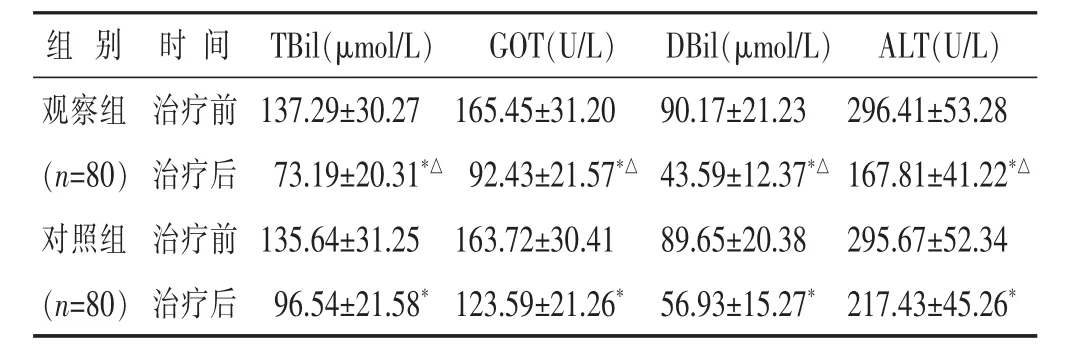
表3 两组治疗前后肝功能比较(±s)
与本组治疗前比较,*P<0.05;与对照组治疗后比较,△P<0.05。下同。
组别 时间T B i l(μ m o l/L) G O T(U/L) D B i l(μ m o l/L) A L T(U/L)观察组 治疗前(n=8 0) 治疗后对照组 治疗前1 3 7.2 9±3 0.2 7 1 6 5.4 5±3 1.2 0 9 0.1 7±2 1.2 3 2 9 6.4 1±5 3.2 8 7 3.1 9±2 0.3 1*△ 9 2.4 3±2 1.5 7*△ 4 3.5 9±1 2.3 7*△ 1 6 7.8 1±4 1.2 2*△1 3 5.6 4±3 1.2 5 1 6 3.7 2±3 0.4 1 8 9.6 5±2 0.3 8 2 9 5.6 7±5 2.3 4(n=8 0) 治疗后9 6.5 4±2 1.5 8*1 2 3.5 9±2 1.2 6* 5 6.9 3±1 5.2 7* 2 1 7.4 3±4 5.2 6*
2.4 两组治疗前后血液流变学指标比较 见表4。治疗前两组全血高切黏度、血浆黏度、血小板黏附率、全血低切黏度比较,差别均不大(均P>0.05)。治疗后两组全血高切黏度、血浆黏度、血小板黏附率、全血低切黏度均低于治疗前(均P<0.05),且观察组均低于对照组(均 P<0.05)。
表4 两组治疗前后血液流变学指标比较(±s)
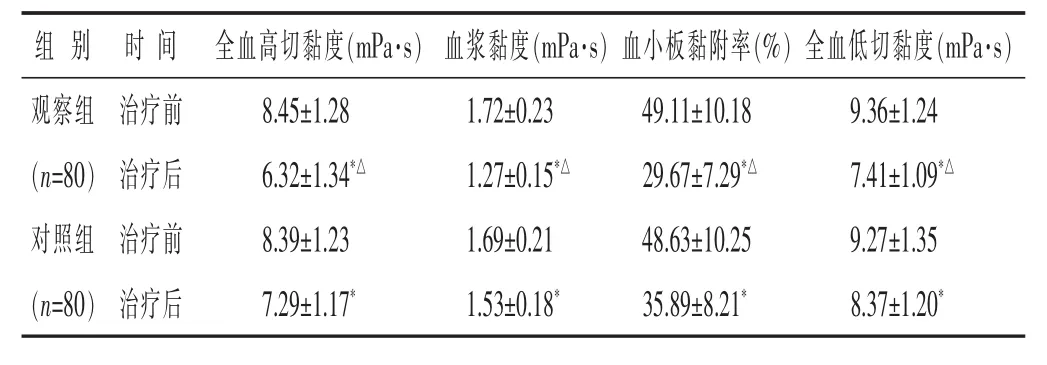
表4 两组治疗前后血液流变学指标比较(±s)
组别 时间全血高切黏度(m P a·s) 血浆黏度(m P a·s)血小板黏附率(%)全血低切黏度(m P a·s)观察组 治疗前(n=8 0) 治疗后对照组 治疗前8.4 5±1.2 8 1.7 2±0.2 3 4 9.1 1±1 0.1 8 9.3 6±1.2 4 6.3 2±1.3 4*△ 1.2 7±0.1 5*△ 2 9.6 7±7.2 9*△ 7.4 1±1.0 9*△8.3 9±1.2 3 1.6 9±0.2 1 4 8.6 3±1 0.2 5 9.2 7±1.3 5(n=8 0) 治疗后7.2 9±1.1 7* 1.5 3±0.1 8* 3 5.8 9±8.2 1* 8.3 7±1.2 0*
2.5 两组治疗前后炎症因子水平比较 见表5。治疗前两组TNF-α、IL-6水平比较差别均不大 (均 P<0.05)。治疗后两组TNF-α、IL-6水平均低于治疗前(均 P<0.05),且观察组均低于对照组(均 P<0.05)。
表5 两组治疗前后炎症因子水平比较(ng/L,±s)
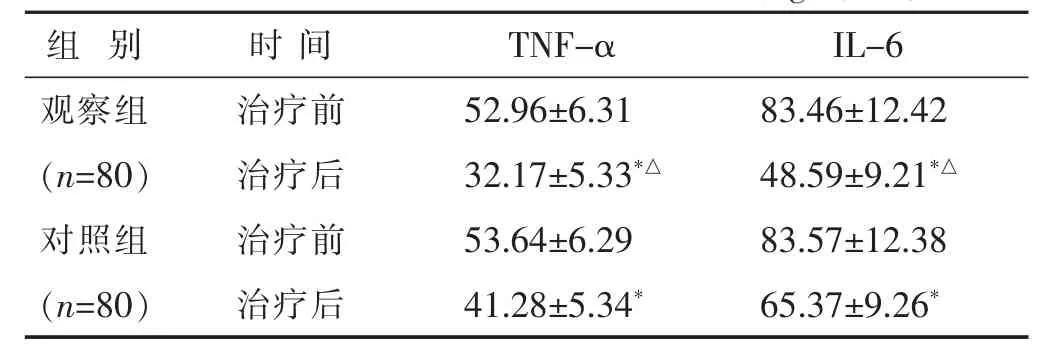
表5 两组治疗前后炎症因子水平比较(ng/L,±s)
组 别 时间T N F-α I L-6观察组 治疗前(n=8 0) 治疗后对照组 治疗前5 2.9 6±6.3 1 8 3.4 6±1 2.4 2 3 2.1 7±5.3 3*△ 4 8.5 9±9.2 1*△5 3.6 4±6.2 9 8 3.5 7±1 2.3 8(n=8 0) 治疗后4 1.2 8±5.3 4* 6 5.3 7±9.2 6*
3 讨 论
急性黄疸型肝炎属于临床常见多发病,肝炎病毒是引起该病主要原因,其刺激肝脏免疫活性细胞,释放大量炎性因子,引起肝细胞变性、坏死,并破坏肝组织,阻塞胆小管,阻碍胆红素正常排泄,最终引起黄疸。大量研究证实[10],炎症反应在急性黄疸型肝炎发病过程中发挥重要作用。TNF-α、IL-6均是介导肝内免疫的因子,TNF-α在肝组织出现炎症时,可刺激枯否氏细胞大量释放,促进炎性物质释放,从而破坏肝细胞。IL-6由多种细胞产生,并在多种疾病发生中起着重要参与作用,其具有广泛生物活性,并参与肝脏炎症损伤。有研究表明[11],TNF-α、IL-6 与肝功能损伤程度呈正相关,可用于评估肝脏疾病的严重程度。
急性黄疸型肝炎可归于中医学 “黄疸”范畴,《内经》中指出“湿热相交,民当病疸”;《温病条辨》中论述“湿热不解,久酿成疸”。中医认为该病多由湿热之毒侵及脾胃,致肝气郁结发为该病[12]。目前穴位电刺激是治疗急性黄疸型肝炎常用方法,将电刺激与针灸进行充分结合,采用低频脉冲电流刺激特定穴位而影响器官,针刺期门具有疏肝理气、健脾养胃之功效;针刺章门,能够有效刺激肝经和胆经,调节五脏疾病,达到理气散结目的[13]。针刺肝俞和脾俞,能够疏肝利胆、清热利湿。三阴交作为阴经交汇处,能够行气活血。足三里是胃下合穴,针刺该穴能够疏风化湿。消黄利胆汤属于本院经验方剂,现代药理研究表明[14],茵陈中所含的茵陈色原酮可增强肝脏清除能力,保护受损肝组织。金钱草中的黄酮类成分可有效促使肝细胞分泌胆汁,松弛胆道括约肌,通过促进胆汁排泄从而发挥利胆功效[15]。赤芍具有抗凝血和氧化作用,并能降低胆红素含量。大黄中有效成分大黄素、大黄酸等可促进胆汁分泌,并具有退黄功效。
本研究结果示观察组中医证候积分、临床疗效优于对照组,提示采用消黄利胆汤联合穴位电刺激可有效改善急性黄疸型肝炎患者临床症状,并提高临床治疗效果。本研究于治疗后对患者肝功能进行检测,结果示观察组 TBil、GOT、DBil、ALT 水平优于对照组,提示二者联合可有效提高患者肝功能,分析原因是消黄利胆汤中的鸡内金、柴胡等具有保肝利胆作用。对血液流变学指标进行检测,结果发现观察组全血高切黏度、血浆黏度、血小板黏附率、全血低切黏度优于对照组,提示二者联合可改善患者血液微循环,分析原因与消黄利胆汤中的桃仁、赤芍等具有益气活血作用有关。本研究进一步对相关血清炎症因子进行检测,结果表明观察组TNF-α、IL-6水平优于对照组,提示二者联合能够有效消除炎症反应。
综上所述,采用消黄利胆汤联合穴位电刺激治疗急性黄疸型肝炎患者,能够有效改善临床症状,提高肝功能,改善血液流变性,降低TNF-α、IL-6水平,提高临床疗效。但由于样本数量限制,研究结果存在不足之处,今后将重视在扩大研究样本基础上进行深入探讨。
[1] 李妍.复方甘草酸苷注射液与前列地尔联合治疗急性黄疸型肝炎的临床效果研究[J].中国现代医生,2017,55(13):102-104.
[2] 左瑞菊,徐春军,邹济源.丹参注射液联合甘草酸二胺治疗黄疸型肝炎疗效观察[J].海南医学,2016,27(24):4001-4003.
[3] 单思,聂鹏,席惠芳,等.中药治疗黄疸研究进展[J].世界中医药,2016,11(11):2486-2489.
[4] 陈小莉.自制利胆退黄汤治疗黄疸型肝炎30例临床观察[J].浙江中医杂志,2016,51(7):497-498.
[5] 中华医学会传染病与寄生虫病学分会,肝病学分会.病毒性肝炎防治方案[J].中华内科杂志,2001,40(1):62-68.
[6] 国家中医药管理局.中医病证诊断疗效标准[M].南京:南京大学出版社,1994.
[7] 余波.血必净联合还原型谷胱甘肽治疗急性黄疸型肝炎疗效观察[J].肝脏,2013,18(5):355-356.
[8] 张丽.茵虎退黄方联合茴三硫治疗黄疸型病毒性肝炎湿热瘀阻证的临床研究[D].成都:成都中医药大学,2013.
[9] 中华人民共和国卫生部.中药新药临床研究指导原则[M].北京:中国医药科技出版社,2002:228-229.
[10]彭福江,张天晓,袁美蓉.复方甘草酸苷对慢性乙型肝炎患者肝功能、肝纤维化指标及炎症因子的影响[J].海南医学院学报,2017,23(4):485-488,492.
[11]李艺.加减健脾清化方联合干扰素治疗对慢性型肝炎脾虚湿盛证患者血清 TNF-α、IL-6影响[D].郑州:河南中医学院,2015.
[12]汪四八,陈玉荣.泻热通腑汤保留灌肠治疗急性黄疸型肝炎临床研究[J].中医学报,2016,31(12):1984-1986.
[13]董双龙,李银彩,王飞.经皮穴位电刺激治疗甲型急性黄疸型肝炎的临床疗效[J].临床合理用药杂志,2016,9(3):106-108.
[14]樊亚巍.清热利湿活血法治疗急性黄疸型肝炎临床观察[J].中国中医急症,2013,22(7):1207-1208.
[15]张炯善,滕立春,杨宏志,等.利胆消黄汤对肝胆湿热型急性黄疸型肝炎患者的疗效观察[J].中药材,2015,38(3):651-652.
