不同造模因素复制小鼠高尿酸血症模型的比较研究
2018-03-28朱祥祥方颖莹庞敏霞李波陈素红吕圭源
朱祥祥 方颖莹 庞敏霞 李波 陈素红 吕圭源
1.浙江中医药大学 杭州 310053 2.浙江工业大学
高尿酸血症(hyperuricemia,HUA)是指嘌呤代谢紊乱,尿酸(uric acid,UA)排泄障碍引起的UA的生成增多或排泄减少,导致血清UA水平超过正常值的疾病[1]。近年来HUA发病率逐年升高[2],且与痛风、肾脏疾病、高血压、高血脂等都具有相关性[3-4],严重危害人们健康,且临床治疗药物缺乏,因此建立有效的HUA动物模型和研发降UA新药任务紧迫。
目前常用的HUA动物模型造模途径主要有:(1)增加UA前体物质,促进UA生成,如黄嘌呤、次黄嘌呤、腺嘌呤等。(2)抑制肾脏对UA的排泄,如乙胺丁醇等。(3)尿酸酶抑制剂,如氧嗪酸钾等通过抑制尿酸酶活性,达到抑制UA分解的作用[5-6]。(4)诱导机体代谢紊乱导致HUA,如脂肪乳剂[7]、高果糖等可诱导机体代谢紊乱,进而升高血清UA水平。本研究采用UA前体物质(腺嘌呤、黄嘌呤、次黄嘌呤)分别和尿酸酶抑制剂(氧嗪酸钾)、抑制UA排泄的药物(乙胺丁醇)联合造模。胡庆华等[8]采用氧嗪酸钾250mg·kg-1成功诱导小鼠HUA模型,本研究在此基础上联用次黄嘌呤300mg·kg-1,比较造模效果的差异。侯建平等[9]采用腺嘌呤200mg·kg-1联合乙胺丁醇250mg·kg-1,成功建立小鼠HUA模型,但有一定肾损伤,据此本实验设置低剂量组腺嘌呤100mg·kg-1+乙胺丁醇125mg·kg-1,同时选用与腺嘌呤同为UA前体物质的黄嘌呤、次黄嘌呤与乙胺丁醇联合作用于小鼠,进一步观测造模效果。
目前大多学者在实际应用中为避免单一途径造模的局限性,采用不同造模途径联用的方式提高造模成功率,但在给药方式上存在多样性,且对联合造模的横向比较研究较少。同时结合人类HUA发病率男性高于女性、高龄高于低龄的特点,本实验采用高龄雄性小鼠,以灌胃的方式造模,通过对不同造模因素造模效果的比较,以期得到更符合人类HUA发病现状的造模方案。
1 材料和方法
1.1 材料
1.1.1 实验动物 SPF级KM小鼠80只,雄性,1月龄,体质量27~31g,由上海灵畅生物科技有限公司提供[许可证号:SCXK(沪)2013-0018]。SPF 级 ICR 小鼠30只,雄性,1月龄,体质量16~18g,由浙江省医学科学院实验动物中心提供[许可证号:SCXK(浙)2014-0001]。KM小鼠和ICR小鼠均常规饲喂2个月至3月龄,期间保持通气良好,12h光照/黑暗循环,温度21~26℃,湿度60%~70%。
1.1.2 主要试剂 腺嘌呤购于上海源叶生物科技有限公司(批号:Y19D7C26834);黄嘌呤购于上海源叶生物科技有限公司(批号:AJ0722MA14);次黄嘌呤为美国Sigma化学试剂公司产品(批号:SLBC2747V);氧嗪酸钾为美国Sigma化学试剂公司产品(批号:STBF661);乙胺丁醇购于杭州民生药业有限公司(批号:T16D022);羧甲基纤维素钠购于成都市科龙化工试剂厂(批号:20090222)。UA试剂盒(批号:17011101)、肌酐(creatinine,CR)试剂盒(批号:17010801)、尿素氮(blood urea nitrogen,BUN)试剂盒(批号:1611401)均购于宁波美康生物科技有限公司。
1.1.3 主要仪器 Microcl 17微量离心机为美国Thermo Fisher公司产品;JM-B50002型电子天平购于余姚纪铭称重校验设备有限公司;FA2204B电子天平购于上海精科天美科学仪器有限公司;TBA-40FR全自动生化分析仪为日本东芝三广医疗株式会社产品。
1.2 方法
1.2.1 动物分组与处理
1.2.1.1 实验一 将KM小鼠按血清UA水平和体质量分为8组,每组10只。分别为:正常对照组、氧嗪酸钾 250mg·kg-1组、次黄嘌呤 300mg·kg-1+氧嗪酸钾250mg·kg-1组、腺嘌呤 100mg·kg-1+乙胺丁醇 125mg·kg-1组、腺嘌呤 200mg·kg-1+乙胺丁醇 250mg·kg-1组、黄嘌呤300mg·kg-1+乙胺丁醇125mg·kg-1组、黄嘌呤600mg·kg-1+乙胺丁醇 250mg·kg-1组、次黄嘌呤300mg·kg-1+乙胺丁醇125mg·kg-1组。各组造模药物用3g·L-1的羧甲基纤维素钠溶液配制成对应剂量的混悬液,除正常对照组给予等量蒸馏水灌胃外,其余各组采用对应造模药物灌胃。灌胃体积均为0.1mL·10g-1,灌胃1次/d,共7d。实验期间所有小鼠均正常饮食。
1.2.1.2 实验二 选择实验一中造模效果较好、有代表性的造模因素作用于ICR小鼠进行实验。将ICR小鼠按血清UA水平和体质量分为正常对照组和各模型组,每组10只。造模药物用3g·L-1的羧甲基纤维素钠溶液配制成混悬液,除正常对照组给予等量蒸馏水灌胃外,其余各组采用对应造模药物灌胃。灌胃体积为0.1mL·10g-1,灌胃1次/d,共7d。实验期间所有小鼠均正常饮食。
1.2.2 指标检测 实验期间观察小鼠的一般体征(毛色、精神状态)、动作灵活性、体质量变化等情况。末次灌胃造模2h后,麻醉小鼠后腹主动脉取血(取血前12h禁食不禁水),37℃水浴 30min,3 500r/min离心10min,分离血清,采用全自动生化分析仪测定血清UA、CR、BUN 水平。
1.3 统计学分析 采用SPSS 19.0统计软件进行统计学分析,所有计量资料均以±s表示,组间差异比较采用两样本均数比较的t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同造模因素对KM小鼠体质量的影响 实验开始时,各组小鼠体质量均无统计学差异(P>0.05)。实验结束时,与正常对照组比较,腺嘌呤100mg·kg-1+乙胺丁醇 125mg·kg-1组、腺嘌呤 200mg·kg-1+乙胺丁醇 250mg·kg-1组 KM 小鼠体质量显著降低(P<0.01),降低率达到11.59%、12.26%。其余5组KM小鼠体质量与正常对照组相比差异无统计学意义(P>0.05)。提示灌胃给予腺嘌呤100mg·kg-1+乙胺丁醇125mg·kg-1、腺嘌呤 200mg·kg-1+乙胺丁醇 250mg·kg-1两个造模因素对KM小鼠的体质量有较大影响;其余5个造模因素对KM小鼠体质量无显著影响。见表1。
表1 不同造模因素对KM小鼠体质量的影响(±s)Tab.1 Influence of different mold making factors on the body weight of KM mice(±s)

表1 不同造模因素对KM小鼠体质量的影响(±s)Tab.1 Influence of different mold making factors on the body weight of KM mice(±s)
注:与正常对照组比较,**P<0.01。Note:Compared with control group,**P<0.01.
造模因素组别(mg·kg-1) n 造模0d体质量(g) 造模7d体质量(g) 体质量增长率(%)正常对照组氧嗪酸钾250组次黄嘌呤300+氧嗪酸钾250组腺嘌呤100+乙胺丁醇125组腺嘌呤200+乙胺丁醇250组黄嘌呤300+乙胺丁醇125组黄嘌呤600+乙胺丁醇250组次黄嘌呤300+乙胺丁醇125组10 10 10 10 8 10 10 10 49.21±3.67 49.22±2.25 48.07±3.46 50.12±3.63 49.52±2.95 50.32±2.22 48.46±2.23 48.23±4.48 50.98±3.79 50.04±2.38 48.94±3.18 44.31±3.72**43.45±3.63**50.63±2.80 49.28±2.54 48.25±4.04+3.60+1.67+1.81-11.59-12.26+0.62+1.69+0.04
2.2 不同造模因素对KM小鼠血清UA水平的影响与正常对照组比较,氧嗪酸钾250mg·kg-1、次黄嘌呤300mg·kg-1+氧嗪酸钾 250mg·kg-1灌胃 7d可使 KM小鼠血清UA水平显著升高(P<0.01),且后者UA增长率(71.93%)远高于前者(28.71%),造模成功率为100%,实验过程中无动物死亡。与正常对照组比较,腺嘌呤 100mg·kg-1+乙胺丁醇 125mg·kg-1、腺嘌呤200mg·kg-1+乙胺丁醇 250mg·kg-1、黄嘌呤 300mg·kg-1+乙胺丁醇125mg·kg-1组KM小鼠血清UA水平不升反降(P<0.01,P<0.05),且腺嘌呤 200mg·kg-1+乙胺丁醇250mg·kg-1组KM小鼠死亡2只,死亡率为20%,经解剖发现死亡小鼠肾脏表面出现白色颗粒状病变,提示死亡原因可能是造模剂所致的肾损伤。与正常对照组比较,黄嘌呤600mg·kg-1+乙胺丁醇250mg·kg-1、次黄嘌呤 300mg·kg-1+乙胺丁醇 125mg·kg-1两组KM小鼠血清UA水平无统计学差异(P>0.05)。提示在灌胃给药的条件下,氧嗪酸钾250mg·kg-1、次黄嘌呤300mg·kg-1+氧嗪酸钾250mg·kg-1可成功诱导KM小鼠HUA模型,后者造模效果更佳且安全性高。见表 2、3。
2.3 不同造模因素对KM小鼠肾功能的影响 与正常对照组比较,腺嘌呤100mg·kg-1+乙胺丁醇125mg·kg-1、腺嘌呤 200mg·kg-1+乙胺丁醇 250mg·kg-1、黄嘌呤300mg·kg-1+乙胺丁醇125 mg·kg-13个造模因素使KM小鼠CR、BUN水平同时升高,差异有统计学意义(P<0.01,P<0.05),CR增长率分别为205.54%、310.12%、16.62%,BUN增长率分别为 314.79%、280.20%、28.20%,3组小鼠均发生严重肾损伤。与正常对照组比较,次黄嘌呤 300mg·kg-1+氧嗪酸钾 250mg·kg-1、次黄嘌呤 300mg·kg-1+乙胺丁醇 125mg·kg-1两个造模因素导致KM小鼠CR水平显著升高(P<0.05),增长率分别为19.69%、14.15%,该两组小鼠发生轻微肾损伤;氧嗪酸钾 250mg·kg-1、黄嘌呤 600mg·kg-1+乙胺丁醇 250mg·kg-1两组小鼠的CR、BUN水平均无统计学差异(P>0.05),无明显肾损伤。见表4。实验一结果表明,腺嘌呤 100mg·kg-1+乙胺丁醇 125mg·kg-1、腺嘌呤200mg·kg-1+乙胺丁醇 250mg·kg-1、黄嘌呤 300mg·kg-1+乙胺丁醇125mg·kg-13个造模因素可致KM小鼠严重肾损伤,且小鼠血清UA水平不升反降,说明以上3个因素不适合用于HUA造模。

表2 不同造模因素造模致KM小鼠死亡情况Tab.2 Mortality of KM mice induced by different mold making factors
表3 不同造模因素对KM小鼠血清UA水平的影响(±s)Tab.3 The effects of different mold making factors on the level of serum UA in KM mice(±s)

表3 不同造模因素对KM小鼠血清UA水平的影响(±s)Tab.3 The effects of different mold making factors on the level of serum UA in KM mice(±s)
注:与正常对照组同一时点比较,*P<0.05,**P<0.01。Note:Compared with control group at the same time,*P<0.05,**P<0.01.
造模因素组别(mg·kg-1) n 造模0d UA(μmol·L-1)造模7d UA(μmol·L-1)造模7d时UA增长率(%)正常对照组氧嗪酸钾250组次黄嘌呤300+氧嗪酸钾250组腺嘌呤100+乙胺丁醇125组腺嘌呤200+乙胺丁醇250组黄嘌呤300+乙胺丁醇125组黄嘌呤600+乙胺丁醇250组次黄嘌呤300+乙胺丁醇125组10 10 10 10 8 10 10 10 228.30±66.99 223.50±82.03 227.60±71.75 229.80±71.73 220.10±72.59 218.30±64.81 226.80±71.92 224.10±69.01 179.78±36.42 231.40±45.76**309.10±85.03**75.80±29.16**64.43±16.69**142.80±37.10*201.90±51.62 167.50±39.64--+28.71+71.93-57.84-64.16-20.57+12.30-6.83
2.4 不同造模因素对ICR小鼠存活情况及体质量的影响 依据实验一的结果,选择了氧嗪酸钾250mg·kg-1、次黄嘌呤 300mg·kg-1+氧嗪酸钾 250mg·kg-1两种造模因素对ICR小鼠造模。结果显示氧嗪酸钾250mg·kg-1、次黄嘌呤 300mg·kg-1+氧嗪酸钾 250mg·kg-1两组ICR小鼠造模前后体质量均无统计学差异(P>0.05),说明灌胃给予氧嗪酸钾 250mg·kg-1、次黄嘌呤300mg·kg-1+氧嗪酸钾250mg·kg-1两个造模因素对ICR小鼠的体质量无显著影响,且造模过程中ICR小鼠无死亡现象。见表5、6。
表4 不同造模因素对KM小鼠肾功能的影响(±s)Tab.4 The effects of different modeling factors on renal function in KM mice(±s)

表4 不同造模因素对KM小鼠肾功能的影响(±s)Tab.4 The effects of different modeling factors on renal function in KM mice(±s)
注:与正常对照组比较,*P<0.05,**P<0.01。Note:Compared with control group,*P<0.05,**P<0.01.
造模因素组别(mg·kg-1) n CR(μmol·L-1) CR 增长率(%) BUN(mmol·L-1) BUN 增长率(%)正常对照组氧嗪酸钾250组次黄嘌呤300+氧嗪酸钾250组腺嘌呤100+乙胺丁醇125组腺嘌呤200+乙胺丁醇250组黄嘌呤300+乙胺丁醇125组黄嘌呤600+乙胺丁醇250组次黄嘌呤300+乙胺丁醇125组10 10 10 10 8 10 10 10 32.50±2.51 32.70±2.36 38.90±1.87**99.30±33.21**133.29±56.76**37.90±3.35**33.80±1.87 37.10±4.48**--+0.62+19.69+205.54+310.12+16.62+4.00+14.15 7.98±1.43 7.96±1.56 8.70±1.95 33.10±5.97**30.34±9.18**10.23±3.07*8.94±1.57 9.14±4.32---0.25+9.02+314.79+280.20+28.20+12.03+14.54

表5 不同造模因素致ICR小鼠死亡情况Tab.5 Mortality of ICR mice caused by different modeling factors
表6 不同造模因素对ICR小鼠体质量的影响(±s)Tab.6 The influence of different mold making factors on the weight of ICR mice(±s)
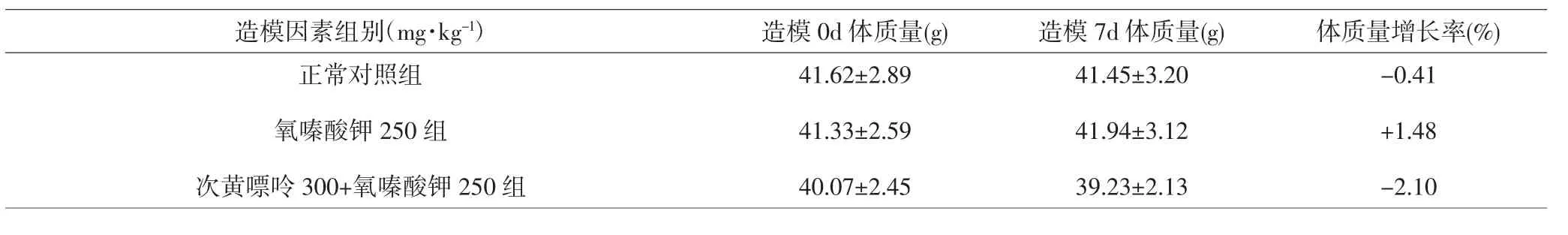
表6 不同造模因素对ICR小鼠体质量的影响(±s)Tab.6 The influence of different mold making factors on the weight of ICR mice(±s)
造模因素组别(mg·kg-1) 造模0d体质量(g) 造模7d体质量(g) 体质量增长率(%)正常对照组41.62±2.8941.45±3.20-0.41氧嗪酸钾250组41.33±2.5941.94±3.12+1.48次黄嘌呤300+氧嗪酸钾250组40.07±2.4539.23±2.13-2.10
2.5 不同造模因素对ICR小鼠的血清UA水平和肾功能的影响 与正常对照组比较,氧嗪酸钾250mg·kg-1、次黄嘌呤 300mg·kg-1+氧嗪酸钾 250mg·kg-1两组ICR小鼠,血清UA水平无统计学差异(P>0.05),造模失败;而相同的造模因素作用于KM小鼠,其血清UA水平显著升高(P<0.01),提示KM小鼠对造模药物的敏感度显著高于ICR小鼠,选用KM小鼠建立HUA模型效果更佳。与正常对照组比较,氧嗪酸钾250mg·kg-1组ICR小鼠的血清CR、BUN水平均无统计学差异(P>0.05),说明无肾损伤。与正常对照组比较,次黄嘌呤300mg·kg-1+氧嗪酸钾250mg·kg-1组ICR小鼠血清CR水平无统计学差异(P>0.05),而血清BUN水平显著升高(P<0.05),说明有轻微肾损伤。见表 3、7。
表7 不同造模因素对ICR小鼠血清UA和肾功能的影响(±s)Tab.7 The effects of different mold making factors on blood UA and renal function in ICR mice(±s)

表7 不同造模因素对ICR小鼠血清UA和肾功能的影响(±s)Tab.7 The effects of different mold making factors on blood UA and renal function in ICR mice(±s)
注:与正常对照组比较,*P<0.05。Note:Compared with control group,*P<0.05.
造模因素组别(mg·kg-1) UA造(μ模mo 0 l·d L-1)UA造(μ模mo 7 l·d L-1)CR造(μ模mo 7 l·d L-1)BUN造(m模mo 7 l·d L-1)正常对照组159.11±18.86142.56±25.1239.00±3.129.50±0.81氧嗪酸钾250组163.10±36.97140.90±25.2638.00±0.829.65±1.17次黄嘌呤300+氧嗪酸钾250组161.90±31.30123.50±29.0642.40±7.2611.24±2.72*
3 讨论
HUA与代谢综合症等多种疾病相关,严重危害人们的健康,且临床常用的治疗药物,如别嘌醇、苯溴马隆等,长期服用可产生胃肠道反应、超敏反应综合征、线粒体功能障碍、肝肾功能损害等不良反应[10],影响患者服药的依从性。因此研发新的降UA药物迫在眉睫。寻找接近人类UA代谢途径的、稳定有效的HUA动物模型造模方法,是研究和筛选降UA药物的重要参考依据。
现有的动物模型造模方式主要有饲喂、腹腔注射、皮下注射、灌胃等。饲喂造模存在动物进食量不同导致摄药量不均的问题,动物血清UA水平不稳定;注射造模可能因首过效应影响药效,且血清UA水平升高持久性较差[11-12];灌胃则可以避免这些方式的弊端。因此本研究选用灌胃的造模方式进行实验。本实验在灌胃给药的前提下,依据增加UA前体物质、减少UA的排泄、抑制尿酸酶活性的造模原理,采用UA前体物质(次黄嘌呤、黄嘌呤、腺嘌呤)联合尿酸酶抑制剂(氧嗪酸钾)或UA排泄抑制剂(乙胺丁醇)进行造模,通过观察KM小鼠体质量、存活情况、UA水平及肾功能指标的变化,对不同造模因素联合造模的效果进行横向比较,筛选理想的HUA模型造模方法。
实验结果显示7种造模因素中仅氧嗪酸钾250mg·kg-1、次黄嘌呤 300mg·kg-1+氧嗪酸钾 250mg·kg-1能成功诱导KM小鼠HUA模型,且对小鼠体质量和存活情况的影响较小。同时通过比较两组KM小鼠UA水平升高率,发现后者造模效果更佳。提示在灌胃造模的条件下,次黄嘌呤和氧嗪酸钾联用造模效果最好,证明联合造模更有优势。既往研究也证实单独给予氧嗪酸钾或次黄嘌呤造模结果不理想[13-14]。因此本研究推荐选用次黄嘌呤300mg·kg-1+氧嗪酸钾250mg·kg-1联合诱导HUA模型。
刘晓燕等[15]采用腹腔注射次黄嘌呤联合皮下注射氧嗪酸钾的方式建立HUA模型,结果表明KM小鼠造模灵敏度高于ICR和C57BL/6J小鼠。据此本研究采用灌胃给药的造模方式,以KM、ICR两个品系的高龄小鼠作为造模对象,进一步对适合建立HUA动物模型的小鼠品系进行筛选。结果显示,在灌胃给予相同造模药物的条件下,与正常对照组比较,KM小鼠的血清UA水平显著升高,而ICR小鼠无统计学差异。提示在灌胃给药条件下,KM小鼠造模灵敏度高于ICR小鼠,笔者推测不同品系小鼠对造模药物敏感度的不同可能与小鼠体内尿酸酶活性的差异有关[15]。
本研究还发现,腺嘌呤100mg·kg-1+乙胺丁醇125mg·kg-1、腺嘌呤 200mg·kg-1+乙胺丁醇 250mg·kg-1两组KM小鼠血清UA水平不升反降,同时CR、BUN水平均显著升高,提示以上两种造模因素导致小鼠肾损伤。熊湘明等[16]研究发现腺嘌呤会导致肾损伤。临床报道也提示肾损伤与低尿酸血症有关[17],由此笔者推测小鼠血清UA水平的降低与其肾损伤有关。还有研究证实,低尿酸血症与恶性肿瘤、肝肾疾病、颅脑疾病等具有相关性[18],应引起高度重视。本研究结果则提示可通过腺嘌呤+乙胺丁醇组合诱导小鼠低尿酸血症模型,为低尿酸血症的深入研究提供参考。
在HUA动物模型建立方面,目前国内外对实验动物的性别和年龄的关注均较少。有研究报道,除了不良饮食习惯和生活方式,HUA患病率与人的性别和年龄也具有密切的关系,男性高于女性、高龄组高于低龄组[19]。据此本研究选用雄性高龄小鼠进行造模研究,更符合人类HUA的发病现状,可为高龄人群HUA的研究奠定基础,同时也为全面深入地研究HUA提供新的思路。
综上所述,本实验采用灌胃给药的方式作用于高龄小鼠,进一步验证了联合造模效果优于单一途径;在不同品系的小鼠间比较,KM小鼠造模灵敏度高,而且具有一定稳定性,适合用于HUA研究。本研究的结论可为HUA的动物模型研究提供一定的参考依据,但仍然还存在很多问题,如动物与人类发病机制存在差距,造模所致的肾损伤尚无定论等,对此仍需进一步深入研究,探寻与人类UA代谢更相似、发病机制更接近的动物模型。
[1]杜霄壤,高建东.高尿酸血症肾病的中医药研究[J].长春中医药大学学报,2012,28(2):264-266.DU Xiaorang,GAO Jiandong.Study of Chinese medicine in hyperuricemia nephropathy[J].Journal of Changchun U-niversity of Traditional Chinese Medicine,2012,28(2):264-266.
[2]陈涛,李卫,王杨,等.高尿酸血症的患病情况及相关因素分析[J].中华临床医师杂志(电子版),2012,6(13):49-52.CHEN Tao,LI Wei,WANG Yang,et al.Prevalence of hyperuricemia and relation of serum uric acid with cardiovascular risk factors[J].Chinese Journal of Clinicians(Electronic Edition),2012,6(13):49-52.
[3]庞敏霞,方颖莹,陈素红,等.高尿酸血症的危害及中药防治特点的研究进展[J].中华中医药学刊,2017,35(2):340-344.PANG Minxia,FANG Yingying,CHEN Suhong,et al.Research progress of harms and characteristics of TCM preventing and treating hyperuricemia[J].Chinese Archives of Traditional Chinese Medicine,2017,35(2):340-344.
[4]尹非,李雪晨,叶菲.高尿酸血症与代谢综合征研究进展[J].国际药学研究杂志,2017,44(6):487-490.YIN Fei, LIXuechen, YE Fei.Hyperuricemiaand metabolic syndrome:research advances[J].International Journal of Pharmaceutical Research,2017,44(6):487-490.
[5]何宏明,冯育林,张武岗,等.不同方法建立高尿酸血症动物模型研究进展[J].江西中医药,2015,46(12):72-75.HE Hongming,FENG Yulin,ZHANG Wugang,et al.Research progress on the establishment of hyperuricemia animal models by different methods[J].Jiangxi Journal of Traditional Chinese Medicine,2015,46(12):72-75.
[6]王晗,张敏,路腾飞,等.高尿酸血症动物模型研究进展[J].天津中医药大学学报,2014,33(4):253-256.WANG Han,ZHANG Min,LU Tengfei,et al.Progress in the study of hyperuricemia animal model[J].Journal of Tianjin University of Traditional Chinese Medicine,2014,33(4):253-256.
[7]马莹莹,吴玉兰,朱恩伟,等.脂肪乳剂模拟“饮食不节”致大鼠高尿酸血症模型[J].中国中药杂志,2015,40(10):2009-2013.MA Yingying,WU Yulan,ZHU Enwei,et al.Rats hyperuricemia model established by lipid emulsion simulating irregular of diet[J].China Journal of Chinese Materia Medica,2015,40(10):2009-2013.
[8]胡庆华,朱继孝,李宁,等.栀子苷对氧嗪酸钾盐致小鼠高尿酸血症的作用及其机制研究[J].中南药学,2013,11(10):721-725.HU Qinghua,ZHU Jixiao,LI Ning,et al.Effect of jasminoidin on potassium oxonate-induced hyperuricemia in mice and its mechanism[J].Central South Pharmacy,2013,11(10):721-725.
[9]侯建平,王艳,孟建国,等.虎杖对实验性高尿酸血症小鼠降尿酸有效部位的研究[J].现代中医药,2011,31(3):49-51.HOU Jianping,WANG Yan,MENG Jianguo,et al.Study on the effective parts of Polygonum Cuspidatum for lowering uric acid level of mice with experimental hyperuricemia[J].Modern Traditional Chinese Medicine,2011,31(3):49-51.
[10]刘金畅,王涛.治疗高尿酸血症药物研发现状与思考[J].天津中医药,2017,34(5):291-294.LIU Jinchang,WANG Tao.Present research situation and thinking of drug in treating hyperuricemia[J].Tianjin Journal of Traditional Chinese Medicine,2017,34(5):291-294.
[11]杨会军,李兆福,彭江云.高尿酸血症动物模型研究概况[J].中医学报,2013,28(1):60-62.YANG Huijun,LI Zhaofu,PENG Jiangyun.Overview research of hyperuricemia animal model[J].Journal of Chinese Medicine,2013,28(1):60-62.
[12]高小涛,高俊玲,佟晓波.大鼠高尿酸血症模型构造概况[J].临床医药文献杂志,2017,11(4):1996.GAO Xiaotao,GAO Junling,TONG Xiaobo.The construction of the model of hyperuricemia in rats[J].Journal of Clinical Medical Literature,2017,11(4):1996.
[13]孟笑玮,樊克涛,代向东,等.高尿酸血症动物模型的实验研究[J].天津中医药,2015,32(10):614-617.MENG Xiaowei,FAN Ketao,DAI Xiangdong,et al.Experimental research of hyperuricemia animal models[J].Tianjin Journal of Traditional Chinese Medicine,2015,32(10):614-617.
[14]金沈锐,郑军.小鼠高尿酸血症模型初探[J].成都中医药大学学报,1999,22(1):49-50.JIN Shenrui,ZHENG Jun.A preliminary study on the model of hyperuricemia in mice[J].Journal of Chengdu University of Traditional Chinese Medicine,1999,22(1):49-50.
[15]刘晓燕,朱学江,郭军,等.不同品系小鼠对代谢性高尿酸血症造模的影响[J].现代生物医学进展,2011,11(24):4824-4827.LIU Xiaoyan,ZHU Xuejiang,GUO Jun,et al.The effect of different strains on mouse hyperucicemia model[J].Progress in Modern Biomedicine,2011,11(24):4824-4827.
[16]熊湘明,曲竹秋.大鼠高尿酸血症模型建立[J].天津中医学院学报,2001,20(4):28-31.XIONG Xiangming,QU Zhuqiu.Establishment of hyperuricemia model in rats[J].Journal of Tianjin College of Traditional Chinese Medicine,2001,20(4):28-31.
[17]李红丽.肾功能损害与低尿酸血症的关系研究[J].临床合理用药杂志,2013,6(15):27.LI Hongli.Study on the relationship between renal dysfunction and hypouricemia[J].Journal of Clinical Rational Drug Use,2013,6(15):27.
[18]刘德平.低尿酸血症[J].中国心血管杂志,2016,21(2):104-107.LIU Deping.Hypouricemia[J].Chinese Journal of Cardiovascular Medicine,2016,21(2):104-107.
[19]李瑜鹏,康乐,石翯.健康体检人群高尿酸血症患病情况及其相关因素分析[J].齐齐哈尔医学院学报,2017,38(16):1928-1930.LI Yupeng,KANG Le,SHI He.Analysis of the prevalence and related factors of hyperuricemia in physical examination people[J].Journal of Qiqihar Medical College,2017,38(16):1928-1930.
