MRI灰度直方图分析在儿童后颅窝常见肿瘤中的鉴别诊断价值
2018-03-27朱晨迪张勇程敬亮董安珂汪卫建郑瑞平
朱晨迪, 张勇, 程敬亮, 董安珂, 汪卫建, 郑瑞平
儿童神经系统肿瘤仅次于淋巴造血系统肿瘤,为儿童第二好发肿瘤,居于儿童实体肿瘤首位[1],多位于后颅窝,其中毛细胞型星形细胞瘤、髓母细胞瘤、室管膜瘤发生率较高,其恶性程度不同,治疗方式及预后亦有明显差异,故术前正确诊断具有重要的临床意义。常规MRI能较好的显示肿瘤的部位、范围及与周围组织的关系,但对肿瘤的组织类型及分级的作用较小。近年来,灰度直方图分析作为新兴技术在疾病诊断中的应用越来越多[2],可为疾病诊断提供更多定量信息,且经济、简便、易行,国外曾有文献报道将灰度直方图分析用于此三种肿瘤的鉴别[3]。本研究通过对83例经手术病理证实的三种儿童常见后颅窝肿瘤的MRI图像进行分析,研究此三种肿瘤的MRI灰度直方图的参数差异,旨在探讨灰度直方图分析对此三种儿童后颅窝肿瘤的鉴别诊断价值。

表1 三组儿童后颅窝肿瘤灰度直方图参数比较
注:a与室管膜瘤比较P<0.05,b与星形细胞瘤比较P<0.05。

表2 三组儿童后颅窝肿瘤灰度直方图参数比较
注:a与室管膜瘤比较P<0.05,b与星形细胞瘤比较P<0.05。
材料与方法
1.一般资料
回顾性分析本院2009年6月-2016年5月经手术病理证实的83例儿童后肿瘤患者的病例资料,其中毛细胞型星形细胞瘤27例(男14例,女13例),髓母细胞瘤25例(男14例,女11例),室管膜细胞瘤31例(男10例,女21例;WHO Ⅱ级20例,WHO Ⅲ级11例),年龄1~15岁。临床表现主要为头痛、头晕、呕吐、站立不稳等。纳入标准如下:①通过手术病理证实为星形细胞瘤、髓母细胞瘤、室管膜瘤中的一种;②术前在本院行MR平扫及增强检查,具有完善的影像资料,包括横轴面T1WI、T2WI、FLAIR、DWI和增强T1WI;③MRI图像质量良好。
2.检查方法
采用Siemens Skyra 3.0T MR仪,标准头颅线圈。平扫行矢状面及横轴面T1WI、T2WI、液体衰减反转恢复(FLAIR)序列及DWI。扫描参数:T1WI(TR 260.0 ms,TE 2.46 ms);T2WI(TR 3800 ms,TE 93.0 ms);FLAIR(TR 4500 ms,TE 93.0 ms);DWI扫描采用SE-EPI序列, b值为0及1000 s/mm2,TR 3500 ms,TE 119 ms;视野23 cm×23 cm,层厚5 mm,层间距0.3 mm,层数20。增强扫描行矢状面、横轴面及冠状面T1WI,增强扫描对比剂采用钆喷替酸葡胺(Gd-DTPA),剂量0.2 mmol/kg,扫描参数同平扫T1WI。
3.兴趣区的选取
图像选择:将所有患者的MR图像从PACS工作站以.BMP格式导出,导出时调整窗宽、窗位,使所有图像窗宽、窗位均保持一致,由于增强T1WI显示病变范围较清晰,因此,首先选择矢状面增强T1WI图像,用于直方图分析。
兴趣区选择及直方图分析:采用MaZda软件沿病变矢状位增强T1WI图像最大层面的肿瘤边缘手动勾画兴趣区(regions of interest,ROI),软件可自动生成ROI的灰度直方图,由灰度直方图可计算得到以下参数:肿瘤变异度(Variance)、偏度(Skewness)、均值(Mean)、峰度(Kurtosis)、第1百分位数(Perc.01%)、第10百分位数(Perc.10%)、第50百分位数(Perc.50%)、第90百分位数(Perc.90%)、第99百分位数(Perc.99%)等。本研究中所有样本的ROI均是在两位影像学专家的指导下勾画完成。分别从3种肿瘤中选取一个样本圈出肿瘤区域,并用红色填充肿瘤区域,将与其对应的标记前后的图像及运行出的直方图显示如下(图1~3)。
4.统计学分析
结 果
三组肿瘤灰度直方图各参数值统计结果见表1、2。由灰度直方图分析得到的9个参数中,Mean、Variance、Skewness、Perc.10%及Perc.50%等5个参数差异有统计学意义(P均<0.05),其中Perc.10%及Perc.50%在室管膜瘤与毛细胞型星形细胞瘤两组之间差异有统计学意义,Perc.10%在室管膜瘤与髓母细胞瘤间有统计学差异,Mean、Variance、Skewness、Perc.10%及Perc.50%在毛细胞型星形细胞瘤与髓母细胞瘤间差异有统计学意义。Kurtosis、Perc.01%、Perc.90%及Perc.99%在三组间差异无统计学意义(P均>0.05)。建立受试者工作特征(receiver operating characterist,ROC)曲线并计算曲线下面积(area under curve,AUC),通过ROC曲线分析Mean、Variance、Skewness、Perc.10%及Perc.50%等5个参数在三组肿瘤两两之间的诊断效能,有统计学意义的参数在相应两组肿瘤之间的AUC(图4、5)及为兼顾敏感度和特异度选取的最佳临界值见表3。
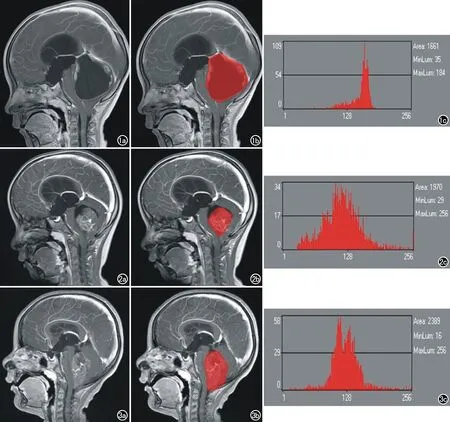
图1 男,2岁,毛细胞型星形细胞瘤。a) MR增强矢状面示四脑室内一巨大囊性肿块,囊壁轻度强化,壁内可见小结节状强化; b) 勾画兴趣区; c) 灰度直方图分布较陡直,分布不对称尾部趋向于更多较大值。图2 女,4岁,髓母细胞瘤。a) MR增强矢状面图像可见四脑室内圆形中等强化肿块; b) 勾画兴趣区; c) 灰度直方图分布相对平缓,接近于正态分布。 图3 男,5岁,室管膜细胞瘤(WHO Ⅲ级)。a) MR增强矢状面图像可见四脑室内中等强化肿块,内可见轻度囊变,肿块超出枕骨大孔呈“融蜡征”; b) 勾画兴趣区; c) 灰度直方图分布相对平缓,接近于正态分布。

表3 灰度直方图参数对毛细胞型星形细胞瘤与髓母细胞瘤的鉴别效能

图4 Variance、Skewness鉴别诊断毛细胞型星形细胞瘤与髓母细胞瘤的ROC曲线。 图5 Mean、Perc.10%及Perc.50%鉴别诊断毛细胞型星形细胞瘤与髓母细胞瘤的ROC曲线。
讨 论
毛细胞型星形细胞瘤、髓母细胞瘤及室管膜瘤是三种常见的儿童后颅窝肿瘤,常规MRI可用于三者的鉴别诊断,但由于肿瘤影像表现之间多有重叠,诊断价值有限;就髓母细胞瘤与毛细胞型星形细胞瘤而言,T2WI上典型的髓母细胞瘤表现为稍高信号,后颅窝内毛细胞型星形细胞瘤囊变多见,囊壁可伴或不伴壁结节,在T2WI上表现为明显高信号,但有文献报道50% 的毛细胞型星形细胞瘤在T2WI相对于脑实质呈等或稍高信号,与髓母细胞瘤在T2WI的信号强度有重叠现象[4]。而与常规MRI影像表现相比,肿瘤的定量分析对肿瘤鉴别诊断具有更高的准确性,可在术前作为一种非侵入手段为肿瘤分类及分型提供更多有价值的信息,指导术中肿瘤切除范围及治疗方案的制定,改善预后[3]。
ADC值测量及MRS为肿瘤鉴别诊断中运用较多的定量分析方法。大量研究表明毛细胞型星形细胞瘤平均ADC值明显高于室管膜瘤与髓母细胞瘤,但后两者之间的平均ADC值无明显差异[5-8];MRS可通过定量比较物质代谢提供鉴别诊断信息,但使检查费用增加及检查时间延长,且其准确性易受肿瘤部位、大小及成分的影响[9]。
医学图像中包含大量肉眼无法观测到的与临床实践相关的纹理信息,纹理分析是近年来新出现的一种图像后处理技术,可对医学图像中像素的分布情况进行数学分析,获取一系列量化肿瘤的相关参数。常用的纹理分析获取量化参数的方法有:统计法、基于模型法、结构法和频率法,其中统计法中的灰度直方图分析法为医学图像纹理分析较常使用的分析方法,可提供图像兴趣区的像素值的灰度分布情况,在常规MRI检查的基础上进行分析,且操作简便,可重复性强,可提供大量参数用于疾病诊断。灰度直方图分析在病变鉴别诊断、肿瘤分类、分级、生存期预测等方面的应用已得到认可[10-11]。
本研究发现基于增强MRI灰度直方图的均值、变异度、偏度及第50百分位数在后颅窝髓母细胞瘤与毛细胞型星形细胞瘤之间差异有统计学意义。均值、变异度可反映肿瘤区像素点灰度值的平均水平及灰度值的离散程度;偏度值为描述病变特征值分布对称性的统计量,表明分布相对平均值的不对称程度,正值表明分布不对称趋向于较大值,分布集中于右侧;负值代表分布不对称偏向于较小值,分布集中于左侧,偏度绝对值越大,分布形态越偏离正态分布。髓母细胞瘤(WHO Ⅳ级)虽恶性程度较高,但较少发生大片坏死、囊变少见,肿瘤细胞密集,灰度值分布相对均匀集中,灰度值均值较大、变异度较小,偏度较小,接近于正态分布;毛细胞型星形细胞瘤(WHOⅠ级)恶性程度虽低,但囊变明显,肿瘤细胞密度低,灰度值分布不均,灰度值均值较小,变异度较大,曲线分布向右偏移,偏度较大;而室管膜瘤(WHOⅠ~Ⅲ级),肿瘤细胞排列较髓母细胞瘤疏松,恶性程度及细胞密度居于髓母细胞瘤和毛细胞型星形细胞瘤之间,与两者在此四个参数中差异不明显。
灰度直方图百分位数表示低于该百分位数的观测对象的百分比,第10百分位数及第50百分位数差异有统计学意义,表明三种肿瘤及毛细胞型星形细胞瘤与室管膜瘤、毛细胞型星形细胞瘤与髓母细胞瘤之间直方图的曲线分布仅在较低灰度值范围内差异明显,一定程度上反映肿瘤细胞灰度值的分布。由于本研究样本量有限,未对髓母细胞瘤及室管膜瘤进行不同亚型的分层研究,直方图参数是否与病理及分子亚型之间存在关联有待进一步研究。
总之,MRI灰度直方图作为一种辅助诊断的新方法,结合常规MRI上肿瘤的鉴别要点,有助于提高对儿童后颅窝肿瘤分类的诊断价值。
[1] Kaatsch P,Rickert CH,Kühl J,et al.Population-based epidemiologic data on brain tumors in German children[J].Cancer,200l,92(12):3155-3164.
[2] 迟淑萍.CT灰度直方图对实性肺结节的鉴别诊断价值[J].放射学实践,2016,31(9):866-869.
[3] Rodriguez Gutierrez D,Awwad A,Meijer L,et al.Metrics and textural features of MRI diffusion to improve classification of pediatric posterior fossa tumors[J].AJNR,2014,35(5):1009-1015.
[4] Arai K,Sato N,Aoki J,et al.MR signal of the solid portion of pilocytic astrocytoma on T2-weighted images:is it useful for differentiation from medulloblastoma[J].Neuroradiology,2006,48(4):233-237.
[5] Yamasaki F,Kurisu K,Satoh K,et al.Apparent diffusion coefficient of human brain tumors at MR imaging[J].Radiology,2005,235(3):985-991.
[6] Schneider JF,Confort-Gouny S,Viola A,et al.Multi parametric differentiation of posterior fossa tumors in children using diffusion-weighted imaging and short echo-time1H-MRspectroscopy[J].J Magn Reaon Imaging,2007,26(6):1390-1398.
[7] Rumboldt Z,Camacho DL,Lake D,et al.Apparent diffusion coefficients for differentiation of cerebellar tumors in children[J].AJNR,2006,27(6):1362-1369.
[8] Bull JG,Saunders DE,Clark CA.Discrimination of pediatric brain tumours using apparent diffusion coefficient histograms[J].Eur Radiol,2012,22(2):447-457.
[9] Davies NP,Wilson M,Harris LM,et al.Identification and characterization of childhood cerebellar tumours by in vivo proton MRS[J].NMR Biomed,2008,21(8):908-918.
[10] Kim JH,Ko ES,Lee KS,et al.Breast cancer heterogeneity:MR imaging texture analysis and survival outcomes[J].Radiology,2016,282(3):665-675.
[11] Chen X,Wei X,Zhang Z,et al.Differentiation of true-progression from pseudoprogression in glioblastoma treated with radiation therapy and concomitant temozolomide by GLCM texture analysis of conventional MRI[J].Clin Imaging,2015,39(5):775-780.