降黄酒高级醇无机氮源的筛选
2018-03-27黄桂东徐珊珊傅祖康孙国昌周志磊
黄桂东, 徐珊珊, 刘 惠, 毛 健*, 傅祖康, 孙国昌, 周志磊
(1.江南大学 食品学院,江苏 无锡 214122;2.会稽山绍兴酒股份有限公司,浙江 绍兴 312030)
黄酒是我国特有的酿造酒,但黄酒饮用者普遍认为,黄酒易导致“深醉”、“上头”、醒酒慢[1-2]。 研究表明,高级醇是导致“宿醉”的关键因素[3]。高级醇是酒类主要风味物质之一[4]。以单次饮用相同乙醇量的白酒与黄酒计,从黄酒中摄入的高级醇更多[5]。因此,在酿酒行业中,控制黄酒中高级醇含量更为迫切。
高级醇合成有两条途径:与氨基酸分解代谢相关的Ehrilich途径和与糖代谢相关的生物合成途径(Harris途径)[6-7]。在酿酒酵母细胞中,高级醇合成受发酵体系中氮素营养状况调控[8]。氮素营养充足时,高级醇通过Ehrilich途径合成,生成的高级醇量约占总高级醇体积分数的25%;氮素营养缺乏时,高级醇生成通过Harris途径合成,生成的高级醇量约占总高级醇体积分数的75%[9]。所以,通过氮素补偿,控制Harris途径,成为降低高级醇体积分数的主要方向[9]。复杂的黄酒发酵过程是一个碳源相对充足,氮源相对缺乏的体系。因此氮素补偿可成为降低黄酒高级醇体积分数的可行措施。
并非所有的含氮物质都能被酵母用于细胞代谢途径。能被酵母利用的含氮物质称为酵母菌可同化氮(Yeast Assimilable Nitrogen,YAN),主要包括:α-氨基酸(脯氨酸除外)、小分子的多肽和铵态氮[10]。其中无机氮源来源易得、价格低廉,且可被酵母高效转运及快速同化,成为工业化酿酒体系中潜在的氮源补偿剂。目前,葡萄酒发酵过程中,通过补充适量的含氮物质来解决一系列与氮源有关的发酵难题,其方法甚至在法国酿酒法典和德国葡萄酒法规中已被记载[11]。但无机氮源种类众多,何种无机氮源能够降低黄酒高级醇含量,仍未见报道。因此筛选合适的无机氮源成为降低黄酒高级醇含量的关键。作者以黄酒酿酒酵母为研究对象,探讨了无机氮源种类对高级醇生成的影响,以期为高品质黄酒的生产提供可靠数据。
1 材料与方法
1.1 实验材料与设备
1.1.1 材料与试剂 黄酒酿酒酵母(绍兴81号)为实验室保藏菌种;生麦曲:会稽山绍兴酒股份有限公司提供;特纯糯米:购自无为县永盛米业有限公司。 异戊醇、β-苯乙醇、异丁醇、2-辛醇(内标)等,色谱纯:购于Sigma公司;其它试剂如磷酸氢二铵、磷酸二氢铵、碳酸铵、氯化铵、硫酸铵、尿素、甲酸铵、乙酸铵、硫酸锌等:分析纯,购于国药集团化学试剂有限公司。
1.1.2 仪器设备 RJ-LDL-50G低速大容量多管离心机:无锡瑞江分析仪器有限公司产品;Thermo Fisher Trace气相色谱质谱联用仪:美国Thermo公司产品;50/30 μm DVB/CAR/PDMS萃取头:美国Supelco公司产品;HH-S2系列恒温水浴锅:江苏金坛市环宇科学仪器厂产品;FE20k pH计:梅特勒-托利多仪器有限公司产品;EL3002电子天平:梅特勒-托利多仪器 (上海)有限公司产品;YXQ-LS—50SII立式压力蒸汽灭菌锅:上海博迅实业有限公司产品;GRP-9080型隔水式恒温培养箱:上海森信实验仪器有限公司产品;SHP-250型生化培养箱:上海森信实验仪器有限公司产品。
1.2 实验方法
1.2.1 培养基及菌种活化 麦芽汁培养基:配制14 g/dL的麦芽汁培养基,分装在500 mL锥形瓶中,每个锥形瓶添加培养基300 mL。一级培养:取菌种,接种于盛有5 mL麦芽汁培养基的试管内,28℃静置培养1 d;二级培养:将试管中的酵母液转接入盛有300 mL麦芽汁培养基的500 mL三角瓶内,28℃静置培养12 h。活化后的酵母菌用于后续培养,后续培养中酵母菌种添加量为培养基总体积的5%。
1.2.2 模拟双边发酵工艺酿造黄酒试验方案 模拟黄酒双边发酵工艺,酿造黄酒。其试验过程如下:称取一定量的市售糯米于烧杯中,用水清洗干净后
浸泡22 h;将浸泡的糯米于电磁炉上进行蒸饭,至糯米熟而不烂;将蒸饭后的糯米转移至500 mL锥形瓶中,按米水比1 g∶3 mL加入去离子水;按照原料质量的10%、5%和100 mg/L分别添加麦曲粉、活化后黄酒酵母和可同化氮源((NH4)2HPO4);用 8 层灭菌纱布将其封口,置于28℃培养箱中静置发酵3 d,16 ℃后酵 10 d。根据是否添加(NH4)2HPO4将实验分为实验组(添加组)和对照组(未添加组)。
1.2.3 无机氮源种类的选择 在不影响酵母生长的情况下,选取了可作为添加剂的几种无机氮源(表1),检测其对酵母生长的影响及降低高级醇的能力。以黄酒酿酒酵母为研究对象,在麦芽汁培养基中添加相同量(200 mg/L)的不同无机氮源,培养酵母,以A560nm和高级醇含量为检测指标,确定降低高级醇含量的无机氮源种类。
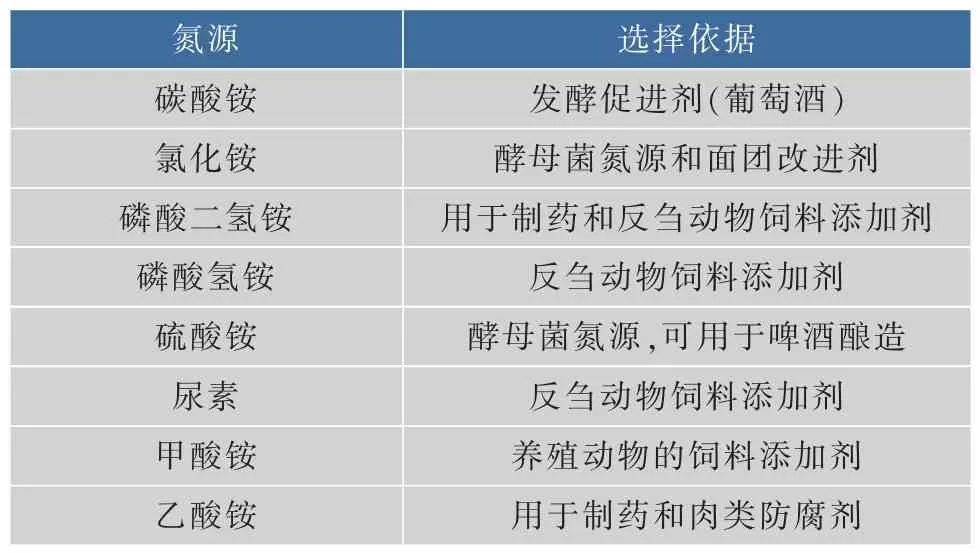
表1 无机氮源种类及选择依据Table 1 Thevarieties and selecting terms of nitrogen sources
1.2.4 高级醇的测定 采用顶空固相微萃取与气质联用 (Headspace-solid phase microextraction gas chromatography mass spectrometry,HS-SPME/GCMS)分析技术,检测高级醇体积分数。HS-SPME条件:取0.5 mL黄酒发酵液,加入到20 mL顶空瓶中,加5.44 mL体积分数15%的乙醇和60 μL内标(2-辛醇),使用 50/30 μm DVB/CAR on PDMS 萃取头,50℃萃取吸附40 min,250℃解吸7 min,用于GC-MS分析。GC 条件:色谱柱,TG-WAXMS(30 m×0.25 μm×0.25 mm);载气为高纯氦气(>99.999%),不分流,流量为1.0 mL/min;进样口温度,250℃;程序升温,起始温度40℃,保持3 min,以6℃/min的速率升温至100℃,然后以10℃/min升温至230℃,保持7 min。MS条件:离子化方式,EI;发射电流,50 μA;电子能量,70 eV;离子源温度,230 ℃;传输线温度,250 ℃;扫描质量范围,33~400。
高级醇体积分数计算公式:

其中:C—高级醇体积分数;Cis—内标物体积分数;
Ac—高级醇峰面积;Ais—内标物峰面积。
高级醇标准曲线如表2所示。
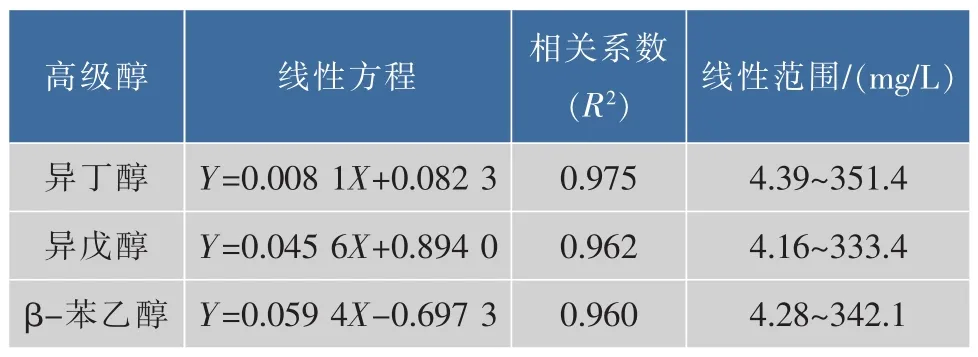
表2 高级醇的标准曲线Table 2 Standard curves of higher alcohols
1.3 数据处理及分析方法
本研究中三角瓶氮源筛选实验重复次数在6次以上(n≥6),黄酒模拟双边发酵工艺的重复次数为3次以上 (n≥3),所得结果利用Excel 2013、Sigmaplot 12.0和SPSS Statistics 20.0等统计软件进行数据处理和分析,最终结果以均值±标准差形式表示,方差显著性在P<0.05水平上进行ANOVA检验。
2 结果与讨论
2.1 黄酒高级醇检测
采用HS-SPME/GC-MS的方法检测了4个品牌(会稽山绍兴酒股份有限公司、浙江古越龙山绍兴酒股份有限公司、上海金枫酒业有限公司、浙江塔牌绍兴酒有限公司)的11个黄酒样品,结果发现,异丁醇、异戊醇和β-苯乙醇是黄酒中的主要高级醇(图1,代表性的黄酒样品图)。Chen等人的研究结果也认为异戊醇和β-苯乙醇是黄酒的主要高级醇[12],与我们的结果相似。
2.2 不同无机氮源对酵母生长及高级醇生成的影响
2.2.1 不同无机氮源对酵母生长的影响 氮源是构成细胞中所含蛋白质、核酸和酶等成分,以及代谢产物中氮素来源的营养物质[13-14]。由于黄酒是食品,所以无机氮源种类的选择需保障无机氮源是食品级添加剂,可用于食品生产,且不影响实际黄酒发酵。由图2和表3可以看出,添加一定量的无机氮源可促进酵母生长。其中(NH4)2HPO4促进酵母生长的效果较好。在苹果酒和葡萄酒发酵中,也已经证实无机氮源有促进酵母生长的作用[15]。法国酿酒法典和德国葡萄酒法规允许使用 (NH4)2HPO4作为酵母营养物,促进葡萄酒发酵。
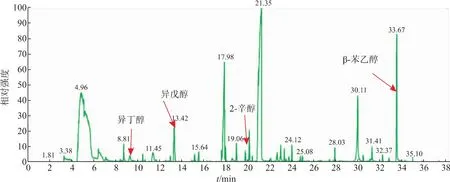
图1 代表性黄酒样品(会稽山黄酒)中高级醇及其他黄酒挥发性成分的GC-MS图谱(内标:2-辛醇)Fig.1 Higher alcohols and othervolatile components in Chinese rice wine from Kuaijishanshaoxing wine co.,Ltd
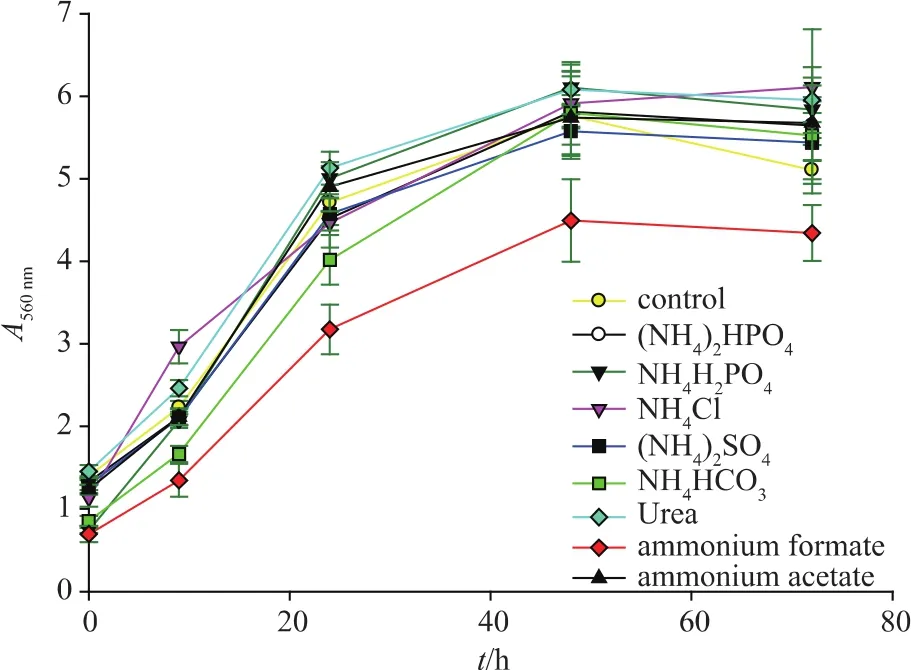
图2 不同氮源培养基中酵母的生长曲线Fig.2 Effect of nitrogen sources on the growth curves of yeast
2.2.2 不同无机氮源对高级醇生成的影响 根据高级醇合成途径推测,氮源的添加,促进了酵母氮源代谢,同时减少了糖源向氨基酸的转化,进而导致高级醇体积分数的降低。由图3~5可知,不同无机氮源的添加对高级醇(异丁醇、异戊醇和β-苯乙醇)的生成有一定的影响,其中(NH4)2HPO4降低高级醇体积分数的效果较好。证实了氮源补偿对高级醇体积分数生成的影响。Torrea等[16]人的研究也认为无机氮源补偿对葡萄酒高级醇体积分数生成有影响。该结果为后续研究奠定了基础。
2.2.3 实验结果验证-模拟双边发酵工艺酿造黄酒由上述实验得到了 (NH4)2HPO4降低高级醇的效果较好。模拟黄酒双边发酵工艺,同时将(NH4)2HPO4作为氮源补充剂添加进入发酵体系,酿造黄酒。结果表明,在此工艺条件下酿造的黄酒,其高级醇体积分数有所降低,其中异丁醇降低了17.5%,异戊醇降低了20.1%,β-苯乙醇体积分数降低了15.2%(图6)。
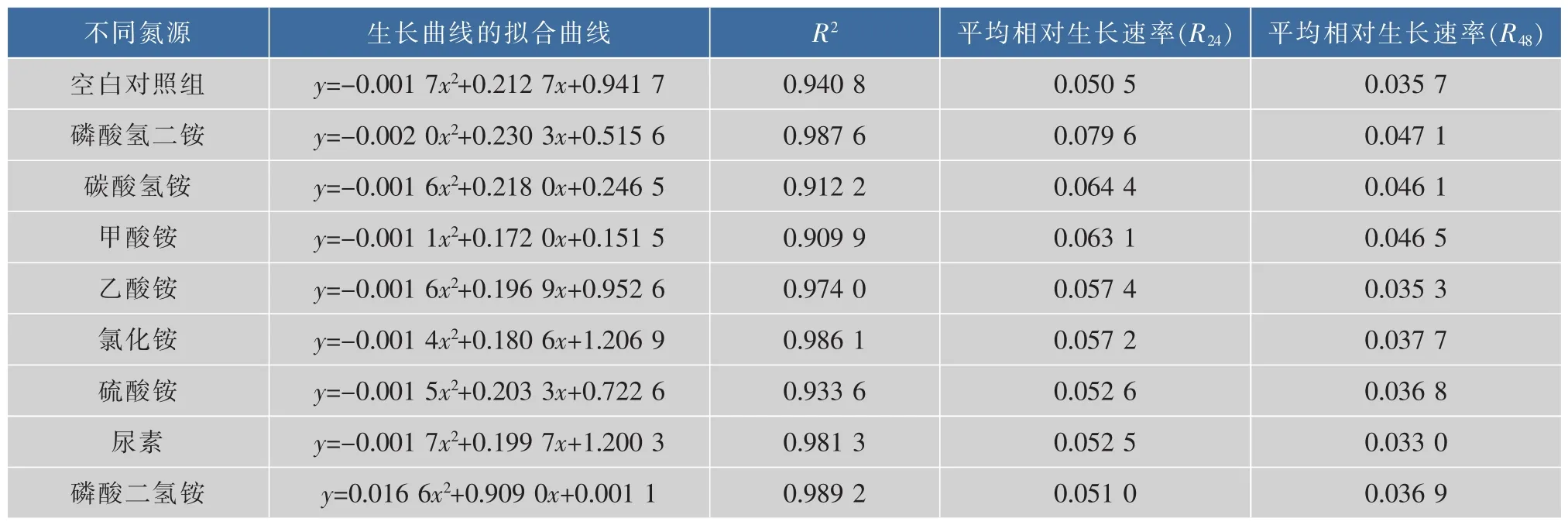
表3 不同氮源培养基中酵母的平均相对生长速率Table 3 Mean relative growth rate of yeast in the medium with different nitrogen sources
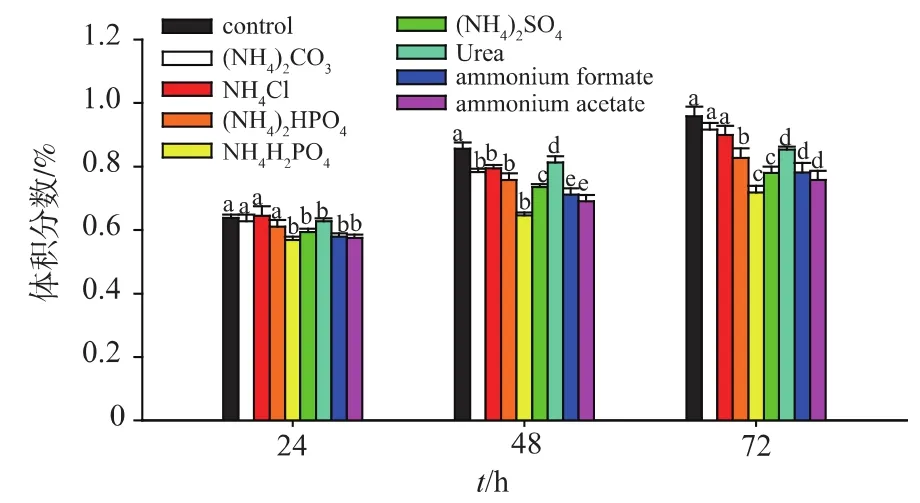
图3 不同氮源对异戊醇体积分数的影响Fig.3 Effect of the addition of nitrogen sources on the content of isoamyl alcohol
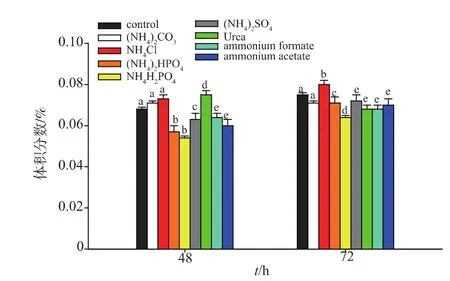
图4 不同氮源对异丁醇体积分数的影响Fig.4 Effect of the addition of nitrogen sources on the content of isobutyl alcohol
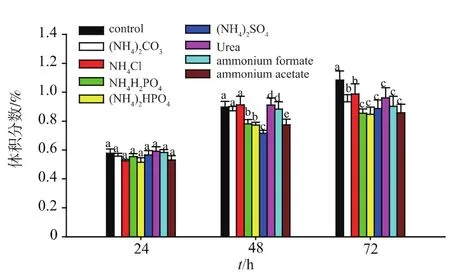
图5 不同氮源对β-苯乙醇体积分数的影响Fig.5 Effect of the addition of nitrogen sources on the content ofβ-phenethyl alcohol
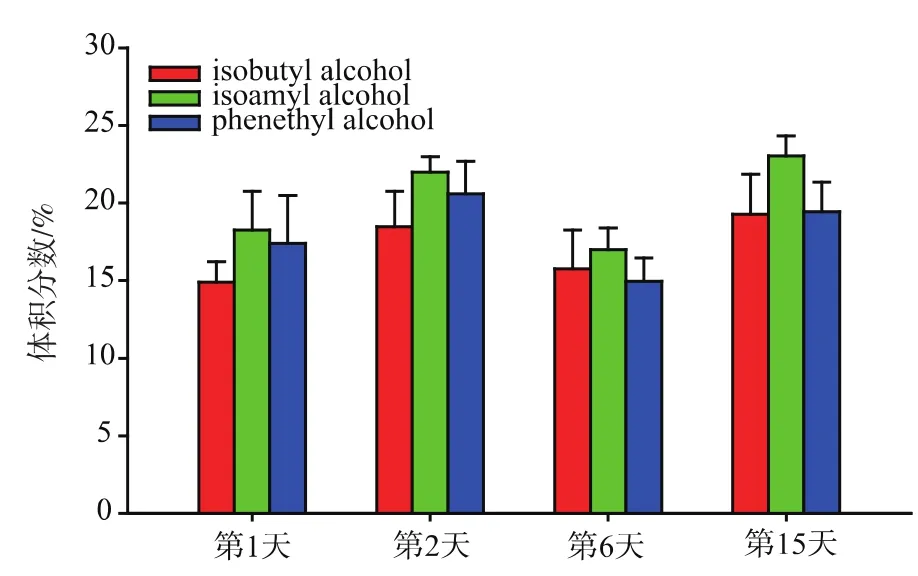
图6 铵盐补偿对黄酒高级醇体积分数的影响Fig.6 Effects of ammonium compensation on the content of higher alcohols in Chinese rice wine
3 结语
降黄酒高级醇含量无机氮源筛选研究,结果表明,适量的无机氮源对酵母生长具有促进作用,同时能够降低高级醇的体积分数,其中(NH4)2HPO4降低高级醇含量的效果较好。将其运用于黄酒发酵,发现黄酒中异丁醇体积分数降低了17.5%,异戊醇体积分数降低了20.1%,β-苯乙醇体积分数降低了15.2%。所得结果对高舒适度黄酒的生产具有借鉴价值。
参考文献:
[1]YANG Guojun.Report on the research of Chinese rice wine industry[J].China Brewing,2005,4:1-5.(in Chinese)
[2]MAO Qingzhong,SHI Caiqin.Study on the intoxication matter in yellow rice wine and its controlling technology[J].Jiangsu Condiment and Subsidiary Food,2010,27(3):17-21.(in Chinese)
[3]HORI H,FUJII W,HATANAKA Y,et al.Effects of?fusel oil?on animal hangover models[J].Alcoholism:Clinical and Experimental Research,2003,27(8):37-41.
[4]ZHANG Xingya,LIN Ling,JIANG Yujian.Research progress of controlling higher alcohols in rice wine[J].China Brewing,2011,10:13-16.(in Chinese)
[5]XIA Xiaole,ZHU Xiaoming,ZHANG Bin,et al.Quantitative analysis of fusel alcohol in Chinese rice wine and its explanation of formation mechanism[J].Food and Fermentation Industries,2011,12:125-129.(in Chinese)
[6]GETHINS Loughlin,GUNESEROnur,DEMIRKOIAsli,et al.Influence of carbon and nitrogen source on production of volatile fragrance and flavour metabolites by the yeast Kluyveromyces marxianus[J].Yeast,2015,32(1):67-76.
[7]ATSUMI S,HANAI T,LIAO J C.Non-fermentative pathways for synthesis of branched-chain higher alcohols as biofuels[J].Nature,2008,451(7174):86-89.
[8]ROLLEROStéphanie,BLOEM A,CAMARASA C,et al.Combined effects of nutrients and temperature on the production of fermentative aromas by Saccharomyces cerevisiae during wine fermentation[J].Applied Microbiology and Biotechnology,2015,99(5):2291-2304.
[9]ZHOU Shishui.Study on controlling content of higher alcohols in beer[J].Liquor Making,2005,3:51-53.(in Chinese)
[10]ZHANG Dan,SUO Ran,FAN Lixin,et al.Effects of assimilable nitrogen on the formation of higher alcohols in Jujube wine by solid fermentation[J].Liquor Making Science and Technology,2013,11:15-17.(in Chinese)
[11]MARTINEZz-MORENO R,QUIROS M,MORALES P,et al.New insights into the advantages of ammonium as a winemaking nutrient[J].International Journal of Food Microbiology,2014,177:128-135.
[12]CHEN S,XU Y,QIAN M C.Aroma characterization of chinese rice wine by gas chromatography-olfactometry,chemical quantitative analysis,and aroma reconstitution[J].Journal of Agriculture and Food Chemistry,2013,61(47):11295-11302.
[13]ZHAO X R,ZOU H J,FU J W,et al.Metabolic engineering of the regulators in nitrogen catabolite repression to reduce the production of ethyl carbamate in a model rice wine system[J].Applied and Environmental Microbiology,2014,80 (1):392-398.
[14]WANG Yue,ZHANG Rongxian,ZHANG Dandan,et al.Effects of carbon and nitrogen sources on keratinase production from Bacillus pumilus K9[J].Journal of Food Science and Biotechnology,2014,33(10):1077-1083.(in Chinese)
[15]CHEN D,CHIA J Y,LIU S Q.Impact of addition of aromatic amino acids on non-volatile and volatile compounds in lychee winefermented with Saccharomyces cerevisiae MERIT.ferm[J].International Journal of Food Microbiology,2014,170:12-20.
[16]TORREA D,VARELA C,UGLIANO M,et al.Comparison of inorganic and organic nitrogen supplementation of grape juice-Effect on volatile composition and aroma profile of a Chardonnay wine fermented with Saccharomyces cerevisiae yeast[J].Food Chemistry,2011,127(3):1072-1083.
