酵母粉对出芽短梗霉发酵普鲁兰多糖相对分子质量的影响
2018-03-27马赛箭上官亦卿薛文娇
安 超, 马赛箭, 常 帆, 上官亦卿, 丁 浩, 薛文娇
(陕西省微生物研究所,陕西 西安710043)
出芽短梗霉(Aureobacidium pullulans)是一类与酵母有密切关系的小型丝状真菌,属半知菌门短梗霉属,能发酵产生胞外多聚糖、酶、抗菌素、单细胞蛋白等多种物质[1-2]。普鲁兰多糖是一种水溶性黏性多糖可由出芽短梗霉发酵所产生,1938年,Bauer首次报道了这种特殊的微生物多糖,1959年,Bender分离纯化并将这种多糖命名为普鲁兰多糖[3]。普鲁兰多糖为无味、无嗅、无毒、可食用的天然碳水化合物,呈非结晶不定型粉末,具有极好的成膜性、成纤维性、阻氧性、可塑性、粘结性和易自然降解等独特的理化和生物学特性,对人体无任何副作用,并且,普鲁兰多糖的水溶液其黏度、特性几乎不受pH、盐类、酶的影响,因此被广泛应用于医药制造(胶囊和药物载体)、食品包装、水果和海产品保鲜、化妆品(保湿剂和水凝胶)、烟草制造、和农业种子保护等领域,是一种多功能新型生物制品[4]。
近年来,随着应用领域的不断细分及应用产品附加值的大幅提高,对普鲁兰多糖的生产提出了更高的要求。作为高聚物,多糖性能与相对分子质量及其分布特征密切相关[5],不同的应用必然要求不同的相对分子质量及其分布才能达到最佳效果[6-11]。普鲁兰多糖的相对分子质量分布范围在5.0×104~5.0×106左右[12],主要受出芽短梗霉菌种差异、碳源种类、培养时间及发酵pH等因素的影响。目前,商业化的普鲁兰多糖的数均相对分子质量大概在1.0×105~2.0×105, 重均相对分子质量大概在 3.62×105~1.8×105,相对分子质量分散指数一般在2.1到4.1之间。相对分子质量的分布范围决定了普鲁兰多糖的应用范围,例如 3.0×104~9.0×104大小的普鲁兰多糖分子片段可代替右旋糖酐作为血浆扩容剂[13-14]。
有机氮源中含有丰富的蛋白质、肽类、游离的氨基酸、糖类、脂肪和生长因子等,在出芽短梗霉的发酵过程中对普鲁兰多糖的产量和相对分子质量起着至关重要的作用。Wiley和Lin等人研究了碳源、氮源和磷酸盐对普鲁兰多糖相对分子质量分布的影响,其中氮源式影响相对分子质量的最大因素,铵离子被证实比硝酸根离子更有利于生产高相对分子质量的普鲁兰多糖[15-16];Morin和Kumar等人报道碳氮质量比为10∶1是普鲁兰多糖的最佳培养条件[17];Cheng等人研究表明:75 g/L蔗糖,3 g/L酵母粉和5 g/L的硫酸组合下,普鲁兰多糖的产量最高,培养7天后,收获25.8 g/L的普鲁兰多糖[18]。作者选用低色素出芽短梗霉CGMCC.No.11602为目标菌株,研究了不同质量浓度酵母粉对普鲁兰多糖产量、结构及相对分子质量的影响,为不同特性普鲁兰多糖的生产提供技术指导。
1 材料与方法
1.1 菌种
出芽短梗霉 (Aureobasidium pullulans)CGMCC 11062,保藏于中国微生物菌种保藏中心。
1.2 培养基
活化培养基(g/L):马铃薯去皮去芽眼、洗净、切块,称200 g放入1 000 mL蒸馏水中用文火煮沸30 min,双层纱布过滤,滤液加水补至1 000 mL,加20 g蔗糖,15 g琼脂粉,121℃,20 min灭菌。
种子培养基 (g/L): 葡萄糖 50.0;MgSO4·7H2O 0.2;K2HPO45.0; 酵母粉 1.7;(NH4)2SO40.6;NaCl 1.0;初始 pH 6.5,113~116 ℃,20 min 灭菌。
发酵培养基(g/L):蔗糖 50;MgSO4·7H2O 0.2;K2HPO45.0;(NH4)2SO40.6;NaCl 1.0,酵母粉质量浓度 (0,0.6,0.9,1.2,1.5,1.8,2.1 g/L)。 初 始 pH 6.5,113~116 ℃,20 min 灭菌。
1.3 标准品试剂
普鲁兰多糖标准品P4516-25G:Sigma公司产品。
1.4 仪器
恒温培养箱SPX-250:北京科伟永兴仪器有限公司产品;控温摇床ZWY-2102:上海智诚分析仪器制造有限公司产品;傅立叶变换红外光谱仪Nicolet is 50:Thermo Scientific产品;高效液相色谱仪(Waters 1515):Waters公司产品。
1.5 培养方法
活化培养方法:将菌种在28℃恒温培养箱培养5 d;种子培养方法:将活化好的菌株接种在装有50 mL种子培养液的250 mL三角瓶中,置于恒温摇床上(230 r/min),28℃条件下培养 48 h,即为种子液;发酵培养方法:按照体积分数5%接种量将种子接种到装有体积分数20%培养液的三角瓶中,置于恒温摇床上(230 r/min),28℃条件下培养96 h。
1.6 分析方法
1.6.1 菌体生物量 将发酵液30 mL装入50 mL离心管中,8 000 r/min,离心 10 min,取沉淀于 105℃干燥至恒重,生物量计算公式如下:
生物量(g/L)=(m实-m空)×1 000/30
1.6.2 普鲁兰多糖产量 取上清液15 mL加入30 mL体积分数为95%的乙醇,4℃静置12 h,8 000 r/min离心10 min,收集沉淀,加水重溶,再次加入30 mL体积分数为95%的乙醇进行沉淀,将沉淀于80℃烘至恒重,精确称重,多糖质量浓度计算公式如下:
多糖质量浓度(g/L)=(m实-m空)×1 000/15
1.6.3 残糖质量浓度 苯酚硫酸法[19]。
反应30 min,等冷却之后测定A490nm。待测样品稀释合适的倍数,使用与标曲测定的相同体系测定,根据标准曲线和稀释倍数计算发酵液中的残糖质量浓度。
1.6.4 结构测定 应用傅里叶变换衰减全反射红外光谱法(ATR-FTIR)直接测定制备获得的普鲁兰多糖粉末[20]。
1.6.5 相对分子质量测定 利用高效液相色谱法(GPC)测定普鲁兰多糖相对分子质量分布范围。以0.1 mol/L NaNO3作为流动相,流量0.5 mL/mim,柱温箱温度35℃,样品质量浓度1 g/L,进样量20 μL,数据处理使用Waters自带的Breeze软件积分获得[21]。
2 结果与分析
2.1 酵母粉质量浓度对出芽短梗霉发酵普鲁兰多糖的影响
不同酵母粉质量浓度对普鲁兰多糖发酵的影响如图1所示。由图我们可以看出,酵母粉的质量浓度对普鲁兰多糖产量及底物的碳源转化率影响很大,而对菌体的产量影响不是很大。其中,在未加酵母粉时,菌体产量5.92 g/L,普鲁兰多糖产量34.74 g/L,残糖质量浓度44.18 g/L。因此,有机氮源的缺失导致菌体含量和普鲁兰多糖产量偏低,造成大量底物剩余。随着酵母粉质量浓度的增加,菌体含量和普鲁兰多糖产量逐渐升高,同时,底物的利用效率也提升,特别是当酵母粉质量浓度为1.5 g/L时,普鲁兰多糖的产量出现最大峰值,达到了61.32 g/L,相对于单一的无机氮源,有机氮源类的酵母膏与无机氮源混合作为发酵氮源时,更有利于出芽短梗霉的生长及胞外多糖合成。而当酵母粉质量浓度超过1.5 g/L,多糖产量逐渐降低,这可能是由于过多的有机氮源供给促使碳源流向生物体自身。
2.2 有机氮源种类对普鲁兰多糖结构的影响
研究多糖结构的方法有许多种,如紫外光谱、红外光谱、核磁共振波谱、气相色谱-质谱联用以及多糖的分子修饰等。糖的红外光谱技术源自于20世纪70年代后,由于红外光谱技术的发展及糖化学的研究深入,红外光谱成为糖结构研究的重要手段之一,主要用于不同糖的鉴别、吡喃糖和呋喃糖的识别、糖苷键及糖构型的确定、糖键上主要取代基的识别[22]。
红外色谱分析结果见图2,结果表明:6种不同有机氮源的培养液发酵合成的普鲁兰多糖样品具有明显的多糖特征吸收峰,与普鲁兰多糖标准品具有一致的红外吸收。普鲁兰多糖在3 600~3 200 cm-1出现一宽峰,是糖类存在的分子间或分子内的O-H伸缩振动产生的;3 000~2 800cm-1存在吸收较弱的O-H的吸收峰;此两组吸收峰是糖类的特征峰[23]。1 400~1 200cm-1的吸收峰是由两个C-O伸缩振动产生,其中一个属于C-O-H,另一个是糖环C-O-C;1 000~700 cm-1包含着糖类特征吸收峰,主要表现为糖的吡喃环的振动谱。因此,酵母粉质量浓度对普鲁兰多糖的结构未产生显著影响。
2.3 有机氮源对普鲁兰多糖相对分子质量的影响
作者选用Sigma普鲁兰多糖相对分子质量标准品,使用Waters 1515-2414(示差检测器)检测平台,获得了普鲁兰多糖相对分子质量的标准曲线,如表1所示,相对分子质量越大,出峰时间越早。通过GPC测定不同有机氮源条件下的普鲁兰多糖相对分子质量大小,如图3所示,随着酵母粉质量浓度的增加,生成的普鲁兰多糖相对分子质量越来越小。通过Waters GPC自带的Breeze软件,依据普鲁兰多糖相对分子质量标准生成标准曲线,进而对不同质量浓度酵母粉制备的普鲁兰多糖的相对分子质量积分计算,具体参数见表2所示,其中不加酵母粉时生产的普鲁兰多糖相对分子质量最大,重均相对分子质量Mw为529 528,随着酵母粉质量浓度的增加,生成的普鲁兰多糖相对分子质量逐渐降低,重均相对分子质量Mw从529 528降低到183 278。Campbell等人发现在碳源被消耗完后且发酵液中仍然有很高的氮源浓度下,会诱导普鲁兰多糖降解酶的产生,并导致普鲁兰多糖相对分子质量及产量的降低[24];Orr等人发现提供过多的氮源会导致更高的出芽短梗霉生物量,而不是普鲁兰多糖的产量[25],研究也证明了这一点。所有条件下制备的普鲁兰多糖的分散系数在2.0~2.4之间,相对较窄,这可能与发酵周期短,未被水解酶水解有关。
2.4 有机氮源对普鲁兰多糖相对分子质量的影响
选用Sigma普鲁兰多糖相对分子质量标准品,使用Waters 1515-2414(示差检测器)检测平台,获得了普鲁兰多糖相对分子质量的标准曲线,如表1所示,相对分子质量越大,出峰时间越早。通过GPC测定不同有机氮源条件下的普鲁兰多糖相对分子质量大小,如图3所示,随着酵母粉浓度的增加,生成的普鲁兰多糖相对分子质量越来越小。通过Waters GPC自带的Breeze软件,依据普鲁兰多糖相对分子质量标准生成标准曲线,进而对不同浓度酵母粉制备的普鲁兰多糖的相对分子质量积分计算,具体参数见表2所示,其中不加酵母粉时生产的普鲁兰多糖相对分子质量最大,重均相对分子质量Mw为529 528,随着酵母粉浓度的增加,生成的普鲁兰多糖相对分子质量逐渐降低,重均相对分子质量Mw从529 528降低到183 278。Campbell等人发现在碳源被消耗完后且发酵液中仍然有很高的

表1 不同相对分子质量普鲁兰多糖标准曲线测定Table 1 Standard curve of different molecular weight of pullulan
氮源在一定质量浓度下,会诱导普鲁兰多糖降解酶的产生,并导致普鲁兰多糖相对分子质量及产量的降低[15];Orr等人发现提供过多的氮源会导致更高的出芽短梗霉生物量,而不是普鲁兰多糖的产量[16],研究也证明了这一点。所有条件下制备的普鲁兰多糖的分散系数在2.0~2.4之间,相对较窄,这可能与发酵周期短,未被水解酶水解有关。
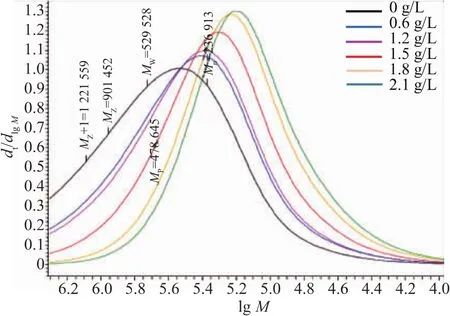
图3 酵母粉质量浓度对普鲁兰多糖相对分子质量大小的影响Fig.3 Effects of yeast extract concentration on pullulan molecular weight size
3 结语
普鲁兰多糖的相对分子质量决定了普鲁兰多糖的应用范围及医用价值,高相对分子质量的普鲁兰多糖更适用于商业用途。但是,针对不同的方向,对于普鲁兰多糖的要求不同,特别是对相对分子质量及其分布的要求。例如,作为生物材料及组织工程而言,要求高相对分子质量普鲁兰多糖且分布相对均一;作为血浆代用品则需要相对分子质量低的普鲁兰多糖(大概6×104左右)且要求其相对分子质量分布范围相对窄,因为高相对分子质量的普鲁兰多糖可能产生高的静脉压;作为一般的食品添加剂,中等相对分子质量的普鲁兰多糖就能满足需求。因此,不同相对分子质量级别的普鲁兰多糖的制备能够更好地满足普鲁兰多糖应用要求,增加产品的附加值,同时,也满足不同相对分子质量普鲁兰多糖的市场需求。
发酵过程调控是控制微生物多糖相对分子质量分布重要途径。氮源的水平和种类对菌体形态和代谢产物的合成起关键性作用,是一个重要且复杂的因素。作者选择工业生产中常用有机氮源酵母粉,研究了不同浓度酵母粉对出芽短梗霉CGMCC 11602发酵生产普鲁兰多糖的产量、结构、相对分子质量的影响。结果表明酵母粉质量浓度对出芽短梗霉的产量和相对分子质量影响显著,而对普鲁兰多糖结构不大。当酵母粉质量浓度为1.5 g/L时,普鲁兰多糖的产量出现最大峰值,达到了61.32 g/L,同时,过多的酵母粉供给造成了碳源流向生物体,普鲁兰多糖产量减少。不加酵母粉时生产的普鲁兰多糖相对分子质量最大,重均相对分子质量Mw为529 528,随着酵母粉质量浓度的增加,生成的普鲁兰多糖相对分子质量逐渐降低,重均相对分子质量Mw从529 528降低到183 278。表明有机氮源可能会诱导普鲁兰多糖降解酶的产生,并导致普鲁兰多糖相对分子质量及产量的降低。
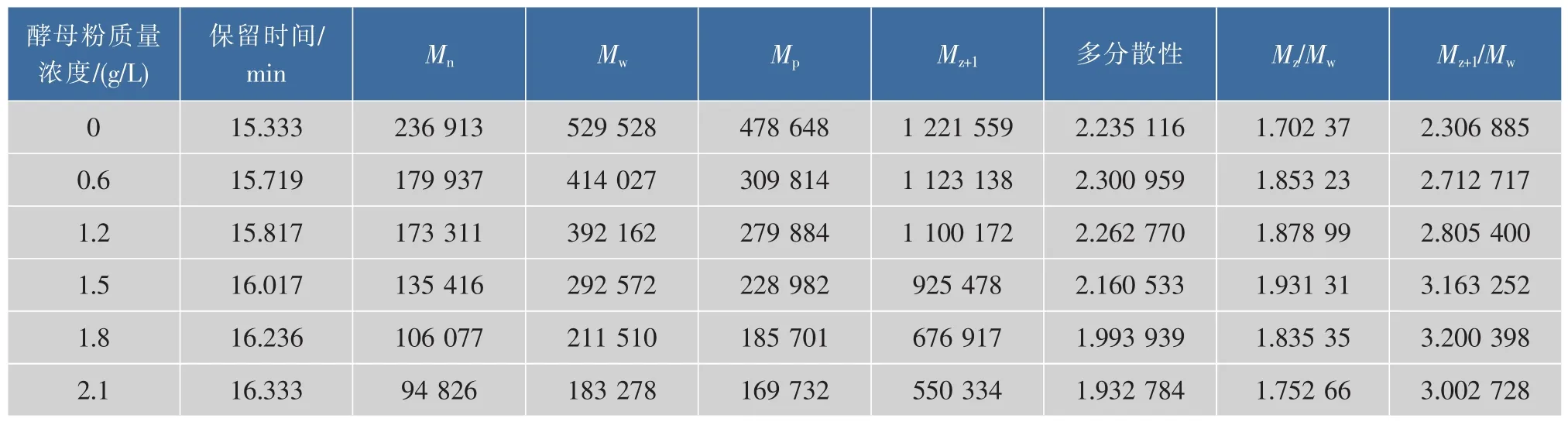
表3 有机氮源种类对普鲁兰多糖相对分子质量分布的影响Table 3 Effects of yeast extract concentration on pullulan molecular weight distribution
参考文献:
[1]BAE H,AHARI A F,SHIN H,et al.Cell-laden microengineered pullulan methacrylate hydrogels promote cell proliferation and 3D cluster formation[J].Soft Matter,2011,7(5):1903-1911.
[2]CHI Z,FANG W,ZHE C et al.Bioproducts from Aureobasidium pullulans,a biotechnologically important yeast[J].Applied Microbiology&Biotechnology,2009,82(5):793-804.
[3]BENDER H,LEHMANN J,WALLENFELS K.Pullulan,an extracellular glucan from Pullularia pullulans[J].Biochimica Et Biophysica Acta,1960,36:309-316.
[4]于航.低色素出芽短梗霉的选育及其培养条件优化[D].无锡:江南大学,2007.
[5]郝杰.霍山石斛不同分子量多糖的抗氧化研究[D].合肥:合肥工业大学食品学院,2009.
[6]HUANG Yueshan,PAN Yiming,XUE Jing.Research on the function and application of hyaluronic acid with different molecular weights[J].Chinese Journal of Dialysis and Artificial Organs,2010,22(4):10-13.(in Chinese)
[7]GAO Ruichang,LI Hui,LI Laihao,et al.Preparation and antioxidant properties of low molecular weight hyaluronic acid from tilapia eye[J].Science and Technology of Food Industry,2015,36(3):60-64.(in Chinese)
[8]YIN Zongqi,LI Ping,LI Dan,et al.Low-molecular-weight hydrogel M2 and cross-lincked hyaluronic acid as injectable cartilage regeneration scaffolds[J].Journal of Tissue Engineering and Reconstructive Surgery,2014(6):305-308.(in Chinese)
[9]毛华.不同分子量透明质酸钠的保湿效果评价[C].第九届中国化妆品学术研讨会.2012.
[10]DING Jinju,SUN Weiqing.Research Status of hyaluronan composite materials[J].Chinese Journal of Tissue Engineering Research,2015,19(21):3403-3408.(in Chinese)
[11]ZHANG Kun,JIAN Jun,ZHANG Zhenpu.Review of hyaluronan:its structure,properties,modifications and applications[J].Chinese Polymer Bulletin,2015(9).217-226.(in Chinese)
[12]刘畅.出芽短梗霉的发酵条件及其糖酵解研究[D].无锡:江南大学食品学院,2012.
[13]IGARASHI T,NOMURA K,NAITO K,et al.Plasma extenders[P].美国专利:4370472,1983.
[14]KULICKE W M,HEINZE T.Improvements in polysaccharides for use as blood plasma expanders[J].Macromolecular Symposia,2005,231(1):47-59.
[15]WILEY B J,BALL D H,ARCIDIACONO S M,et al.Control of molecular weight distribution of the biopolymer pullulan produced by Aureobasidium pullulans[J].Journal of Environmental Polymer Degradation,1993,1:3-9.
[16]LIN Y,ZHANG Z,THIBAULT J.Aureobasidium pullulans batch cultivations based on a factorial design for improving the production and molecular weight of exopolysaccharides[J].Process Biochemistry,2007,42(5):820-827.
[17]KUMAR A,MODY K B.Bacterial exopolysaccharides-a perception[J].Journal of Basic Microbiology,2007,47(2):103-117.
[18]CHENG K C,DEMIRCI A,CATCHMARK M J.Evaluation of medium composition and cultivation parameters on pullulan production by Aureobasidium pullulans[J].Food Sci Technol Int,2011,17:99-109.
[19]SENA R F,COSTELLI M C,GIBSON L H,et al.Enhanced production of Pulllulan by two strains of Aureobasidium pullulans with different concentrations of soybean oil in sucrose solution in batch fermentations[J].Brazilian Journal of Chemical Engineering,2006,23(4):507-515.
[20]ZOU J,ZHANG F,CHEN Y,et al.Responsive organogels formed by supramolecular self assembly of PEG-block-allylfunctionalized racemic polypeptides into β-sheet-driven polymeric ribbons[J].Soft Matter,2013,9(25):5951-5958.
[21]SUGUMARAN K R,SINDHU R V,SUKANYA S,et al.Statistical studies on high molecular weight pullulan production in solid state fermentation using jack fruit seed[J].Carbohydrate Polymers,2013,98(1):854-860.
[22]段效辉.普鲁兰多糖高产菌株Y68多糖发酵生产及其机理初步研究[D].青岛:中国海洋大学,2007:1-20.
[23]周文化.甘蔗糖蜜为原料发酵合成茁霉多糖及其在芒果常温保鲜中的应用研究[D].海口:海南大学,2004:1-7.
[24]LIN Yulu.Research on relationship of polysaccharides chemical structure and structure-activity[J].Journal of Jianghan University(Social Science),2000(6):34-37.(in Chinese)
[25]CAMPBELL B S,UGALL B M,SEVIOUR R J.Why do exopolysaccharide yields from the fungus Aureobasidium pullulans fall during batch culture fermentation?[J].Enzyme&Microbial Technology,2003,33(3):104-112.
[26]ORR D,ZHENG W,CAMPBELL B S,et al.Culture conditions affecting the chemical composition of the exopolysaccharide synthesized by the fungus Aureobasidium pullulans[J].J Appl Microbiol,2009,107:691-698.
