苜蓿根瘤菌绿色荧光蛋白标记株的构建及对菌株结瘤固氮能力的影响
2018-03-27杨晓玫师尚礼
杨晓玫,周 彤,阿 芸,师尚礼,
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
绿色荧光蛋白(Green Fluorescent Protein,GFP)为发光蛋白,最初在维多利亚多管水母中发现,吸收光谱的最大峰值为395 nm,为紫外光;发射光谱最大峰值为509 nm,呈现绿色荧光。gfp分子量小,对细胞无毒,只编码238 氨基酸,不干扰标记蛋白的功能和定位,其具有的特点性质及荧光特性稳定、检测方便可靠的优点,使gfp在细菌的分子标记研究中的应用非常广泛。GFP基因标记采用三亲本杂交的方法,将供体菌、辅助菌和受体菌混合培养,用荧光显微镜选择平板上长出的单菌落,肉眼可见接合子菌落发出的绿色荧光[1]。史巧娟[2]应用gfp基因在华癸中生根瘤菌中的异源表达,构建基于gfp的广宿主范围启动子探针载体,通过鸟枪克隆技术以gfp为报告基因原位活体监测华癸中生根瘤菌侵染紫云英的早期结瘤过程。HumbertoJ O Ramos[3]应用gusA和gfp基因标记大豆根瘤菌,检测其占瘤率[3]。
运用三亲本杂交方法的荧光标记,即利用分子生物学手段将标记荧光基因引入到目的根瘤菌中,从而利用导入根瘤菌的荧光基因所编码的酶作用于多种底物而产生颜色反应或发光现象,从而能够比较直观地跟踪所要研究的目的根瘤菌。三亲本杂交是在双亲本杂交的基础上建立起来的。Chalfie 等[4]首次在果蝇、大肠杆菌等生物体内成功表达绿色荧光蛋白(GFP)基因,因此,人们将携带有绿色荧光标记的果蝇、大肠杆菌等生物体作为又一快速高效的研究工具,应用于分子生物学和细胞生物学领域,三亲本杂交的方法得以广泛的应用。
目前,已有青色荧光蛋白成功运用三亲本杂交法构建苜蓿cfp荧光标记菌株,不影响苜蓿的固氮能力和植物生长指标[5],三亲本杂交是应用比较广泛的接合转移方法,但荧光资源短缺,一种颜色的荧光质粒蛋白不便于同时多元化标记。gfp荧光蛋白是cfp荧光蛋白的突变体,基于绿色荧光蛋白成功转导大肠杆菌并稳定表达,以三亲本杂交方法构建gfp荧光标记苜蓿根瘤菌的基础上,通过无氮培养基和抗生素选择平板对标记株进行筛选,对优良菌株进行遗传稳定性验证和回接鉴定,并通过测定回接植株的生物量、结瘤特性和发光根瘤的数量,探讨优良标记株的荧光蛋白表达能力。
1 材料和方法
1.1 材料
1.1.1 供试菌株 受体菌株为苜蓿根瘤菌RhizobiummelilotiGN5、苜蓿中华根瘤菌标准菌Sinorhizobiummeliloti12531和苜蓿中华根瘤菌标准菌Sinorhizobiummeliloti343。
苜蓿根瘤菌RhizobiummelilotiGN5分离自甘农5号紫花苜蓿(Medicagosativacv. Gannong No.5)种子,由教育部草业生态系统重点实验室提供,经中科院微生物鉴定与保藏中心鉴定;苜蓿中华根瘤菌标准菌Sinorhizobiummeliloti12531和苜蓿中华根瘤菌标准菌Sinorhizobiummeliloti343,购自中国科学院微生物保藏中心。供体菌为含gfp荧光基因质粒的大肠杆菌E.coliGFP104。辅助菌为大肠杆菌EscherrichiacolipRK2073。
1.1.2 培养基 YMA培养基用于根瘤菌的增殖培养,参照文献[6]的方法配制。
TY(Yeast Tryptone Agar)培养基用于观察检测标记菌株荧光表达能力,参照文献[7]的方法配制。LB(Luria Bertani)培养基用于增值培养供体菌和辅助菌,参照文献[8]的方法配制。SM(Supplemental Medium)培养基用于分离培养菌体,参照文献[9]的方法配制。Winogradsky无氮固体培养基用于快速检测接合子的固氮能力,参照文献[10]的方法配制。 各种培养基均以121℃湿热灭菌26 min。
含抗生素固体培养基的配制:抗生素溶液氨苄(Amp)和庆大霉素(Gm)各0.005 g,加入100 mL去离子水溶解后经0.22 μm的无菌滤膜过滤,制成浓度为50 μg/mL的溶液。待配制的固体培养基冷却至40℃时加入,制成TY/LB/SM含药固体平板。
1.1.3 植物材料 甘农5号紫花苜蓿种子,由教育部草业生态系统重点实验室提供,种子发芽率90.6%,净度98.5%。
1.2 荧光标记根瘤菌的构建
三亲本杂交法荧光标记根瘤菌的构建,混合菌体是在凌瑶[11]的方法上予以改进,即在含庆大霉素(Gm)50 μg/mL和氨苄(Amp)50 μg/mL的LB固体培养基活化供体菌E.coli104和辅助菌E.coli2073。28℃培养16~18 h,分别转接菌株到含50 μg/mL Gm和50 μg/mL Amp的LB液体培养基中,37℃、120 r/min摇床震荡培养至菌体生长对数期(D600 nm=0.5)。将以上供体菌、辅助菌、受体菌的菌液各1.5 mL混合,8 000 r/min离心5 min得到混合菌体沉淀,弃上清液后向沉淀加入1 mL无抗生素TY液体培养基,振荡混匀并8 000 r/min离心5 min,弃上清液后留混合菌体沉淀。
混合培养在TY固体平板表面每皿贴3片0.22 μm无菌滤膜,菌体沉淀加1 mL无菌水打散成浓菌液,加0.2 mL浓菌液至滤膜中央,28℃正置2 h后倒置培养。2~3 d后用镊子取出已长出培养物的滤膜,放入无菌西林瓶中,5 mL无菌水洗菌体后用无菌水稀释10倍,取0.2 mL菌液在SM+Gm固体平板上涂布,28℃培养7 d,挑取平板上50个单菌落,依次编号,分别点接于无抗生素TY培养基和无氮培养基,每菌株3次重复,28℃培养至菌落出现。检测菌落后,在荧光显微镜下选择可发绿色荧光单菌落的培养菌落转接于无氮培养基,无氮平板上能正常生长的菌株则为荧光标记根瘤菌(接合子)。
1.3 标记根瘤菌的遗传稳定性检测方法
甘农5号紫花苜蓿荧光标记菌的筛选参照文献[12]的方法,参照文献[13]的方法进行回接试验,盆栽试验采用随机区组设计[14],每菌株4次重复,对照组为不接菌的处理。每盆栽种5粒灭菌苜蓿种子,重复单个无菌沙培盆栽,出苗3 d后留苗一株。分别标号后放入关照培养室,日常处理参照文献[12]的方法,45 d后测定植株的株高、根长、生物量、根瘤重和单株结瘤数。
根瘤固氮酶活性测定:使用乙炔还原法等[15]的方法测定,进样温度150℃,柱温175℃,,FID170℃,进样50 μL,每处理3次重复。
标记菌占瘤率的测定:蒸馏水慢慢清洗苜蓿苗根系,最后用无菌水冲洗3~5次,收集苜蓿苗单株上的所有根瘤,表面灭菌后用荧光显微镜观察,有绿色荧光的根瘤为荧光标记株侵染形成[9],按照以上方法,筛选出荧光蛋白表达能力强、占瘤率高、荧光质粒遗传稳定、固氮酶活性高且能使苜蓿植株生物量增加的荧光标记菌株。
1.4 数据分析
以SPSS 13.0统计软件对数据进行单因素方差分析,用Duncan法进行数据的多重比较,采用Excel 2007制图[16]。
2 结果与分析
2.1 荧光标记根瘤菌接合子的构建和初选
3种根瘤菌分别从SM+Gm平板上选出各20个可以在TY培养基上形成菌落的接合子,用荧光显微镜压片观察其荧光蛋白表达均出现绿色荧光(图1)。
在S.meliloti12531菌株的接合子中,6个菌株的3次重复均能在无氮固体培养基上正常生长(表1),表
2中R.melilotiGN5的8个菌株的3次重复均能在无氮培养基上生长,表3中R.meliloti343的4个菌株的3次重复均能在无氮培养基上生长,表明菌株的固氮能力能够稳定遗传;综合接合子的发光及生长特性,筛选出S.meliloti12531菌株的6个接合子,R.melilotiGN5菌株的8个接合子,R.meliloti343菌株的4个接合子,由此可见在SM+Gm上获得的菌株大部分在传代过程固氮性能并不稳定,仅约13%的菌体可稳定遗传。因此,无氮培养基能很稳定的筛选荧光标记固氮菌株。

图1 3种绿色荧光标记根瘤菌在显微镜下的荧光表达Fig.1 Fluorescence expression of three green fluorescent protein labeled strains of rhizobia

接合子编号12345678910S.meliloti12531++++-++++---+++-++---+++++-+-+R.melilotiGN5+++++++++---+++--+---+++++++-+S.meliloti343+-+++++-+---+-+-++---++++----+接合子编号11121314151617181920S.meliloti12531--+---++++-++--+++--------+-+-R.melilotiGN5--+-+-++++--++-+++-------++---S.meliloti343-++---+--+-+++++++-------++++-
注:“+”表示接合子能在无氮培养基上生长,“-” 表示接合子不能在无氮培养基上生长,“+++”表示接合子3次重复均能在无氮培养基上生长,“---”表示接合子3次重复均不能在无氮培养基上生长,“+--”等表示接合子3次重复中不完全在无氮培养基上生长
2.2 荧光标记根瘤菌的遗传稳定性
初选获得的接合子在无抗生素的TY固体培养基上连续传代10次后,荧光质粒的丢失率均低于10%(表2),可见gfp荧光质粒随宿主菌的传代能稳定复制进入下一代,说明与荧光质粒的结合能力较好的菌株,固氮能力比较稳定。其中丢失率为0的R.melilotiGN5-gfp2、R.melilotiGN5-gfp4、S.meliloti343-gfp2、S.meliloti12531-gfp2及S.meliloti12531-gfp的荧光蛋白表达能力也最强,最后进行宿主植株回接试验。
2.3 荧光标记根瘤菌的回接鉴定和筛选
接种标记菌的苜蓿幼苗的生物量和株高与未接种植株(CK)有明显的差异。其中,甘农5号紫花苜蓿回接中CK1-gfp2,CK2-gfp2及CK3-gfp4菌株的生物量高出对照74%~81%,与对照差异显著(P<0.05),紫花苜蓿343回接中CK1-gfp2,CK2-gfp4和CK3-gfp4菌株的生物量高出对照65%~87%,与对照差异显著(P<0.05)(表3)。甘农5号紫花苜蓿回接中CK1-gfp2,CK2-gfp2和CK3-gfp4植株株高高出对照33%~85%,与对照差异显著(P<0.05),紫花苜蓿343回接中CK1-gfp2、CK2-gfp4及CK3-gfp4植株株高高出对照48%~82%,与对照差异显著(P<0.05)。5株标记菌回接植株的根长与对照差异显著(P<0.05)(表4),表明苜蓿根瘤菌荧光标记株和接种根瘤菌一样能有效的促进幼苗地上部分的生长,增加干物质的积累和生物量,而与接种根瘤菌菌株之间无显著的差异。可见优良标记菌额外的标记质粒要消耗碳水化合物,未显著影响菌体对植株的促生作用,仍具备荧光的表达特性。因此,在优良的标记菌中,携带gfp荧光标记基因质粒的荧光表达效率高且耗能低。

表2 荧光质粒丢失率
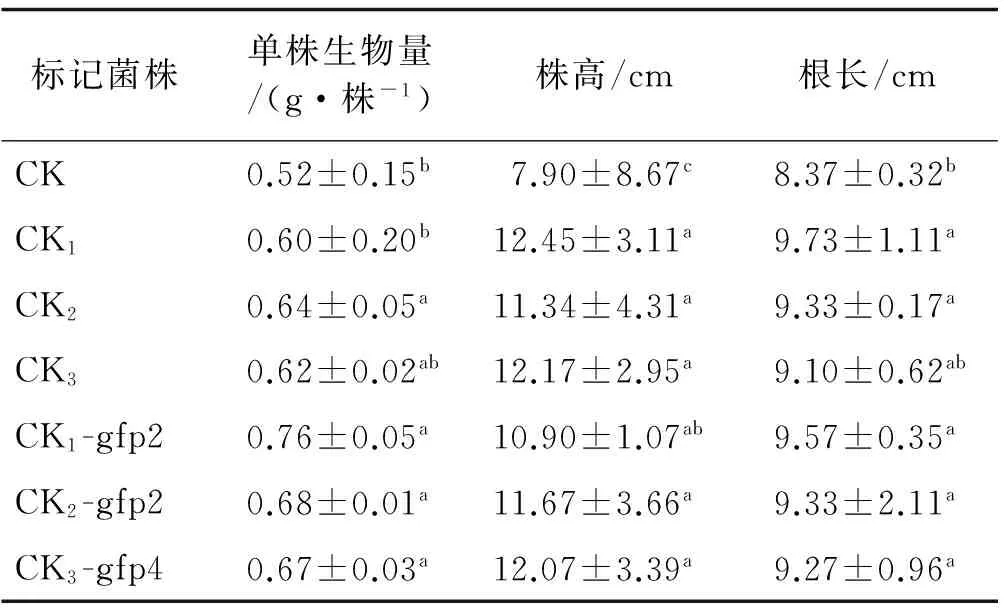
表3 标记根瘤菌处理下甘农5号苜蓿幼苗的生长
注:同列不同小写字母表示同一生长指标接种不同标记菌的处理间差异显著(P<0.05),CK为接种无菌水的对照,CK1为接种出发菌R.meliloti343苜蓿根瘤菌,CK2为接种出发菌R.meliloti12531苜蓿根瘤菌,CK3为接种出发菌R.melilotiGN5苜蓿根瘤菌,下同
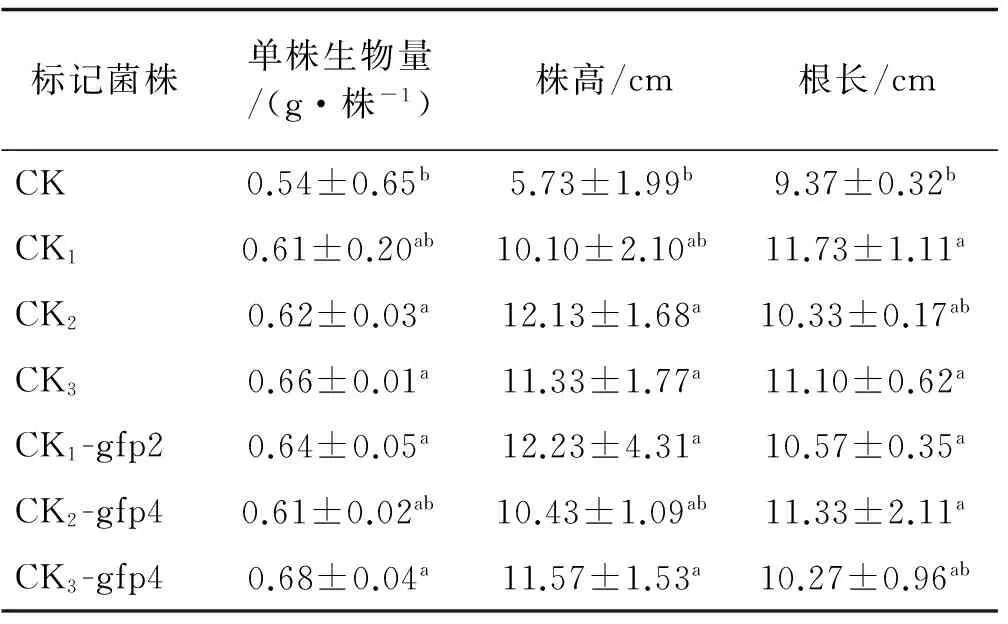
表4 标记根瘤菌处理下紫花苜蓿343苜蓿幼苗的生长
根瘤菌主要是侵染寄主植株形成有效根瘤,未接种对照根瘤的鲜重和数量等均较低,此次试验中筛选出5株荧光表达强度较高、回接植株根瘤数、固氮酶活性和单个根瘤鲜重较显著的荧光标记株(图1),其中,在甘农5号紫花苜蓿回接中CK1-gfp2,CK2-gfp2和CK3-gfp4的根瘤数高出对照20%~32%,固氮酶活性为对照的22.9~31.9倍,单个根瘤鲜重高出对照23%~30%,除CK1-gfp2处理占瘤率高于CK3-gfp4处理13.7%外,其他根瘤指标与CK3-gfp4处理差异不显著(P>0.05),CK1-gfp2可作为甘农5号的标记菌株优良菌株研究(表5)。在紫花苜蓿343回接中CK1-gfp2,CK2-gfp4及CK3-gfp4的根瘤数高出对照10%~78%,固氮酶活性为对照的28.9~39.3倍,单个根瘤鲜重高出对照35%~60%,除CK1-gfp2处理占瘤率高于CK3-gfp4处理7.04%外,其他根瘤指标与CK2-gfp4处理差异不显著(P>0.05)。依据植物促生能力、占瘤率和结瘤情况数据分析, 表明CK1-gfp2及CK2-gfp4可分别作为紫花苜蓿343的优良标记菌株用于更深研究(表6)。结果表明,三亲本杂交后代的相同供体菌株中固氮能力和结瘤等之间的差异不显著,说明三亲本杂交方法质粒通过辅助菌株接合受体菌株的整个过程,对不同接种根瘤菌菌株的固氮能力和结瘤能力未产生明显的影响,能作为研究苜蓿根瘤菌的有效示踪荧光。

表5 标记根瘤菌对甘农5号紫花苜蓿幼苗根瘤的影响

表6 标记根瘤菌对紫花苜蓿343幼苗根瘤的影响
3 讨论
目前,国内外对苜蓿根瘤菌优良菌株的筛选颇有研究,已有报道用三亲本杂交方法成功构建出遗传稳定的cfp荧光标记苜蓿根瘤菌[5],三亲本杂交是在双亲本杂交的基础上,质粒在辅助菌的协助下进入受体菌,如将gfp荧光基因导入到青蒿转基因芽后能够稳定表达[17]。gfp是良好的细胞间信号传递的动态标记分子,有敏感的标记检测率[18]。研究中,运用三亲本杂交方法高效构建遗传稳定的gfp荧光标记根瘤菌,构建的标记根瘤菌在TY固体培养基上连续传代10代后,gfp荧光质粒的丢失率均低于10%。各出发菌与其绿色荧光标记菌接种苜蓿幼苗的单株生物量、根长、株高和固氮酶活性等均显著(P<0.05)高于未接种的处理,说明出发菌与其荧光标记菌均具有明显的促生作用,且荧光标记根瘤菌不会对苜蓿幼苗的根系产生影响。
三亲本杂交法中,培养基上出现的假接合子很难区分。试验中,假接合子或丧失固氮能力的标记菌株比例较高,用反复的形式观察和宿主回接试验是否结瘤,太过复杂耗时[9]。因此,借助根瘤菌在无氮培养基上正常生长的特性,用无氮和TY固体培养基同步验证菌种的固氮和发光特性,同时也验证了陈力玉等[5]的研究结果,简化了筛选验证的流程,提高了标记菌选育效率,具有良好的应用前景。
4 结论
绿色荧光标记根瘤菌接种苜蓿幼苗的单株生物量、株高和根长等与对应的出发菌相比,无显著差异,表明荧光质粒的导入没有影响菌株对苜蓿幼苗生物量积累的促进效果。外源质粒对菌株共生固氮能力的影响可能是促进、也可能是抑制[19]。一些根瘤菌在导入外源质粒后侵染结瘤和共生固氮能力会显著提升[20],可使宿主植株的生物量、根瘤鲜重及植株含氮量增加[21]。试验研究发现对标记菌株的结瘤及促生能力进行验证很重要,仅次于荧光蛋白表达强度。同一出发菌株的荧光标记菌结瘤能力和固氮酶活性无较大的差异。
在固氮能力指标中,绿色荧光标记根瘤菌和对应的出发菌与其对照在接种的苜蓿幼苗的生物量、根瘤数、根瘤固氮酶活性、单个根瘤鲜重和占瘤率方面的表现有明显差异。甘农5号紫花苜蓿回接中CK1-gfp2,CK2-gfp2和CK3-gfp4菌株的生物量高出对照74%~81%,根瘤数高出对照20%~32%,单个根瘤鲜重高出对照23%~30%,固氮酶活性为对照的22.9~31.9倍,与对照差异显著(P<0.05),紫花苜蓿343回接中CK1-gfp2,CK2-gfp4和CK3-gfp4菌株的生物量高出对照65%~87%,根瘤数高出对照10%~78%,单个根瘤鲜重高出对照35%~60%,固氮酶活性为对照的28.9~39.3倍,与对照差异显著(P<0.05)。
研究最终获得了理想的标记根瘤菌,形成的根瘤的荧光表达能力强,与未接种菌株易于区分(图1),与未接种相比有良好的促生能力,其中甘农5号紫花苜蓿标记菌株CK1-gfp2、紫花苜蓿343标记菌株CK1-gfp2及CK2-gfp4荧光蛋白表达强度、占瘤率、根瘤的固氮酶活性等均高出其他标记菌株,可用于进一步的根瘤菌示踪研究。
[1] Shimumura O,Johnson F H,Saiga Y.Extraction purification and properties of a bioluminesecent protein from the luminous hudrmedusan[J].Aequorea Cell Comp Physiol,1962,59:223-240.
[2] 史巧娟.绿色荧光蛋白基因(gfp)在华癸中生根瘤菌与紫云英共生固氮作用研究中的应用[D].武汉:华中农业大学,2001.
[3] Humberto J O Ramos,Emanuel M Souza O,Juliana R L,et al. Determination of bean nodule occupancy by Rhizobium tropiciusing the double gfp and gusA genetic markers constitutively expressed fromanewbroad-host-rangevector[J].World Journal of Microbiology and Biotechnology,2007,23:713-717.
[4] Chalfie M Tu Y,Euskirchen G W,Prasher D C.Green fluorescent protein as a marker of gene expression[J].Science,1994,263:802-805.
[5] 陈力玉,张淑卿,李剑锋,等.接种荧光标记根瘤菌对苜蓿幼苗生长的影响[J].草原与草坪,2013,33(6):1-8.
[6] 殷爱华,韩素芬.豆科树种凝集素和根瘤菌胞外多糖结合反应与结瘤的关系[J].南京林业大学学报(自然科学版),2005,29(5):88-90.
[7] 袁全,杨梦华,郑会明,等.中慢生型华癸根瘤菌MesorhizobiumhuakuiiAS9 自体诱导物合成酶基因的筛选及其功能分析[J].土壤,2009,41(3):459-463.
[8] 胡元森,李翠香,孙富林,等.不同培养基组合提高土壤细菌可培养性的研究[J].微生物学报,2007,47(5):882-887.
[9] 陈力玉.基于三亲本杂交的荧光标记根瘤菌的构建及其稳定性检测研究[D].兰州:甘肃农业大学,2013.
[10] Islam M S,Kawasaki H,Nakagawa Y,etal.Labrysokinawensissp.nov. andLabrysmiyagiensissp. nov.,budding bacteria isolated from rhizosphere habits in Japan,and emended descriptions of the genus Labrys and Labrys monachus[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(3):552-557.
[11] 凌瑶.用cfp标记基因法研究菜豆根瘤菌的竞争性和有效性[D].雅安:四川农业大学,2005.
[12] 李剑锋,张淑卿,师尚礼.微波诱变选育高产生产素及耐药性根瘤菌株研究[J].核农学报,2009(6):981-985.
[13] 张志芳,夏叔芳.几种豆科牧草根瘤的分离与接种试验[J].草业科学,1994,11(5):59-64.
[14] 高永革,李黎,刘祥,等.黄河滩区紫花苜蓿生产性能比较研究[J].草业科学,2008,25(7):59-64.
[15] Hara S,Hashidoko Y,Desyatkin R V,etal.High rate of N2 fixation by east siberian cryophilic soil bacteria as determined by measuring acetylene reduction in nitrogen-poor medium solidified with gellan gum[J].Applied Environment Microbiology,2009,75:2811-2819.
[16] Muhammad Z,Asif T,Ata C Z ,etal.Weed-crop competition effects on growth and yield of sugarcane planted using two methods[J].Pakistan Journal of Botany,2010,42(2):815-823.
[17] 陈大华,叶和春,李国凤,等.绿色荧光蛋白基因在青蒿转基因芽中的表达[J].植物学报,1999,41(5):490-493.
[18] 汪恒英,周手标,常志州,等.绿色荧光蛋白(GFP)研究进展[J].生物技术,2004,6(70)113-115.
[19] 朱光富,周俊初,陈华癸,等.外源质粒(基因)导入花生根瘤菌的行为分析[J].遗传学报,1996,23(2):172-175.
[20] 李杰,陈丽华,李希臣,等.一种应用luxAB基因标记大豆根瘤菌的新方法[J].大豆科学,2003,22(3):172-175.
[21] 李友国,周俊初.导入dctABD和nifA基因对费氏中华根瘤菌共生固氮的影响研究[J].遗传学报,2002,29(2):181-188.
