贵长猕猴桃腐烂菌的侵染途径及分离鉴定
2018-03-27黄亚励孙晓红
冯 丽,魏 洪,黄亚励*,徐 红,孙晓红,蒋 静
(1.贵州医科大学 公共卫生学院环境污染与疾病监控教育部重点实验室暨贵州省普通高等学校病原生物学特色重点实验室,贵州 贵阳 550025;2.贵州医科大学 基础医学院,贵州 贵阳 550025;3.贵州医科大学 食品安全学院,贵州 贵阳 550025)
猕猴桃(Actinidiadeliciosa)是猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)的多年生落叶植物,其果实营养丰富,有“水果之王、VC之王”的美称,深受消费者喜爱。截至2015年,贵州省修文县猕猴桃种植面积达15万hm2,“贵长”猕猴桃为主栽品种,占90%以上[1]。猕猴桃皮薄汁多,是典型的呼吸跃变型果实,有明显的生理后熟过程,果实易软化,出现异味和霉烂,影响果实的贮藏、运输与销售,限制了猕猴桃的产业发展[2]。
国外报道的导致猕猴桃腐烂的主要病原菌是灰葡萄孢菌(Botrytis cinerea)和拟茎点霉(Phomopsissp.),认为病原菌先在衰老的花器上寄生,然后通过花端或在采收、分级、包装过程中通过果蒂进入果实内[3-6]。王井田等[7]研究发现,“徐香”猕猴桃致腐烂病原菌是拟茎点霉(Phomopsis sp.),该病菌潜伏在果园中,其侵染规律是菌丝体或者分生孢子器在发病的枝蔓、残留的果梗和落叶落果上越冬,在下一年春季分生孢子借风、雨水、昆虫传播,在谢花后的3周左右侵染幼果,谢花后6周左右侵染达到高峰,此后侵染达到平稳状态,7月下旬开始第二次侵染。丁爱冬等[8]对“秦美”和“海沃德”猕猴桃的腐烂病原菌进行研究,认为病原菌在果园不是潜伏侵染的,采收运输时造成的机械伤口是主要的侵染途径,未发现在果实过熟衰老前病原菌直接穿透果皮侵染。查阅相关文献,发现国内外对“贵长”猕猴桃腐烂的病原菌及其侵染途径研究较少。为了解“贵长”猕猴桃腐烂的病原菌种类及其可能的侵染途径,以其花、鲜果及腐烂果为研究对象,分离猕猴桃不同生长阶段所携带的真菌,通过形态学、分子生物学进行鉴定,致病性试验确定主要致病菌,以期为延长“贵长”猕猴桃贮藏期提供科学依据。
1 材料与方法
1.1 材料与试剂
2016年5月至2017年1月,在贵州省修文县猕猴桃基地(26.882 23°N,106.608 704°E,亚热带季风性湿润气候),分别采集猕猴桃健康无病害的花和鲜果,部分鲜果在冷藏室贮藏形成腐烂果,品种为贵长,分别进行花、鲜果及腐烂果的真菌分离。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:上海博微生物科技有限公司;琼脂糖(agarose)G-10:法国BIOWEST公司;Ezup柱式真菌基因组DNA抽提试剂盒:生工生物工程股份有限公司;2×EsTaqMasterMix、ddH2O、脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:北京康为世纪生物科技有限公司;乳酸、苯酚、丙三醇(均为分析纯):成都金山化学试剂有限公司;ITS1和ITS4引物:英潍捷基(上海)贸易有限公司合成。
1.2 仪器与设备
HH-B11·500-BY电热恒温培养箱:上海跃进医疗器械有限公司;HH·W21·Cr600电热恒温水温箱:北京长源实验设备厂;101-2型电热鼓风恒温干燥箱:浙江上虞市圣超仪器厂;WD-9413B凝胶成像分析仪:北京市六一仪器厂;BXM-30R立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;DYY-7C型电泳仪:北京六一生物科技有限公司;TGL-16B离心机:上海安亭科学仪器厂;ci-e-ds-r11正置荧光显微镜:尼康仪器(上海)有限公司。
1.3 试验方法
1.3.1 猕猴桃花、鲜果及腐烂果真菌的分离培养
猕猴桃花、鲜果、腐烂果分别经体积分数75%的酒精消毒,无菌水清洗后,用无菌剪刀将花剪碎成约0.5 cm×0.5 cm的组织块;用灭菌刀片削去鲜果的果皮,果皮剪碎成约0.5 cm×0.5 cm的组织块,再用灭菌镊子挑取一定量的果肉组织;用灭菌刀片削去腐烂果果皮,用灭菌镊子挑取一定量的病变组织;将各组织接种于PDA培养基上,每组重复3次,放置在25℃恒温培养箱中培养数日,挑取不同形态的菌落于新的PDA培养基中培养,重复3次,得到纯化的菌株,将纯化的菌株接种于PDA斜面培养基上于25℃恒温培养箱中培养数日,放于4℃保存备用[9-10]。
1.3.2 形态学鉴定
在载玻片上滴加1滴乳酸酚棉蓝染色液(将20 mL乳酸、20 g苯酚、40 mL甘油、蒸馏水20 mL混匀,再加入50 mg棉蓝),用接种针挑取少量菌落,置于载玻片上的染液中,用接种针分散菌丝。盖上盖玻片,显微镜下观察菌丝和孢子的形态特征。
1.3.3 分子生物学鉴定
用Ezup柱式真菌基因组DNA抽提试剂盒提取试验菌株的总DNA,采用引物ITS1和ITS4扩增rDNA ITS序列,引物序列为ITS1 5'-TCCGTAGGTGAACCTGCGG-3'和ITS4 5'-TCCTCCGCTTATTGATATGC-3'。反应总体积50 μL:2×EsTaqMasterMix 25 μL,DNA 2 μL,ITS1/ITS4各2 μL,ddH2O 19 μL。聚合酶链反应(polymerase chain reaction,PCR)反应条件为94℃预变性5 min,94℃变性1 min,60℃退火30 s,72℃延伸1 min,35个循环,72℃再延伸10 min,最后在4℃停止反应。扩增结束后将PCR产物于1.5%琼脂糖凝胶电泳(100 V),DNA Marker指示分子质量,30 min后在凝胶成像分析仪下检测和照相。PCR产物送上海生工测序。获得的序列递交美国国家生物技术信息中心(national centerofbiotechnologyinformation,NCBI)数据库进行比对。
1.3.4 致病性测定
将腐烂果分离纯化后的菌株按照柯赫氏法则进行回接验证,选取适龄的PDA平板菌落用打孔器制备直径5 mm的菌饼,以刺伤的方式,将菌饼的菌丝面紧贴于表面消过毒的猕猴桃鲜果上,设置直径5 mm的无菌培养基块作对照。接种的猕猴桃放入25℃培养箱中保湿培养,定期观察发病情况并测量病斑直径,根据病斑直径大小判断病菌致病性强弱。无致病性记为“-”,有致病性记为“+”,病斑直径Φ≤5mm、5mm<Φ≤10mm、10mm<Φ≤15mm、15mm<Φ≤20mm和Φ>20mm时,病菌致病性分别用“+、++、+++、++++、+++++”表示,取发病的猕猴桃进行病菌的分离鉴定[11]。
2 结果与分析
2.1 分离真菌的形态学鉴定
本试验从花中分离到6种菌株,分别记为H01、H02、H03、H04、H05、H06。从猕猴桃鲜果果肉中分离到1种菌株,果皮中分离到3种菌株,分别记为X01、X02、X03、X04。从腐烂果中分离到6种菌株,分别记为F01、F02、F03、F04、F05、F06。根据菌落形态、显微形态及相关文献对其进行形态学鉴定,结果见图1~图3。
由图1可知,H01菌落正面白色,菌落背面可由白色变为黄褐色,中心菌丝致密渐变成皮膜状,边缘丝毛状,菌丝多分枝,有内含物或中空,节状分隔很多。根据该真菌的形态特征结合相关文献[12-13],初步鉴定为多孔属。H02菌落白色,绒毛状,菌丝生长旺盛,常多核,少有隔膜,常分枝,无锁状联合。分生孢子为卵形颗粒。根据该真菌的形态特征结合相关文献[14],初步鉴定为平革菌属。H03菌落黄白色,有皱纹,菌落边缘为白色绒毛,背面为黄褐色,分生孢子头球形或半球形,顶囊烧瓶状,分生孢子球形或近球形。根据该真菌的形态特征结合相关文献[15],初步鉴定为曲霉属。H04菌落灰绿色,边缘为白色。菌落背面中心部位呈浅褐色,背面边缘呈黄色,粉状。分生孢子梗发生于基质,顶端分枝呈扫帚状,分生孢子呈球形或近球形。根据该真菌的形态特征结合相关文献[16],初步鉴定为青霉属。H05菌落橄榄绿色,背面黑绿色,平铺状,分生孢子多为单细胞,卵形、近球形、圆柱形,形成分枝的孢子链。根据该真菌的形态特征结合相关文献[8],初步鉴定为枝孢菌属。H06菌落正面呈白色,背面呈黄白色,放射状生长,生成大量气生菌丝,生长迅速。产生大小两种分生孢子,大分生孢子镰刀形,小分生孢子多数单胞,卵形至长圆形,单生,根据该真菌的形态特征结合相关文献[8],初步鉴定为镰刀菌属。

图1 猕猴桃花分离菌的菌落及显微形态Fig.1 Colony and microscopic morphology of strains isolated from kiwi flower
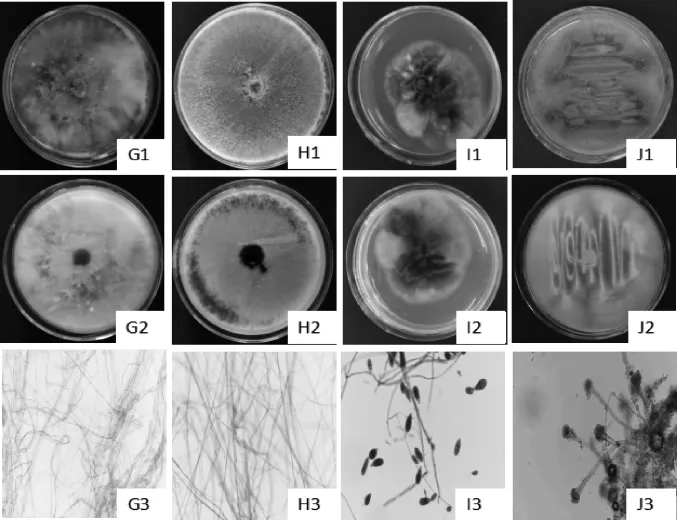
图2 猕猴桃鲜果分离菌的菌落及显微形态Fig.2 Colony and microscopic morphology of strains isolated fromfresh kiwifruit
由图2可知,X01菌落白色,绒毛状,气生菌丝旺盛边缘整齐,背面呈微黄色,菌丝有间隔有分枝,锁状联合明显,菌丝粗细不均。根据该真菌的形态特征结合相关文献[17],初步鉴定为裂褶菌属。X02菌落初期白色,后期变为黑灰色,有同心轮纹,子囊孢子单细胞、暗色。根据该真菌的形态特征结合相关文献[18-19],初步鉴定为轮层炭壳属。X03菌落绒状,产孢子面黑绿色,背面黑色,分生孢子圆形,卵形,倒棍棒形,圆筒形,有纵横隔膜0至多个。根据该真菌的形态特征结合相关文献[8],初步鉴定为链格孢属。X04菌落正面灰绿色,菌落反面呈淡黄色,絮状颗粒,分生孢子梗细长,上部有膨大顶囊,形如烧瓶,分生孢子球形。根据该真菌的形态特征结合相关文献[15],初步鉴定为曲霉属。
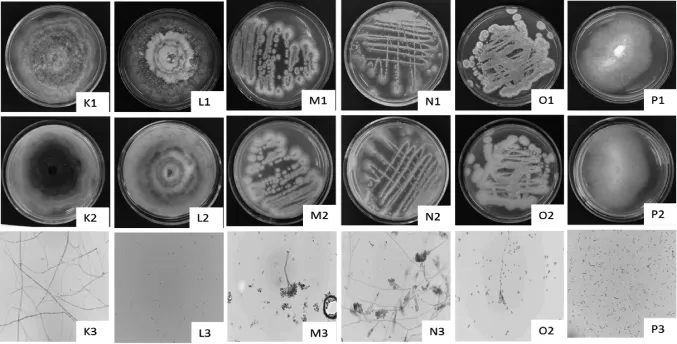
图3 猕猴桃腐烂果分离菌的菌落及显微形态Fig.3 Colony and microscopic morphology of strains isolated fromrotten kiwifruit
由图3可知,F01菌落生长初期菌落正面呈白色,后期呈灰色甚至黑色,菌落背面呈墨绿色,气生菌丝发达,菌丝有隔,根据该真菌的形态特征结合相关文献[20],初步鉴定为小新壳梭孢。F02菌落正面中央为白褐色,背面中央黄褐色,边缘为暗褐色,有轮状生长现象,分生孢子两型,甲型分生孢子单胞,椭圆形或纺缍形,两端各有1个油球;乙型分生孢子丝状、钩状,单孢。根据该真菌的形态特征结合相关文献[8],初步鉴定拟茎点霉菌属。F03菌落绿色,边缘有白色絮状,由图3的N1、N2、N3和O1、O2、O3可见,F04和F05菌落青色,背面黄色,粉状,分生孢子梗直立,顶端1至多次分枝呈扫帚形,分生孢子呈球形或近球形,分生孢子成串呈链状。根据该真菌的形态特征结合相关文献[8,16],初步鉴定为青霉属。F06菌落正面呈白色短绒状,背面为黄白色,菌丝生长迅速,在培养基中产生大量菌丝。大分生孢子呈镰刀形,小分生孢子多数单胞,卵形至长圆形,根据该真菌的形态特征结合相关文献[8],初步鉴定为镰刀菌属。
2.2 rDNA-ITS分子鉴定
以基因组DNA为模板,对上述16株真菌的rDNA ITS序列进行PCR扩增,结果见图4。由图4可知,其PCR反应产物均为单一清晰条带,分子质量大约为500~750 bp。
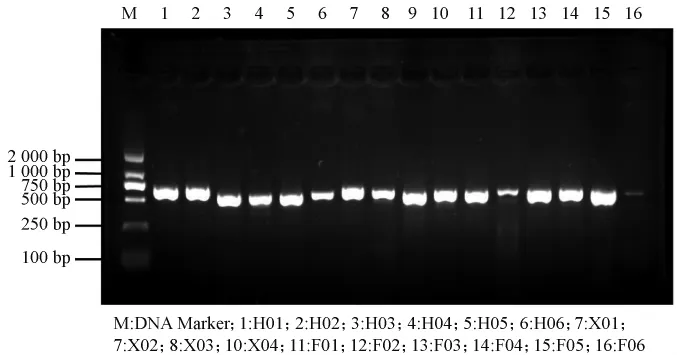
图4 16株真菌的rDNA ITS扩增电泳图Fig.4 rDNA ITS amplification electrophoresis of 16 fungi strains
对PCR产物进行测序,除去引物序列,获得的16株分离真菌的rDNA ITS序列长度分别为574 bp(H01)、584 bp(H02)、482 bp(H03)、470 bp(H04)、474 bp(H05)、479 bp(H06)、553 bp(X01)、505 bp(X02)、479 bp(X03)、518 bp(X04)、501 bp(F01)、495 bp(F02)、508 bp(F03)、507 bp(F04)、509bp(F05)和465bp(F06),菌株序列提交到 NCBI GenBank中注册(注册号:MF491816~MF491831),并与GenBank中已有序列进行同源性比较,结果表明,除了菌株F04和F05,其他菌株分别与漏斗多孔菌(Polyporusarcularius)(KP283489.1)、平革菌属(Phanerochaetesp.)(DQ912697.1)、曲霉属(Aspergillussp.)(KX688043.1)、橘青霉(Penicillium citrinum)(NR_121224.1)、枝孢菌属(Cladosporiumsp.)(KX378909.1)、镰刀菌属(Fusariumsp.)(KT270215.1)、裂褶菌(Schizophyllum commune)(LT217533.1)、蔡氏轮层炭壳菌(Daldinia childiae)(KU683757.1)、链格孢菌(Al ternariasp.)(KY077525.1)、烟曲霉(Aspergillus fumigates)(KX064986.1)、小新壳梭孢菌(Neofusicoccum parvum)(KX871881.1)、拟茎点霉(Phomopsissp.)(AB302243.1)、Penicillium paneum(HQ442339.1)、尖孢镰刀菌(Fusarium oxysporum)(KF889114.1)相似性为99%~100%。根据相似序列搜索结果,提取相似性高的已知菌株的ITS区基因序列,与试验菌株序列一起用Clustalx1.83软件进行匹配排列,用MEGA6软件以N-J法构建系统发育树,采用1 000次重复的自展检验进化树枝的置信度[21]。构建的系统发育树见图5。
由图5可知,结合分离菌的形态学和分子生物学结果,将菌株H01鉴定为漏斗多孔菌(Polyporus arcularius)、菌株H02为平革菌属(Phanerochaetesp.)、菌株H03为曲霉属(Aspergillussp.)、菌株H04为橘青霉(Penicillium citrinum)、菌株H05为枝孢菌属(Cladosporiumsp.)、菌株H06为镰刀菌属(Fusariumsp.)、菌株X01为裂褶菌(Schizophyllum commune)、菌株X02为蔡氏轮层炭壳菌(Daldinia childiae)、菌株X03为链格孢菌(Alternariasp.)、菌株X04为烟曲霉(Aspergillus fumigates)、菌株F01为小新壳梭孢菌(Neofusicoccum parvum)、菌株F02为拟茎点霉(Phomopsissp.)、菌株F03为Penicillium paneum、菌株F06为尖孢镰刀菌(Fusarium oxysporum)。菌株F04和F05根据形态学及分子生物学可以将其鉴定为青霉属,但是不能鉴定到具体的菌种,具体的鉴定有待进一步验证。
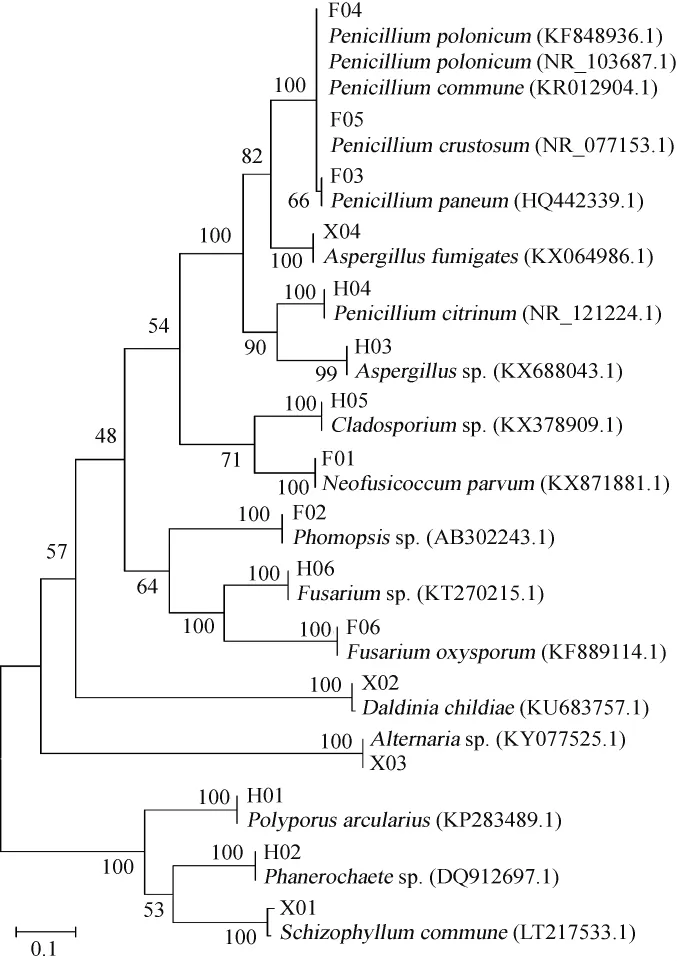
图5 基于ITS-rDNA基因序列真菌的系统发育树Fig.5 Phylogenetic tree of fungi based on ITS-rDNA gene sequence
2.3 致病性测定结果
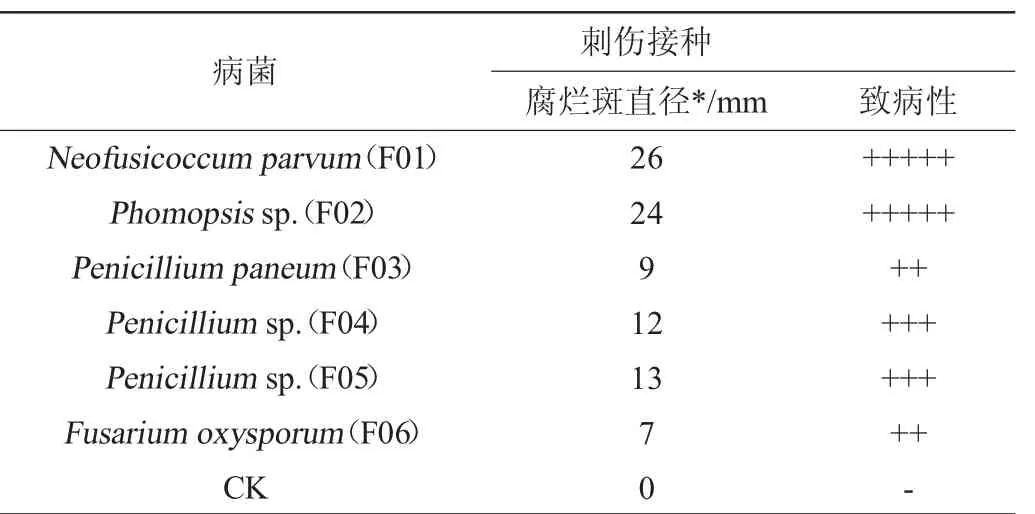
表1 6种真菌分离物接种猕猴桃果实后的致病情况Table 1 Pathogenicity of 6 fungal isolates on fruits of kiwifruit
将猕猴桃腐烂果分离到的病原菌以菌饼的形式刺伤接种于健康的猕猴桃果面,以直径5 mm的无菌培养基块作对照(CK),致病性结果见表1。由表1可知,从猕猴桃腐烂果中分离到的6株真菌均能引起猕猴桃腐烂,其中F01小新壳梭孢菌、F02拟茎点霉具有的致病性最强。对发病的猕猴桃进行再分离,获得了与原接种菌形态特征一致的病菌,符合柯赫氏法则要求。
3 结论
从贵长腐烂猕猴桃中分离出6株菌,鉴定4株菌,分别是小新壳梭孢菌(Neofusicoccum parvum)、拟茎点霉(Phomopsissp.)、Penicillium paneum及尖孢镰刀菌(Fusarium oxysporum),有2株菌鉴定为青霉属(Penicilliumsp.),具体的鉴定有待进一步研究。根据致病性实验结果,认为小新壳梭孢菌和拟茎点霉是导致贵长猕猴桃腐烂的主要病原菌。已有研究报道在贵长猕猴桃的腐烂果中分离到拟茎点霉[9]。小新壳梭孢(Neofusicoccum parvum)曾被认为是葡萄座腔菌(Botryosphaeria parva)的无性阶段Fusicoccum parvum[22]。后有研究者通过形态学和分子生物学建立了一个新属Neofusicoccum,将F.parvum转属重组为该属的模式种[23]。
本研究从猕猴桃花中分离鉴定出6株菌,漏斗多孔菌、平革菌属、曲霉属、橘青霉、枝孢菌属及镰刀菌属;鲜果果肉中分离到1株菌,裂褶菌;鲜果果皮中分离到3株菌,分别为蔡氏轮层炭壳菌、链格孢菌和烟曲霉。花和鲜果中均未分离到引起猕猴桃腐烂的病原菌,由此推测,猕猴桃腐烂果的病原菌没有在花期和鲜果期潜伏存在,猕猴桃病原菌的侵染途径可能主要是通过采收、运输和包装过程中进入猕猴桃内,从而引起猕猴桃的腐烂,病原菌浸染途径的结论与丁爱冬等[8]研究结论一致,但是与王井田等[7]研究结论不同,病原菌侵染途径的不同可能与猕猴桃的品种、生长的环境等有关,需要进行更深入地研究。
[1]王 瑞,曹 森,谢国芳,等.基于主成分分析的出库猕猴桃最佳1-MCP使用浓度研究[J].保鲜与加工,2016,16(4):6-13.
[2]任亚梅,刘兴华,徐春雅,等.不同处理对猕猴桃采后生理和细胞超微结构的影响[J].农业工程学报,2008,24(7):217-221.
[3]HAWTHRONE B T,REID M S.Possibility for fungicidal control of kiwifruit fungal storage rots[J].NZ J Exp Agr,1982,10(3):333-336.
[4]OPGENPORTY D C.Storage rot of California-grown kiwifruit[J].Plant Dis,1983,67(4):382-383.
[5]PENNYCOOK S R.Fungal fruit rots ofActinidia deliciosa(kiwifruit)[J].NZ J Exp Agr,1985,13(4):289-299.
[6]SOMMER N F,SUADI J E.Postharvest disease and storage life of Kiwifruits[J].Postharvest Handling Vegetables,1984(157):295-302.
[7]王井田,刘达富,刘允义,等.猕猴桃果实腐烂病的发病规律及药剂筛选试验[J].浙江林业科技,2013,33(3):55-57.
[8]丁爱冬,于 梁,石蕴莲.猕猴桃采后病害鉴定和侵染规律研究[J].植物病理学报,1995,25(2):149-153.
[9]张 承,李 明,龙友华,等.采前喷施壳聚糖复合膜对猕猴桃软腐病的防控及其保鲜作用[J].食品科学,2016,37(22):274-281.
[10]夏丽娟,张 焜,黄华容,等.5种红树根际土壤真菌和内生真菌的分离及抑菌活性的研究[J].中国农学通报,2014,30(4):259-263.
[11]李 诚,蒋军喜,冷建华,等.奉新县猕猴桃果实腐烂病病原菌分离鉴定[J].江西农业大学学报,2012,34(2):259-263.
[12]王剑锋,李 江,饶 军,等.产漆酶木腐真菌的筛选、鉴定及部分酶学性质[J].食品与发酵工业,2009,35(10):44-48.
[13]冯 璐,戚大伟.基于PCR技术的木材腐朽菌鉴定方法的研究[J].森林工程,2016,32(5):35-39.
[14]GHOBADNEJHAD M,LIU S L,LANGER E,et al.Molecular and morphological evidence reveal a new non-cystidiate species belonging to the corePhanerochaete(Polyporales)[J].Mycol Progr,2015,14(9):1-7.
[15]孙端方,冉雪琴,王嘉福.一株产紫杉醇罗汉松内生真菌的分离和鉴定[J].微生物学报,2008,48(5):589-595.
[16]曹 琳,曹 东,陈存坤,等.鲜剥大蒜中腐败微生物的分离纯化及鉴定[J].中国酿造,2017,36(9):123-126.
[17]骆静怡,傅威锐,潘程远.木腐真菌的鉴定及对不同木材的腐朽能力[J].浙江农林大学学报,2015,32(1):1-10.
[18]肖春萍,杨利民,韩 梅,等.人参主要病原菌生防真菌的筛选及鉴定[J].西北农林科技大学学报:自然科学版,2016,44(7):181-192.
[19]王晓国,卢家仕,周主贵,等.带叶兜兰菌根真菌分离和初步鉴定[J].西南农业学报,2016,29(2):316-320.
[20]袁志林,陈益存,汪阳东.一种新发生的油桐叶枯病病原真菌[J].菌物学报,2011,30(4):658-662.
[21]张美芳,何 玲,张美丽,等.‘秦美’猕猴桃贮藏期病原真菌的鉴定[J].西北农业学报,2015,24(6):132-137.
[22]PENNYCOOK S R,SAMUELS G J.BotryosphaeriaandFusicoccum species associated with ripe fruit rot ofActinidia deliciosa(Kiwifruit)in New Zealand[J].Mycotaxon,1985,24:445-458.
[23]CROUS P W,SLIPPERS B,WINGFIELD M J,et al.Phylogenetic lineages in theBotryosphaeriaceae[J].Stud Mycol,2006,55(55):235-253.
