饲料精氨酸/赖氨酸配比对黄颡鱼生长及消化性能的影响
2018-03-27邱其浚孙龙生杨家威陈耀宇
沈 勇,邱其浚,孙龙生,杨家威,陈耀宇,金 磊
(扬州大学 动物科学与技术学院,江苏 扬州 225001)
鱼类对饲料的消化其实质是消化道酶的分泌与反应过程,消化酶活性的高低直接影响鱼类对营养物质的吸收和利用,其受多种因素调节,与饲料营养成分关系密切[1]。Fountoulaki等[2]在金头鲷(Sparusaurata)研究中表明,饲料组成不同会对金头鲷的饲料表观消化率及消化酶活性产生影响。Kenan[3]认为,饲料蛋白及脂肪水平不同,均会影响其蛋白吸收效率及生长性能。目前已有报道认为饲料养分影响瓦氏黄颡鱼(Pseudobagrusvachelli)消化酶活性[4]。精氨酸、赖氨酸为鱼体必需氨基酸,二者又同为碱性氨基酸,共用转运载体,它们之间的吸收关系一直是营养研究者关注的热点。有关饲料精氨酸、赖氨酸关系在中华鳖(Trionyxsinensis)、大菱鲆(Scophthalmusmaximus)、黑鲷(Nigrumsparus)的生长及养分利用的影响已有研究[5-7],而在全雄黄颡鱼上鲜有报道。本试验就饲料精氨酸/赖氨酸不同配比对全雄黄颡鱼消化酶活及饲料表观消化率进行研究,探讨全雄黄颡鱼的消化生理特性,为科学配制全雄黄颡鱼饲料提供依据。
1 材料与方法
1.1 试验设计与饲料配制
试验饲料以面粉、鱼粉、豆粕、菜粕、麸皮、预混料为原料,以豆油、大豆卵磷脂为主要脂肪源,再在各组中添加晶体精氨酸、赖氨酸,以甘氨酸作为等氮替代物,将饲料配制成8组精氨酸、赖氨酸水平(配比)不同的等氮等脂饲料。以2.19/2.61组为对照组(2.19/2.61组);1.74/2.08组精氨酸、赖氨酸水平均低于对照组20%(1.74/2.08组);1.75/3.02组精氨酸低于对照组20%,赖氨酸高于对照组20%(1.75/3.02组);2.63/2.08组精氨酸高于对照组20%,赖氨酸低于对照组20%(2.63/2.08组);2.64/3.12组精氨酸、赖氨酸均高于对照组20%(2.64/3.12组);3.07/2.61组精氨酸高于对照组40%,赖氨酸不变(3.07/2.61组);2.19/3.65组精氨酸不变,赖氨酸高于对照组40%(2.19/3.65组);3.08/3.65组精氨酸、赖氨酸均高于对照组40%(3.08/3.65组)。

表1 试验饲料组成及营养水平(风干基础) %
注:1.每千克预混料提供VA500 000 IU,VD340 000 IU、VE10 000 IU、VK32 000 mg、VB12000 mg、VB23000 mg、VB61600 mg、VB12100 mg、烟酸 3.2 g、泛酸 8 g、叶酸 600 mg、肌醇 40 g、VC24 g、胆碱 400 g、铁 8 g、铜 4 g、锌 5 g、锰 1 g、镁 7 g、硒 20 mg、碘 200 mg.2.营养指标均为实测值.
饲料原料经粉碎、过筛后,按照饲料配方进行配制。用F-26型颗粒饲料挤条机加工成粒径为2 mm硬颗粒饲料,自然晾干后,破碎、过筛,冰箱中-20 ℃保存备用。
1.2 试验动物与饲养管理
全雄黄颡鱼购自扬州市董氏特种水产有限公司,增氧运输至养殖温室,暂养。挑选体质健壮、反应敏捷、平均体质量为(2.34±0.05) g的幼鱼960尾,随机分成8组,每组4个重复,每个重复30尾,分别放养于200 L圆形水族箱中。每日6:00和16:00投喂至表观饱食,记录投饵量。试验采用微循环流水,全程遮光,间隙式增氧,溶氧维持在5 mg/L以上;温度控制在24~28 ℃。试验分预试期和正试期。
1.3 样品采集与处理
试验鱼粪便采用虹吸法收集。每日12:00收集鱼粪,烘箱(65 ℃)烘干,装入自封袋于冰箱中保存备用。
试验结束,将试验鱼饥饿24 h后,每个重复随机挑选2尾鱼置于冰盘解剖,分别采集肝胰腺、肠和胃,去除内容物,装入已编号的离心管,迅速置于液氮中速冻后,再转移样品至冰箱-80 ℃保存,以备消化酶活性测定。
1.4 测定指标与方法
1.4.1 生长指标的测定
m0=m1/n1
m2=m3/n2
m4=m2-m0
质量增加率/%= (m2-m0)/m0×100%
饲料系数=m5/m4
存活率/%=n2/n1×100%
式中,m0为初始体质量(g),m1为试验前鱼体总质量(g),m2为试验鱼终末体质量(g),m3为试验后鱼体总质量(g),m4为鱼的增加质量(g),m5为试验鱼采食饲料质量(g),n1为初始尾数,n2为试验鱼存活尾数。
1.4.2 消化酶活性测定
各组织样品分析前于冰上解冻、称量,用预冷的去离子水按1∶9质量体积比稀释、匀浆,将匀浆液在4 ℃,8000 r/min离心10 min,上清液即为粗酶液。
各组织蛋白、脂肪酶、胰蛋白酶、淀粉酶和胃蛋白酶活性均采用南京建成生物工程研究所生产的试剂盒测定。
组织胰蛋白酶单位定义:在pH8.0,37 ℃条件下,每毫克的蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003即为1个酶活力单位。
组织脂肪酶单位定义:在37 ℃条件下,每克组织蛋白在本反应体系中与底物反应1 min,每消耗1 μmol底物为1个酶活力单位。
组织淀粉酶单位定义:组织中每毫克蛋白于37 ℃下与底物作用30 min,水解10 mg淀粉定义为1个酶活力单位。
组织胃蛋白酶单位定义:每毫克组织蛋白于37 ℃下每分钟分解蛋白生成1 μg氨基酸定义为1个酶活力单位(1个酶活力单位=1 μg酪氨酸/min·mg)。
1.4.3 表观消化率的测定
本试验采用内源指示剂法,盐酸不溶灰分的测定参照GB/T23742—2009。考虑到每个重复收集粪样较少,故将4个重复的粪样混合均匀后再进行检测。
消化率/%={1-[(N1/N2)×(A2/A1)]}×100%
式中,N1、N2分别为粪便中某养分含量和饲料中某养分含量,包括:干物质(DM)、能量、粗蛋白(CP)、粗脂肪(EE)及氨基酸(AA)等;A1、A2分别为粪样中盐酸不溶灰分含量和饲料盐酸不溶灰分含量(以风干质量计)。
1.5 数据统计与分析
用Excel整理数据,统计分析采用SPSS 18.0软件包进行方差分析,多重比较采用Duncan法,显著水平为0.05,表中同行数据上标不同表示差异显著。试验结果表示为平均值±标准差。
2 结果与分析
2.1 饲料精氨酸/赖氨酸配比对全雄黄颡鱼生长性能的影响
饲料精氨酸/赖氨酸配比对全雄黄颡鱼生长性能影响的结果见表2。由表2可知,各组存活率无显著差异。质量增加率在3.07/2.61组达到最大,除2.64/3.12组外,显著高于其他各组(P<0.05),终末体质量、质量增加率也在3.07/2.61组最大,与2.63/2.08组、2.64/3.12组差异不显著外,显著高于其他各组;1.74/2.08组最低,显著低于2.64/3.12组、3.07/2.61组(P<0.05),其他各组间差异均不显著(P>0.05)。1.74/2.08组饲料系数显著高于其他各组(P<0.05),其他各组无显著差异(P>0.05)。
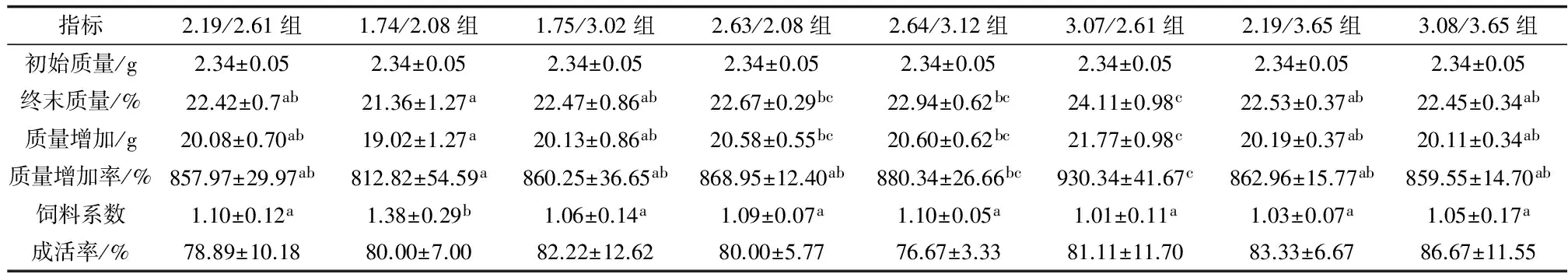
表2 饲料精氨酸/赖氨酸水平对全雄黄颡鱼生长及饲料利用的影响
注:表中同一行不同小写字母表示各组间有显著差异(P<0.05),下同.
2.2 饲料精氨酸/赖氨酸配比对全雄黄颡鱼消化道不同组织消化酶活性的影响
饲料精氨酸/赖氨酸配比对全雄黄颡鱼肝、胃组织的脂肪酶活性无显著差异,而肠组织的脂肪酶活性有显著差异,其中第Ⅷ组脂肪酶活性最高,显著高于第2.19/2.61组、1.74/2.08组和1.75/3.02组(P<0.05);2.19/2.61组、1.74/2.08组最低,除与1.75/3.02差异不显著外,显著低于其他各组(P<0.05)(表3)。

表3 饲料精氨酸/赖氨酸配比对全雄黄颡鱼消化道不同组织消化酶活性的影响
饲料精氨酸/赖氨酸配比对全雄黄颡鱼肝、肠组织胰蛋白酶活性有显著差异。肝组织中,2.19/2.61组胰蛋白酶活性最高,显著高于3.07/2.61组、2.19/3.65组和3.08/3.65组(P<0.05);2.19/3.65组除与3.07/2.61组、3.08/3.65组差异不显著外,显著低于其他各组(P<0.05)。肠组织中,2.19/2.61组胰蛋白酶活性最高,除与1.74/2.08组、1.75/3.02组差异不显著外,显著高于其他各组(P<0.05),2.63/2.08组显著高于2.64/3.12组、3.07/2.61组、3.08/3.65组(P<0.05),其余各组差异不显著。而饲料精氨酸/赖氨酸配比对全雄黄颡鱼胃组织胰蛋白酶活性差异不显著。饲料精氨酸/赖氨酸配比对全雄黄颡鱼胃组织胃蛋白酶活性有显著差异。1.74/2.08组胃蛋白酶活性最高,3.08/3.65组胃蛋白酶活性最低。1.74/2.08组、1.75/3.02组、2.63/2.08组显著高于2.19/2.61组、2.64/3.12组、3.07/2.61组、2.19/3.65组、3.08/3.65组(P<0.05)。
精氨酸/赖氨酸配比对全雄黄颡鱼肝组织淀粉酶活性无显著差异,而在肠、胃组织中淀粉酶活性有显著差异(P<0.05)。肠组织中,2.64/3.12组淀粉酶活性最高,1.74/2.08组淀粉酶活性最低,且2.64/3.12组、2.19/3.65组、3.08/3.65组显著高于1.74/2.08组、1.75/3.02组、3.07/2.61组(P<0.05)。胃组织中,2.64/3.12组淀粉酶活性最高,1.74/2.08组淀粉酶活性最低,2.64/3.12组显著高于1.74/2.08组、2.19/3.65组(P<0.05)。
2.3 饲料精氨酸/赖氨酸配比对全雄黄颡鱼饲料表观消化率的影响
精氨酸/赖氨酸对全雄黄颡鱼饲料养分及氨基酸的表观消化率测定结果见表4。由表4可知,干物质消化率为62.02%~76.51 %,1.74/2.08~3.07/2.61组较高;蛋白质消化率为84.06%~91.42%,1.75/3.02~3.07/2.61较高;脂肪消化率为85.22%~94.10%,1.74/2.08组较低,其各组差异较小;能量消化率为68.15%~80.99%,2.63/2.08组最高,其他各组差异较小;精氨酸消化率为84.83%~95.01%,1.75/3.02组~3.08/3.65组较高;赖氨酸、总氨基酸各组消化率均较高,分别为91.97%~96.66%和92.80%~96.97%。

表4 饲料精氨酸/赖氨酸配比对黄颡鱼饲料表观消化率的影响 %
3 讨 论
3.1 饲料精氨酸/赖氨酸配比对全雄黄颡鱼生长性能的影响
精氨酸、赖氨酸为水生动物必需氨基酸,与鱼类生长关系密切。饲料中二者的含量以及配比均能严重影响鱼的生长,主要原因是二者含量的过高或者过低以及二者之间不均衡的配比,均会引起饲料中营养物质的失衡,从而导致体内营养物质进行能量代谢[8]。本试验中,精氨酸、赖氨酸添加量均低于全雄黄颡鱼的需要量时,不仅严重影响其生长性能,还降低饲料转化率。而提升饲料精氨酸、赖氨酸水平,或者精氨酸/赖氨酸比值约为1.20时,其生长性能均有不同程度的好转。说明精氨酸、赖氨酸的水平添加至适宜水平且当二者比值(精氨酸/赖氨酸)达到适宜比值时,对全雄黄颡鱼的生长具有促进作用。但当饲料中赖氨酸添加过量时,反而会抑制其生长,在克氏原螯虾(Procambarusclarkii)[9]、日本鲈鱼(Lateolabraxjaponicus)[10]研究中均有类似发现。主要是因为过量的赖氨酸引起饲料中氨基酸的不平衡,加重鱼类多余氨基酸的脱氨基作用,含氮部分以氨、尿素和三甲胺等形式排出体外,不含氮部分分解成水和二氧化碳,以能量形式释放,从而影响其生长[11]。
3.2 饲料精氨酸/赖氨酸配比对全雄黄颡鱼消化道组织酶活性的影响
鱼类通过适应饲料的变化来调整消化酶的活性及分泌[12],鱼类消化酶活性与饲料种类和质量有关。蛋白酶是水解蛋白质肽链的一类酶的总称,鱼类各组织分泌不同的蛋白酶。鱼胃部可分泌胃蛋白酶,肝胰脏分泌的蛋白酶种类最多,鱼类肠道中蛋白酶的来源主要来自肝脏[13]。胰蛋白酶为蛋白酶的一种,在体内不仅起消化酶作用,而且还能限制分解糜蛋白酶原、羧肽酶原、磷脂酶原等其他酶的前体,起活化作用,是特异性最强的蛋白酶。Lee等[14]报道,大菱鲆对蛋白质的消化主要集中在肠道与幽门盲囊,这与本试验肠道蛋白酶活性远高于肝、胃组织的研究结果一致。除此之外,胰蛋白酶能将多肽链中赖氨酸和精氨酸残基中的羧基侧切断。张微微等[9]认为,克氏原螯虾饲料中赖氨酸适宜水平能够提高肠道蛋白酶的活性,过高赖氨酸水平对肠道消化酶活性进行抑制。王际英等[15]在仿刺参(Apostichopusjaponicus)的研究中表明,饲料中高精氨酸水平会降低各组织蛋白酶活性。在半滑舌鳎(Cynoglossussemilaevis)的研究中也有类似现象,胰蛋白酶活力随着氨基酸水平的升高而显著下降[16]。因此饲料中精氨酸、赖氨酸水平对消化道组织胰蛋白酶活性有重要影响。本试验中,饲料精氨酸/赖氨酸对全雄黄颡鱼肝、肠组织中胰蛋白酶及胃组织中胃蛋白酶活性影响呈现相同趋势,当饲料中精氨酸/赖氨酸比值相同时,提高精氨酸、赖氨酸水平,发现各组织胰蛋白酶活性均有不同程度的降低。而当饲料精氨酸/赖氨酸配比不同时,胰蛋白酶活力随着精氨酸/赖氨酸比值的升高,呈先升后降的趋势,但并无显著影响,可能是因为高水平的精氨酸、赖氨酸二者之间产生了拮抗作用。有关精氨酸、赖氨酸对鱼体消化道组织酶活性机理的影响还需做进一步研究。饲料精氨酸/赖氨酸不同配比对各组全雄黄颡鱼胃组织中总蛋白以及胰蛋白酶活性无显著影响,主要是因为胰蛋白酶在中性和弱碱性条件下有较强的活性[7],而胃内处于极酸环境,因此并未在胃中表现出差异。
脂肪酶属于羧基酯水解酶类,饲料中脂肪在脂肪酶的作用下,分解成甘油和自由脂肪酸的混合物,再被鱼类吸收。Fountoulaki等[2]在金头鲷的研究中发现,消化道组织脂肪酶活性与饲料脂肪含量相关。而在建鲤(CyprinuscarpiovarJian)稚鱼、宝石鲈(Scortumbacoo)、匙吻鲟(Polyodonspathula)的研究中表明,饲料蛋白水平对鱼类消化道组织脂肪酶活性影响均不显著[17-19]。在水产动物氨基酸需要量的研究中也未发现,赖氨酸、精氨酸对水产动物的肝脏有影响[9,15]。本试验中,肝组织脂肪酶活性最低,且饲料精氨酸/赖氨酸不同配比对全雄黄颡鱼肝、胃组织并未产生显著影响。而当饲料中精氨酸/赖氨酸比值相同时,除比值为1.20(2.63/2.08组、3.07/2.61组)外,肠道脂肪酶活性随着饲料精氨酸、赖氨酸水平的提高而逐渐升高,且主要受赖氨酸影响显著。主要原因为赖氨酸是左旋肉碱的前身,为长链脂肪酸活化后生成的酰基(脂酰CoA)在线粒体中的β-氧化及运输,起着重要作用,有助于体内脂肪的氧化分解。因此饲料中赖氨酸适宜添加水平能够提升肠道脂肪酶活性。本试验中,当精氨酸/赖氨酸配比值为1.20时,降低二者添加水平反而提高其酶活性,并且其酶活性处于较高水平。由此可以看出,精氨酸/赖氨酸适宜配比同样能提升肠道脂肪酶活性。
淀粉酶是水解糖原及淀粉酶类的总称,具有专一性和特异性,且不同消化道组织淀粉酶活性不同。孙翰昌等[20]推测,鱼类肝胰脏可能是淀粉酶的主要分泌器官,而肠道可能是淀粉的主要消化场所。本试验中,淀粉酶在肠道中活性最高,其次是胃,肝组织中酶活性最低,这与李瑾等[21]在中华鲟(Acipensersinensis)研究中结果一致。杨家威等[22]在全雄黄颡鱼摄食前后消化酶活性变化规律的研究中发现,全雄黄颡鱼摄食前后消化道不同消化酶活性存在时序变化和组织差异性,这可能就是造成上述差异的原因。淀粉酶和胰蛋白酶均为反映胰腺外分泌能力的指标,胰腺外分泌功能的发育反映了仔鱼消化系统的成熟程度[23]。胰蛋白酶活力的大小反映了仔鱼胰腺外分泌能力的高低,而淀粉酶恰恰相反,会随着胰腺外分泌的发育而下降[24]。本试验中,当饲料精氨酸、赖氨酸水平较低时,精氨酸/赖氨酸比值越高,淀粉酶活力越强;同时提升二者添加水平,淀粉酶活力也在提升。说明饲料中精氨酸、赖氨酸水平过低,易导致消化系统的早熟。但当精氨酸/赖氨酸比值为1.20或者精氨酸水平过量时,同样能够提升淀粉酶活力,催熟消化系统,可能是饲料精氨酸的水平影响胰腺外分泌功能,但其机理有待进一步研究。
3.3 饲料精氨酸/赖氨酸配比对全雄黄颡鱼饲料表观消化率的影响
饲料的营养价值不仅取决于营养成分含量,还取决于动物对营养物质的消化、吸收和利用率[25]。影响鱼类饲料消化、吸收利用的因素有很多[26]。本试验以鱼粉为主要蛋白源,豆油、大豆卵磷脂为主要脂肪源,各指标的研究结果与团头鲂(Megalobramaamblycephala)、中华绒螯蟹(Eriocheirsinensis)、凡纳滨对虾(Litopenaeusvannamei)对不同饲料表观消化率的研究结果相近[27-29]。除了饲料原料不同对鱼饲料表观消化率有影响外,饲料中氨基酸的添加水平以及饲料氨基酸平衡性对鱼表观消化率的吸收也有影响。王爱民等[30]用氨基酸平衡的饲料饲养异育银鲫(Garssiusauratusgibelio),测定饲料中各养分的利用率发现,氨基酸平衡组的各养分利用率均比对照组高,表明饲料中必需氨基酸越接近平衡状态,养殖动物对饲料中蛋白质的利用率就越高。于海瑞等[31]研究表明,饲料中添加微囊赖氨酸显著提高了饲料蛋白质的消化率。本试验中,饲料精氨酸/赖氨酸配比不同,全雄黄颡鱼饲料表观消化率存在差异。饲料干物质、蛋白质、脂肪、能量的消化率趋势相近,受饲料中精氨酸、赖氨酸添加水平的影响,当精氨酸水平为2.63%时,饲料表观消化率均较高,这与各组织消化酶活性结果一致。各组饲料氨基酸表观消化率均较高,且与饲料蛋白表观消化率趋势一致,该结果与董晓慧等[32]在吉富罗非鱼(GIFTOreochromisniloticus)的研究结果类似。理论上鱼类采食晶体氨基酸后能够在消化道被直接吸收,推测氨基酸消化率受饲料氨基酸添加水平的影响较小,于海瑞等[31]以及本试验的结果也能证明这一点。有关氨基酸利用效果的评价最好采用氨基酸在体组织中的沉积率等生物利用率指标来衡量。
4 结 论
饲料精氨酸/赖氨酸不同配比会影响全雄黄颡鱼消化酶活性特别是蛋白酶活性,并影响饲料养分的消化利用。从消化生理方面考虑,建议全雄黄颡鱼饲料精氨酸/赖氨酸适宜比为1.20,本试验中适宜配比为2.63/2.08。
[1] 李军,吴天星.鱼类消化酶活性的影响因素[J],水利渔业,2006,26(6):4-6.
[2] Fountoulaki E,Alexis M N,Nengas L,et al.Effect of diet composition on nutrient digestibility and digestive enzyme levels of gilthead sea bream (SparusaurataL.) [J].Aquaculture Research,2005(13):1243-1251.
[3] Kenan K.Effects of dietary protein and lipid levels on growth,feed utilization and body composition of juvenile grass carp (Ctenopharyngodonidella) [J].Journal of Fisheries Sciences,2012,6(3):243-251.
[4] 封福鲜.精氨酸、赖氨酸和苏氨酸对瓦氏黄颡鱼幼鱼生长、代谢及免疫力的影响[D].青岛:中国海洋大学,2011.
[5] 周小秋,杨凤,周安国,等.鳖赖氨酸和精氨酸拮抗研究[J].四川农业大学学报,2003,21(2):157-160.
[6] 代伟伟,麦康森,徐玮,等.饲料中赖氨酸和精氨酸含量对大菱鲆幼鱼生长、体成分和肌肉氨基酸含量的影响[J].水产学报,2015,39(6):876-887.
[7] Zhou F,Shao Q J,Xiao J X et,al.Effects of dietary arginine and lysine levels on growth performance,nutrient utilization and tissue biochemical profile of black sea bream,Acanthopagrusschlegelii,fingerlings[J].Aquaculture,2011,319(1):72-80.
[8] Langer H,Guilhume J,Metailer R,et al.Augmentation of protein synthesis and degradation by poor dietary amino acid balance in European sea bassDicentrarchuslabrax[J].Journal of Nutrition,1993(123):1754-1761.
[9] 张微微,徐维娜,王莹,等.饲料中赖氨酸水平对克氏原螯虾生长、体组成与消化酶活性的影响[J].中国水产科学,2013,43(2):402-410.
[10] Mai K S,Zhang L,Ai Q H,et al.Dietary lysine requirement of juvenile Japanese seabass,Lateolabraxjaponicas[J].Aquaculture,2006,258(1):535-542.
[11] Berge G E,Sveier H,Lied E.Nutrition of Atlantic salomon (Salmosalar).The requirement and metabolic effect of lysine[J].Comparative Physiology and Biochemistry,1998,120(3):477-485.
[12] 刘扬,周小秋,叶成远,等.鱼类消化酶活性的影响因素[J].饲料广角,2004(18):37-38.
[13] 周凡.饲料赖氨酸和精氨酸对黑鲷幼鱼生长影响及其拮抗作用机理研究[D].杭州:浙江大学,2011.
[14] Lee J K,Cho S H,Su P,et al.Dietary protein requirement for young turbot (ScophthalmusmaximasL.)[J].Aquaculture Nutrition,2003,9(4):283-286.
[15] 王际英,李宝山,张德瑞,等.饲料中添加精氨酸对仿刺参幼参生长、免疫能力及消化酶活性的影响[J].水产学报,2015,39(3):410-420.
[16] 张珊.晶体氨基酸与水解鱼蛋白对半滑舌鳎稚鱼的生长、消化酶活力及PepT1基因表达的影响[D].青岛:中国海洋大学,2013.
[17] Yong L,Lin F,Jun J,et al.Effects of dietary protein levels on the growth performance,digestive capacity and amino acid metabolism of juvenile Jian carp (Cyprinuscarpiovar.Jian)[J].Aquaculture Research,2010,40(9):1073-1082.
[18] 邵庆均,苏小凤,许梓荣.饲料蛋白水平对宝石鲈增重和胃肠道消化酶活性影响[J].浙江大学学报:农业与生命科学版,2004,30(5):85-88.
[19] 孙海涛,吉红.饲料蛋白水平对匙吻鲟幼鱼肌肉营养成分及消化酶活力的影响[J].水产科学,2011,30(12):721-725.
[20] 孙翰昌,徐敬明,庞敏.饲料蛋白水平对瓦氏黄颡鱼消化酶活性的影响[J].水生态学杂志,2010,3(2):84-88.
[21] 李瑾,何瑞国,王学东.中华鲟消化系统内消化酶活性分布[J].中国饲料,2002(21):18-20.
[22] 杨家威,孙龙生,蔡春光,等.全雄黄颡鱼摄食前后消化酶活性变化规律的研究[J].饲料工业,2014,35(8):20-24.
[23] Cahu C,Zambonino-Infante J L.Maturation of the pancreatic and intestinal digestive functions in sea bass (Dicentrarchuslabrax): effect of weaning with different protein sources[J].Fish Physiology and Biochemistry,1995,14(6):431-437.
[24] Cahu C,Zambonino-Infante J L.Early weaning of sea bass (Dicentrarchuslabrax) larvae with a compound diet: effect on digestive enzymes[J].Comparative Biochemistry & Physiology Part A Physiology,1994,109(2):213-222.
[25] 韩庆炜,梁萌青,姚宏波,等.鲈鱼对7种饲料原料的表观消化率及其对肝脏、肠道组织结构的影响[J].渔业科学进展,2011,32(1):32-39.
[26] 李军.美国红鱼消化酶活性及饲料原料体外消化率相关性研究[D].杭州:浙江大学,2006.
[27] 姜雪姣,梁丹妮,刘文斌,等.团头鲂对7种饲料的蛋白质、氨基酸及磷的表观消化率[J].中国水产科学,2011,18(1):119-126.
[28] 张璐,陈立侨,洪美玲,等.中华绒螯蟹对11种饲料原料蛋白质和氨基酸的表观消化率[J].水产学报,2007,31(9):116-121.
[29] 王文娟,迟淑艳,谭北平,等.凡纳滨对虾对13种动物性饲料原料营养物质表观消化率的研究[J].动物营养学报,2012,24(12):2402-2414.
[30] 王爱民,邵荣,刘汉文,等.氨基酸平衡对异育银鲫鱼生长及表观消化率的影响[J].安徽农业科学,2006,34(16):4005-4007.
[31] 于海瑞,张琴,姜燕,等.饲料中补充赖氨酸和蛋氨酸对罗非鱼生长和消化率的影响[J].渔业科学进展,2012,33(4):14-15.
[32] 董晓慧,郭云学,叶继丹,等.吉富罗非鱼幼鱼对10种饲料原料表观消化率的研究[J].动物营养学报,2009,21(3):326-334.
