猪粪厌氧发酵消化液回流体系微生物群落结构特征与产气关系研究
2018-03-26孔德望张克强高文萱梁军锋杜连柱
孔德望,张克强 ,房 芳,高文萱,梁军锋 ,梁 雨,杜连柱*
(1.沈阳农业大学土地与环境学院,沈阳 110866;2.农业部环境保护科研监测所,天津 300191;3.天津环科源环保科技有限公司,天津 300191)
随着我国养殖业集约化、规模化的快速发展,畜禽粪便产量逐年增加,正确处理和利用养殖废弃物已成为养殖业健康良性发展的关键因素。厌氧消化因其工艺相对简单、活性污泥量少而逐渐成为有机废弃物处理的主要技术之一,在畜禽养殖废弃物处理和资源化利用中得到越来越广泛的应用。
厌氧消化性能受温度、pH、有机负荷、回流等众多因素的影响,其中消化液的回流能够减少微生物流失和沼液排放量、提高发酵体系的缓冲能力、缓解沼液后续深度处理的压力[1]。Estevez等[2]研究了消化液回流对牛粪和汽爆过的沙柳混合半连续厌氧发酵的作用,结果表明,1∶1的回流比能够提高沼气中的甲烷含量,同时甲烷产率提高16.0%。吴树彪等[3]在牛粪的厌氧发酵研究中发现,固液分离后的消化液回流使基质的产甲烷率提高16.3%,但随着回流的进行,日产甲烷量呈下降趋势。Nordberg等[4]的研究结果表明,消化液回流能够增加青贮苜蓿厌氧发酵体系的pH、碱度和稳定性。高新星等[5]对比了固体产酸发酵反应器中消化液浸泡和喷淋两种回流方式对猪粪和秸秆混合原料两相厌氧消化性能的影响,发现在消化液浸泡回流方式下累积产气量是喷淋回流的2倍,而且稳定性更好,单位质量总固体产气量可达217.88 mL·g-1。
以往的研究主要针对固液分离后的消化液回流,重点集中在对产气性能的影响,对消化液直接回流及直接回流过程中微生物的群落变化及其与产气之间的关系研究不足。邓遵等[6]研究了ABR反应器出水回流对微生物种群的影响,结果表明,与不回流相比,回流反应器中真细菌、古细菌、产氢产乙酸菌和耗氢产乙酸菌的相对丰度分别高出8.5%、4.5%、3.5%和3.0%。Zamanzadeh等[7]研究了消化液回流对食品废水厌氧消化中微生物的影响,结果表明,中温条件下,回流和不回流体系中优势古菌均为甲烷鬃毛菌属,细菌群落结构存在明显差别,门水平上优势菌分别为厚壁菌门和绿屈挠菌门,而高温条件下的微生物群落则非常相似。
本试验采用实验室猪粪中温厌氧消化连续试验,研究消化液直接回流过程中微生物群落结构组成变化特征,并分析其与产气性能的关系,为优化规模化养殖场大中型沼气工程的运行参数、提高产气效率提供有益参考。
1 材料与方法
1.1 试验材料
猪粪取自天津市西青区某养殖有限公司,取当日产鲜猪粪冷藏于(4±1)℃的冰箱。接种物取自实验室正常运行的有机负荷(OLR)为 4.0 g·L-1·d-1的猪粪中温混合厌氧反应器(Continuous Stirred Tank Reactor,CSTR)。底物与接种物的理化指标见表1。

表1 底物和接种物的基本性质Table 1 Characteristics of substrates and inoculum sludge
1.2 试验装置
试验装置为有机玻璃材质的CSTR反应器,有效容积7 L。反应器顶部安装搅拌装置,设有进料口、排气口,侧部设上下两个取样口,底部设有出料口,反应器采用双层结构,恒温水浴加热(图1)。
1.3 试验设计

图1 厌氧发酵试验装置图Figure 1 Experimental equipment of anaerobic digestion
厌氧发酵的OLR为4.0 g·L-1·d-1(以VS计),水力停留时间(HRT)为30 d。试验启动前,在反应器内装填4 L接种物,加水至7 L。启动阶段,每天排出约233.3 mL的消化液,定量称取猪粪加蒸馏水至约233.3 mL,混匀后填充至反应器。运行稳定后,出料的50%替代蒸馏水进入反应器,回流试验共进行219 d。反应器通过双层水浴加热,保持发酵温度为(35±0.5)℃。试验采取间歇搅拌方式,每搅拌2 h停10 min,转数为 50 r·min-1。
每天测量产气量,每2 d测量气体中CH4和CO2的百分含量,每3 d取消化液分析pH值、挥发性脂肪酸(VFAs,乙酸、丙酸、丁酸和戊酸)、氨氮等指标。取接种物(S0)、试验第 68 d(S1,1~68 d,短期回流)和第219 d(S2,69~219 d,长期回流)消化液样品(重复取样3次)用于微生物群落分析。
1.4 理化指标分析
产生的沼气收集于气袋中,通过湿式气体流量计测量体积,消化液pH、氨氮浓度采用标准方法测定[8],CH4和CO2的百分含量及VFAs浓度采用前期试验[9]的处理及分析方法。
1.5 Miseq高通量测序分析
1.5.1 样品DNA提取
样品DNA采用Fast DNAs Spin Kit(Mpbio,美国)试剂盒提取,S0、S1和S2的重复样品(3个)分别提取DNA,利用1%琼脂糖凝胶电泳检测基因组DNA的完整性,通过超微量分光光度计(Nano Drop 2000,Thermo Scientific,Wilmington,美国)测定浓度,然后将提取的DNA混匀。
1.5.2 PCR扩增
细菌扩增引物为341F(5′-CCTACACGACGCTCT TCCGATCTG(barcode)CCTACGGGNGGCWGCAG-3′)和 805R(5′-GACTGGAGTTCCTTGGCACCCGAGAATT CCAGACTACHVGGGTATCTAATCC-3′),产甲烷古菌扩增引物为 349F[5′-CCCTACACGACGCTCTTCCG ATCTN(barcode)GYGCASCAGKCGMGAAW-3′]和806R(5′-GACTGGAGTTCCTTGGCACCCGAGAATTC CAGGACTACVSGGGTATCTAAT-3′)[10]。采用 PCR 仪(C100 Thermal Cycler)对样品16S rDNA基因进行PCR扩增,扩增反应体系及条件参照文献[11-12],对PCR产物进行琼脂糖电泳,采用生工琼脂糖回收试剂盒(Cat:SK8131)对 PCR 产物进行回收,回收产物用Qubit 2.0定量。
1.5.3 Miseq测序
样品送生工生物工程(上海)股份有限公司,测序平台为Miseq 2x300,测序后的DNA序列进行拼接,通过barcode标签序列区分样品序列,采用Prinseq(0.20.4)对样本序列做质量控制,在QIIME中调用Uclust(1.1.579)软件,设置97%相似性,对有效DNA序列数据进行操作分类单元(OTU)分类,采用RDP软件比对Silva数据库进行物种分类,在门、纲、目、科和属分类水平上统计样本的物种丰度。采用Mothur软件计算种群丰富度指数(Chao指数、ACE指数)和群落多样性指数(Shannon指数和Simpson指数)。
2 结果与讨论
2.1 沼气发酵性能参数
表2为厌氧发酵在短期长期回流下沼气产率、氨氮浓度、乙酸浓度、pH值等参数的平均值。由表可见,消化液回流的平均VS产气率由409 mL·g-1升高到477 mL·g-1,氨氮、乙酸的平均浓度和pH值也明显升高,但沼气中的CH4百分含量有所降低。
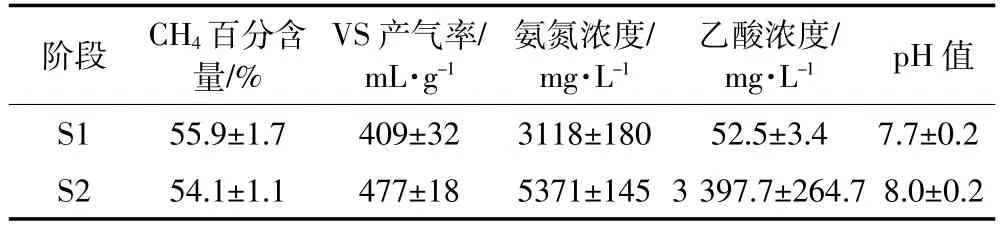
表2 沼气产率及反应器关键指标Table 2 Variations of biogas yield and key factors
2.2 微生物群落多样性分析
在OTUs(操作分类单位)为97%的相似性水平下,对厌氧消化过程中细菌和古菌微生物群落多样性进行分析比较(图2、图3和表3)。由图2和图3可知,尽管细菌和古菌的稀释曲线未达到平坦状态,但Shannon指数曲线随着序列数的增加迅速趋于平坦,表明测序数量能够反映样品中绝大多数微生物信息[11]。从图2稀释曲线和表3中Chao和ACE指数可知,随着消化时间的延长,厌氧发酵体系中细菌和古菌群落的丰富度均有所提高,细菌的丰富度增加幅度明显高于古菌。
表征微生物群落多样性的Shannon指数变化趋势与Chao、ACE指数相似,随着发酵的进行呈升高趋势,表明细菌群落多样性增加,群落的复杂程度升高,而古菌的Shannon指数基本没有变化,表明长期消化液回流对古菌群落的多样性和复杂程度影响不大。厌氧发酵体系中,微生物群落多样性越高产沼气性能越好,虽然S2中产甲烷古菌的多样性没有明显增加,但细菌多样性提高了16.1%,从而导致了沼气产率的提升。
Simpson指数体现了优势物种生物量占群落生物总量的比重,该指数越大表明优势菌群生物量占总生物量比重越小,反之则优势菌群生物量占总生物量比重越大[12]。与Shannon指数不同,随着厌氧发酵的进行细菌的Simpson指数降低,而产甲烷古菌的升高,表明细菌优势菌群的生物量占总生物量的比例增大,古菌优势菌群的占比减小。

图2 细菌和古菌的稀释曲线Figure 2 Rarefaction curves of bacteria and archaeal communities

图3 细菌和古菌的Shannon指数曲线Figure 3 Shannon index curves of bacteria and archaeal communities

表3 发酵过程中微生物丰富度和多样性变化Table 3 Richness and diversity of microbial communities during digestion
综合各指数可以看出,与产甲烷古菌相比,厌氧发酵体系中的细菌具有更高的微生物种群丰富度和多样性,与已有研究报道相一致,这主要是由细菌和产甲烷古菌遗传发育的多样性差异造成的[13]。
2.3 细菌群落结构变化
不同发酵时期样品中细菌群落在门、纲和属的分类水平见图4。由图4a可知,细菌主要属于8个门,其中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为主要的优势菌群,在S0、S1和S2中的相对丰度分别为62.79%、71.66%、81.46%和 19.39%、20.32%、6.74%;其次是变形菌门(Proteobacteria)和无壁菌门(Tenericutes),相对丰度分别为 2.59%、1.84%、3.23%和0.04%、0.11%和1.96%;未分类菌门则为12.75%、3.41%和3.36%。
厚壁菌门是厌氧发酵水解酸化阶段最优势的细菌类群,能够产生降解复杂有机物的纤维素酶、蛋白酶和各种胞外水解酶,在高浓度氨氮的厌氧消化体系中,很多已知的同型乙酸氧化(SAO)菌属于该门类微生物[14-15]。Sundberg等[16]的研究结果显示,在餐厨和屠宰场等废弃物的中温混合厌氧发酵中,厚壁菌门的相对丰度达到83%。Li等[14]对我国12个以猪场粪污为原料的厌氧沼气工程微生物分析结果显示,厚壁菌门的平均丰度为63.73%,其在5个沼气工程中占绝对优势,平均丰度达到78.44%,另外,牛场和猪场废弃物厌氧消化中,游离氨与厚壁菌门成显著正相关。试验中不同阶段厚壁菌门均占绝对优势,而且随着回流时间的延长其相对丰度逐渐升高,达到81.46%,这可能与体系中氨氮浓度逐渐升高有关。拟杆菌门和变形菌门是污泥水解和产酸的主要菌。试验中,发酵液长期回流对拟杆菌门细菌影响明显,相对丰度从初期的20%左右降至219 d时的6.74%,而变形菌门和无壁菌门变化较小。
属于厚壁菌门(Firmicutes)的梭菌纲(Clostridia)包含数量众多的微生物,具有降解蛋白、脂肪和碳水化合物等多种物质的功能,同时能够将乙酸和乳酸转化为H2和CO2[17-18]。试验中,梭菌纲在不同时期均占明显优势,占比分别为58.62%、65.60%和68.19%(图4b),相对丰度逐渐升高,表明该种群在水解酸化过程中较其他纲微生物具有更强的竞争力,同时反映出消化液回流的厌氧消化系统中梭菌纲与氢营养型甲烷菌的互养关系占主导,并呈加强趋势[18]。另一种优势微生物为拟杆菌纲(Bacteroidia),占比分别为2.45%、4.31%和4.92%。其他主要微生物相对丰度几乎均呈升高趋势,但不大于3.88%。
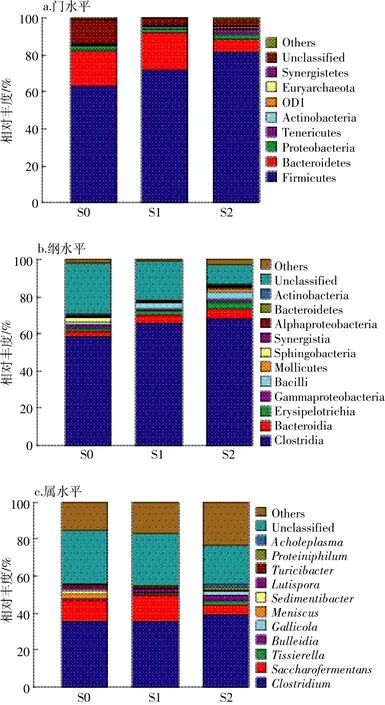
图4 细菌群落结构变化Figure 4 Variation of bacteria communities structure
图4c为属分类水平上细菌群落结构,虽然大量的细菌序列未能分类,但属水平上的群落结构仍能提供反应器中微生物群落功能的重要信息[18-19]。由图可知,相对丰度高于1.00%的细菌基本属于厚壁菌门、梭菌纲,以梭菌属(Clostridium)为优势菌属,相对丰度由S0的35.44%经S1的35.77%升高至S2的39.10%,与日平均产气率的变化一致,表明日平均产气率与梭菌属的丰度呈正相关。第二优势菌属为具有纤维素降解能力的Saccharofermentans,相对丰度从11.64%经13.9%下降到5.25%。未分类的细菌在各个阶段的相对含量分别为28.57%、27.43%和20.66%,表明还存在较多的细菌尚未被分类,需要更深入的研究和挖掘。
2.4 古菌群落结构变化
图5为消化液回流不同阶段产甲烷古菌在门、纲、目、科和属水平上的群落结构。由图5a可知,在S0、S1和S2中,产甲烷菌在门水平上非常单一,广古菌门(Euryarchaeota)占绝对优势,其相对丰度分别为94.76%、99.89%和 99.59%,泉古菌门(Crenarchaeota)则只占4.40%、0.08%和0.11%。纲水平上(图5b)甲烷微菌纲(Methanomicrobia)和甲烷杆菌纲(Methanobacteria)是优势微生物,但随消化液回流时间的延长表现出不同的变化规律,甲烷微菌纲由S0的53.35%升高至S1和S2的56.97%和78.09%,而甲烷杆菌纲则由S0的38.34%最终下降至S2的16.78%。
目水平上,各产甲烷菌的相对丰度大小表现为甲烷八叠球菌目(Methanosarcinales)>甲烷杆菌目(Methanobacteriales)>甲烷微菌目(Methanomicrobiales),消化过程中,前者处于升高的趋势,中者下降,后者下降,但变化不大,科水平上的古菌相对丰度变化与目水平一致。有研究表明,不同产甲烷菌对体系中有害物质或环境因子具有不同的抵抗能力,高沼气产率下,甲烷八叠球菌目(科)占比高于其他古菌[20-22]。试验中,随着回流时间的延长,虽然对产甲烷微生物具有毒害作用的氨氮的浓度逐渐升高达到5371 mg·L-1,但沼气的VS产率达到477 mg·g-1(表2),这与高氨氮浓度下甲烷八叠球菌科的相对丰度较高有关。

图5 产甲烷古菌群落结构变化Figure 5 Variation of archaeal communities structure
虽然整个发酵过程中产甲烷古菌的多样性差异较小(表3),但在属水平上分类的差异却非常明显(图5e),可分为7个属,其中甲烷八叠球菌属(Methanosarcina)、甲烷短杆菌属(Methanobrevibacter)和甲烷球菌属(Methanosphaera)为优势菌属。甲烷八叠球菌属相对丰度由S0的23.99%依次升高到S1的56.55%和S2的72.28%,而甲烷短杆菌和甲烷球菌属的相对丰度总体呈降低趋势,分别由16.34%、21.71%降低至3.70%、12.93%,表明回流体系的产气率与甲烷八叠球菌属的相对丰度呈正相关,与甲烷短杆菌属和甲烷球菌属呈负相关。其他菌属还包括甲烷鬃毛菌属(Methanosaeta)、甲烷囊菌属(Methanoculleus)、热裸单胞菌属(Thermogymnomonas)、甲烷螺菌属(Methanospirillum)。
作为畜禽粪污厌氧发酵中常见的优势产甲烷菌属,甲烷八叠球菌属是已知的唯一能够利用所有产甲烷途径的菌属,很多文献都将其归结为乙酸营养型产甲烷菌[23-24],然而这需要进一步研究。试验中,随着发酵时间的延长,甲烷八叠球菌属的相对丰度升高,而包括甲烷短杆菌属、甲烷球菌属和甲烷囊菌属(Methanoculleus)等在内的氢营养型产甲烷菌的总占比在S0和S1中基本相同(43.10%和43.14%),在S2中则下降至22.54%,表明在回流初期多种微生物对甲烷产生的贡献相当,随着回流时间的延长,逐渐以甲烷八叠球菌属的代谢为主,其主要原因可能是:(1)接种物取自长期运行的猪粪厌氧消化反应器,经过高浓度氨氮的驯化,具有较高的氨氮耐受浓度;(2)甲烷八叠球菌属对氨氮具有高达7000 mg·L-1的耐受浓度[25],虽然体系中氨氮浓度达到 5371 mg·L-1,但未对甲烷八叠球菌属产生抑制。
值得注意的是,同属乙酸营养型产甲烷菌的甲烷鬃毛菌属和甲烷八叠球菌属在本研究中表现迥然不同,甲烷八叠球菌属占绝对优势,而甲烷鬃毛菌属S0时为24.14%,S1和S2时则低于0.05%,主要原因是甲烷鬃毛菌属对乙酸和氨氮均比甲烷八叠球菌属敏感[22]。甲烷鬃毛菌属只能代谢乙酸,能在低至0.3~1.2 mg·L-1的浓度环境中生长,在 93.7~140.6 mg·L-1的浓度范围内为优势菌属,而甲烷八叠球菌属所需最小乙酸浓度约为 60.1 mg·L-1,在 234.3~468.6 mg·L-1以上时为优势菌属[23,25]。试验中,S1和S2的乙酸浓度分别为 52.5 mg·L-1和 3 397.7 mg·L-1,均不在甲烷鬃毛菌属的最适乙酸浓度内,但是甲烷八叠球菌属在S2时期处于适宜的乙酸浓度内,因此甲烷八叠球菌属表现出更强的竞争力[26]。另外,有机负荷也影响乙酸营养型产甲烷菌。有文献[27]报道,在低有机负荷下甲烷鬃毛菌属占优势,而高有机负荷下甲烷八叠球菌属占优势,本试验 VS 负荷为 4.0 g·L-1·d-1,处在较高水平。
3 结论
(1)在消化液回流过程中,细菌较古菌具有更高的多样性和丰富度,并且随着回流时间的延长有所提高,而产甲烷古菌变化不明显。
(2)消化液回流的不同时期,细菌以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)为主,梭菌属(Clostridium)占绝对优势,古菌以甲烷八叠球菌属(Methanosarcina)为主,且随回流时间的延长,优势更加明显,这与甲烷八叠球菌属具有高的氨氮和乙酸耐受浓度有关。
(3)回流过程中,发酵体系的日平均产气率与梭菌属和甲烷八叠球菌属的相对丰度呈正相关,而与甲烷短杆菌属和甲烷球菌属呈负相关。
(4)在219 d的发酵周期内,回流导致氨氮和挥发性有机酸浓度升高,产气效率维持在较高水平,虽未表现出抑制作用,但长期运行应关注氨氮浓度变化对微生物和产气效率的影响。
[1]Hu Y,Shen F,Yuan H R,et al.Influence of recirculation of liquid fractionofthedigestate(LFD)onmaizestoveranaerobicdigestion[J].Biosystems Engineering,2014,127(1):189-196.
[2]Estevez M M,Sapci Z,Linjordet R,et al.Semi-continuous anaerobic co-digestion of cow manure and steam-exploded Salix with recirculation of liquid digestate[J].Journal of Environmental Management,2014,136(8):9-15.
[3]吴树彪,黎佳茜,李 伟,等.沼液回流对牛粪厌氧发酵产气特性及其动力学的影响[J].农业机械学报,2015,46(10):241-246.WU Shu-biao,LI Jia-qian,LI Wei,et al.Effect of liquid digestate recirculation on biogas production and fermentation kinetics for anaerobic digestion of cattle manure[J].Transactions of the Chinese Society of A-gricultural Machinery,2015,46(10):241-246.
[4]Nordberg A,Jarvis A,Stenberg B,et al.Anaerobic digestion of alfalfa silage with recirculation of process liquid[J].Bioresource Technology,2007,98(1):104-111.
[5]高新星,赵立欣,董保成,等.分离式两相厌氧发酵渗滤液回流对发酵过程影响试验[J].农业工程学报,2011,27(10):266-269.GAO Xin-xing,ZHAO Li-xin,DONG Bao-cheng,et al.Experimental study on effect of separated two-phase anaerobic fermentation leachate recirculation on anaerobic process[J].Transactions of the Chinese Society of Agricultural Engineering,2011,27(10):266-269.
[6]邓 遵,彭剑峰,宋永会,等.出水回流对ABR反应器启动过程中污染物去除效果和微生物种群的影响[J].环境科学学报,2012,32(9):2104-2111.DENG Zun,PENG Jian-feng,SONG Yong-hui,et al.Effect of reflux on population distributions of microorganisms and contaminant removals in start-up of an anaerobic baffled reactor[J].ActaScientiae Circumstantiae,2012,32(9):2104-2111.
[7]Zamanzadeh M,Hagen L H,Svensson K,et al.Anaerobic digestion of food waste effect of recirculation and temperature on performance and microbiology[J].Water Research,2016,96:246-254.
[8]国家环境保护总局.水和废水监测分析方法[M].四版.北京:中国环境科学出版社,2002:211-281.State Environmental Protection Administration.Methods for monitoring and analysis of water and wastewater[M].4th Edition.Beijing:China Environmental Science Press,2002:211-281.
[9]宋香育,张克强,房 芳,等.工艺措施对猪粪秸秆混合厌氧干发酵产气性能的影响[J].农业工程学报,2017,33(11):233-239.SONG Xiang-yu,ZHANG Ke-qiang,FANG Fang,et al.Influences of different technological strategies on performance of anaerobic co-digestion of pig manure with straw in solid-state[J].Transactions of the Chinese Society of Agricultural Engineering,2017,33(11):233-239.
[10]Yang B,Xu H,Wang J F,et al.Bacterial and archaeal community distribution and stabilization of anaerobic sludge in a strengthen circulation anaerobic(SCA)reactor for municipal wastewater treatment[J].Bioresource Technology,2017,244:750-758.
[11]Zhang J,Sun Q L,Zeng Z G,et al.Microbial diversity in the deep-sea sediments of Iheya North and Iheya Ridge,Okinawa Trough[J].Microbiological Research,2015,177(3):43-52.
[12]陈重军,张海芹,汪瑶琪,等.基于高通量测序的ABR厌氧氨氧化反应器各隔室细菌群落特征分析[J].环境科学,2016,37(7):2652-2658.CHEN Chong-jun,ZHANG Hai-qin,WANG Yao-qi,et al.Characteristics of microbial community in each compartment of ABR ANAMMOX reactor based on high-throughput sequencing[J].Environmental Science,2016,37(7):2652-2658.
[13]Guo X H,Wang C,Sun F Q,et al.A comparison of microbial characteristics between the thermophilic and mesophilic anaerobic digesters exposed to elevated food waste loadings[J].Bioresource Technology,2014,152:420-428.
[14]Li J B,Rui J P,Yao M J,et al.Substrate type and free ammonia determine bacterial community structure in full-scale mesophilic anaerobic digesters treating cattle or swine manure[J].Frontiers in Microbiology,2015,6.doi:10.3389/fmicb.2015.01337.
[15]Sieber J R,McInerney M J,Gunsalus R P.Genomic insights into syntrophy:The paradigm for anaerobic metabolic cooperation[J].Annual Review of Microbiology,2012,66(1):429-452.
[16]Sundberg C,Al-Soud W A,Larsson M,et al.454 pyrosequencing analyses of bacterial and archaeal richness in 21 full-scale biogas digesters[J].FEMS Microbiology Ecology,2013,85(3):612-626.
[17]Luo G,Angelidaki I.Analysis of bacterial communities and bacterial pathogens in a biogas plant by the combination of ethidium monoazide,PCR and Ion Torrent sequencing[J].Water Research,2014,60:156-163.
[18]Jang H M,Kim J H,Ha J H,et al.Bacterial and methanogenic archaeal communities during the single-stage anaerobic digestion of highstrength food wastewater[J].Bioresource Technology,2014,165(8):174-182.
[19]Chen S Y,Niu L L,Zhang Y X.Saccharo fermentans acetigenes gen.nov.,sp.nov.,an anaerobic bacterium isolated from sludge treating brewery wastewater[J].International Journal of Systematic and Evolutionary Microbiology,2010,60(12):2735-2738.
[20]De Vrieze J,Saunders A M,He Y,et al.Ammonia and temperature determine potential clustering in the anaerobic digestion microbiome[J].Water Research,2015,75:312-323.
[21]Regueiro L,Lema J M,Carballa M.Key microbial communities steering the functioning of anaerobic digesters during hydraulic and organic overloading shocks[J].Bioresource Technology,2015,197:208-216.
[22]Hao L P,Bize A,Conteau D,et al.New insights into the key microbial phylotypes of anaerobic sludge digesters under different operational conditions[J].Water Research,2016,102:158-169.
[23]Liu Y C,Whitman W B.Metabolic,phylogenetic,and ecological diversity of the methanogenic archaea[J].Annals of the New York Academy of Sciences,2010,1125(1):171-189.
[24]Song Z L,Zhang C.Anaerobic codigestion of pretreated wheat straw with cattle manure and analysis of the microbial community[J].Bioresource Technology,2015,186:128-135.
[25]De Vrieze J,Hennebel T,Boon N,et al.Methanosarcina:The rediscovered methanogen for heavy duty biomethanation[J].Bioresource Technology,2012,112(5):1-9.
[26]Yu D,Kurola J M,Lahde K,et al.Biogas production and methanogenic archaeal community in mesophilic and thermophilic anaerobic co-digestion processes[J].Journal of Environmental Management,2014,143:54-60.
[27]Chelliapan S,Wilby T,Yuzir A,et al.Influence of organic loading on the performance and microbial community structure of an anaerobic stage reactor treating pharmaceutical wastewater[J].Desalination,2011,271(1):257-264.
