血清Aβ1-42、UA水平和血清炎症因子与帕金森病发病的相关性研究
2018-03-26吴文波牛德旺胡超胜
吴文波,王 超,牛德旺,胡超胜
(安阳地区医院 神经内科,河南 安阳455000)
帕金森病(PD)是老年人群中常见的神经系统退变性疾病,常合并认知功能障碍[1,2]。有研究报道[3],汉族PD患者约有29.10%伴轻度认知损害,若错过干预治疗的最佳时期,约有80%的患者将进展成为帕金森病痴呆(PDD)。近年来,有学者对PD蛋白质标志物的研究发现,PD患者血清中β淀粉样蛋白(Aβ)1-42水平下降对PD早期诊断具有重要意义。本研究通过检测Aβ1-42、尿酸(UA)等生化指标并结合认知功能的检查,探讨Aβ1-42、UA水平和血清炎症因子(IL-6、TNF-α)与帕金森病(PD)患者发病的相关性,现报道如下。
1 资料与方法
1.1一般资料
选取2014年6月至2017年9月在我院诊断为帕金森病的120例患者作为PD组,其中男性74例,女性46例,年龄55-88岁,平均年龄(65.47±15.11)岁。纳入标准:符合帕金森病的诊断标准,排除其他中枢神经系统疾病导致的痴呆患者,不伴有心、肝、肾等脏器功能严重障碍,患者或家属对本研究知情并签署知情同意书,一般资料和病理资料完整。按照Hoehn-Yahr(H-Y)分期标准将PD组患者进一步分为轻度PD组(n=52,H-Y 分期1-2.5)和中、重度PD组(n=68,H-Y 分期≥3 期)。另选取同期健康体检者120例为对照组,其中男性71例,女性49例,年龄54-85岁,平均年龄(62.75±11.15)岁。纳入标准:自愿参与本次研究,并签署知情同意书;排除标准:排除PD之外其他如由心、肺、肾、肝、内分泌、血液系统等导致的认知功能障碍,严重焦虑、抑郁和精神分裂症等心理疾病,失语、谵妄、意识障碍等影响认知功能评估的疾病。两组年龄、性别等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2方法
清晨空腹采集5 ml外周静脉血作为样本,3 000 转/min离心 10 min,提取上清,于-80 ℃保存,检测前统一解冻,4 ℃过夜,次日按人血清 Aβ1-42 ELISA 检测试剂盒(货号 CSB-E10684h,武汉华美公司)说明检测Aβ1-42水平。采用双抗体夹心酶联免疫吸附法检测IL-6、TNF-α水平,所需的ELISA试剂盒购自苏州露水生物科技有限公司。操作步骤严格按照试剂盒操作说明进行。
1.3统计学方法
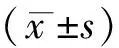
2 结果
2.1两组血清Aβ1-42、UA及血清炎症因子水平比较
与对照组相比,PD组患者血清中Aβ1-42、UA水平明显降低,差异有统计学意义(P<0.05);血清炎症因子IL-6 、TNF-α水平明显升高,差异有统计学意义(P<0.05),见表1。

表1 两组血清Aβ1-42、UA及血清炎症因子水平比较
2.2中、重度帕金森病患者与轻度帕金森病患者血清Aβ1-42、UA及血清炎症因子水平比较
与轻度帕金森病患者相比,中、重度帕金森病患者血清中IL-6 及TNF-α水平明显升高,差异有统计学意义(P<0.05),但血清Aβ1-42及UA水平差异均无统计学意义(P>0.05),见表2。

表1 中、重度组与轻度组患者血清Aβ1-42、UA及IL-1β 、IL-6 及TNF-α水平比较
2.3帕金森病患者血清Aβ1-42、UA、IL-1β、IL-6及TNF-α水平与帕金森病综合评分量表(UPDRS)评分相关性分析
各项指标与UPDRS评分相关性分析结果显示:UA的水平与UPDRS评分之间呈负相关(r=-0.674,P=0.021),IL-6与UPDRS评分之间呈正相关(r=0.402,P=0.027),其余指标与UPDRS评分之间无显著相关性。
表2PD患者血清Aβ1-42、UA、IL-1β、IL-6及TNF-α水平与UPDRS、评分相关性分析

指标相关系数P值UPDRS评分与Aβ1⁃42相关性-0.2310.152UPDRS评分与UA相关性-0.6740.021UPDRS评分与IL⁃1β相关性0.2340.364UPDRS评分与IL⁃6相关性0.4020.027UPDRS评分与TNF⁃α相关性0.1190.761
3 讨论
认知功能障碍是PD临床上表现出的非运动症状之一。PD的病理生理机制复杂,一般认为是多巴胺能(DA)神经元变性丢失,纹状体DA耗竭,位于基底核和额叶间的皮质-皮质下DA环路明显受损[4,5]。病理改变主要表现为小胶质细胞激活所致的一系列神经免疫炎症和氧化应激反应[6]。脑内和外周血中的Aβ通过血脑屏障上Aβ内向和外向转运,使Aβ的生成和降解维持动态平衡。在此过程中低密度脂蛋白受体相关蛋白I和高级糖基化终产物受体(RAGE)起着关键作用。人类淀粉样前体蛋白(APP)在γ-分泌酶的作用下可被分解生成为Aβ1-40和Aβ1-42两种形式。APP编码基因突变或其他原因均可导致γ-分泌酶活性增加。细胞Aβ1-42含量少但更易聚集,且神经毒性更强。齐佩瑾等[7]发现约有50%的PD患者血清中出现Aβ堆积现象,与老年斑的形成有密切关系,同时存在tau蛋白的神经缠结等病理改变[8]。体外细胞培养显示[9]一定浓度的Aβ1-42可诱导一氧化氮(NO)的释放,是炎症级联反应和氧化应激的诱导因素,最终损伤蛋白质及膜性结构,导致神经节坏死或凋亡。
本研究结果显示,PD组血清Aβ1-42水平明显低于对照组,差异有统计学意义,充分说明Aβ1-42参与PD认知功能障碍的发生发展过程,且其水平的降低提示PD神经炎症级联反应和氧化应激反应的可能性。本研究发现PD组患者血清中Aβ1-42水平下降,主要原因可能与血脑屏障渗透性增加,紧密连接蛋白损伤,上调RAGE,使得血脑屏障上的Aβ1-42向内转运大大多于向外转运,血清中Aβ1-42水平降低有关[10]。氧化应激和线粒体功能障碍是PD认知功能障碍的主要原因。UA作为天然抗氧化剂和自由基清除因子,对PD线粒体损伤和氧化应激具有保护作用。病理状态下,UA缺乏,剩余大量自由基和金属离子损害生物膜,破坏线粒体,造成神经元代谢障碍,最终损伤认知功能。本研究结果显示,PD患者血清中UA水平降低,且与UPDRS评分呈负相关,证实UA对PD有保护作用。
近年来大量研究报道[11,12]PD患者血清、脑脊液、脑内纹状体内炎症因子水平升高,主要以包括TNF-α、IL-6在内的致炎性细胞因子水平升高为主,与以上两种致炎性细胞因子广泛分布于外周循环中且容易检测到有关。TNF-α、IL-6可通过诱导和促进炎症和细胞毒性等反应,激活多种细胞凋亡途径,加快细胞损伤和凋亡。本研究结果显示,PD患者血清中TNF-α、IL-6水平不仅升高,且中、晚期帕金森患者与早期帕金森患者相比,IL-6 及TNF-α水平明显高于早期患者。
相关研究也报道[13]脑损伤程度与PD病情相关。但细胞因子水平与病情无关。刘夫军等[14]发现脑内细胞因子的含量与该部位活化的胶质细胞的密度成正比,且活化的小胶质细胞与变性的DA相毗邻。说明小胶质细胞活化并与细胞因子协同作用是导致线粒体功能障碍和神经元变性的主要原因。本研究结果显示,IL-6 、TNF-α水平与UPDRS评分之间呈正相关(r=4.811,P<0.05),说明TNF-α、IL-6是PD的损伤因素。
[1]Jones A J,Kuijer R G,Livingston L,et al.Caregiver burden is increased in Parkinson’s disease with mild cognitive impairment (PD-MCI)[J].Translational Neurodegeneration,2017,6(1):17.
[2]Chaturvedi M,Bousleiman H,Cozac V,et al.Quantitative EEG in patients with Parkinson`s Disease (PD) with and without Mild Cognitive Impairment (MCI) -Power analysis[J].Clinical Neurophysiology,2016,127(3):e30.
[3]罗 琴,夏 欢,杨新玲,等.中国汉族帕金森病患者外周血淋巴细胞基因表达谱的研究[J].中华实验外科杂志,2015,32(7):1720.
[4]刘渤娜,尤振宇,刘学飞.腹腔热灌注联合静脉化疗治疗进展期胃肠道恶性肿瘤并腹水临床研究[J].现代仪器与医疗,2015,21(3):35.
[5]张 佳,康文岩,刘 军.帕金森病患者唾液α-突触核蛋白与纹状体多巴胺摄取功能的相关性研究[J].临床内科杂志,2017,34(1):45.
[6]庄文欣,刘宗昱,王雪净,等.血管活性肠肽对帕金森病大鼠黑质胶质细胞活化及相关炎性因子释放的影响[J].解剖学报,2016,47(2):178.
[7]齐佩瑾.与阿尔茨海默症相关的γ-分泌酶复合物的表达与纯化研究[D].上海交通大学,2015,47(2):178.
[8]唐智伟,张淑坤,吴世政.Tau蛋白与α-突触核蛋白在常见神经系统退行性疾病中的致病机制[J].海南医学,2017,28(3):451.
[9]罗振钊,刘 璐,马 健,等.Annexin-A1模拟肽Ac2-26抑制小胶质细胞释放炎性介质的作用研究[J].中华老年医学杂志,2016,35(12):1320.
[10]梁若冰,雷 晶,张小宁.帕金森病患者合并认知功能障碍与血清Aβ1-42、胱抑素C、尿酸水平的关系[J].神经损伤与功能重建,2016,11(2):131.
[11]魏 涛,张 丽.血清炎症因子与帕金森病精神症状的相关性[J].徐州医学院学报,2015,10(11):773.
[12]Hartley G,Regan D,Guth A,et al.Regulation of PD-L1 expression on murine tumor-associated monocytes and macrophages by locally produced TNF-α[J].Cancer Immunology Immunotherapy,2017,66(4):523.
[13]沈 萍.颅脑损伤急性期C-反应蛋白与脑损伤程度、病情发展和预后的关系[J].中国继续医学教育,2015,11(27):48.
[14]刘夫军,袁向山,刘 静,等.小胶质细胞在VPA孤独症模型大鼠脑增龄过程中的变化[J].神经解剖学杂志,2015,31(3):275.
