宫颈高危型HPV感染者外周血T、B淋巴细胞及NK细胞变化分析
2018-03-26余晓凤陈玲玲王晶华阎泽君
余晓凤,陈玲玲,王晶华,姜 浩,阎泽君,冯 军
(承德医学院第二临床学院 承德市中心医院 检验科,河北 承德067000)
人乳头瘤病毒(HPV)感染在年轻性活跃的个体中很常见。目前有超过200种HPV亚型被发现,其中有40种亚型能够导致生殖器感染[1]。根据2012年国际癌症研究机构(IARC)对HPV致癌性的分类[2],常见的高危型包括HPV16,18,31,33,35,39,45,51,52,56,58,59及68共13个型别,在99.7%的宫颈癌中能够检测到高危型HPV感染[3,4],大约80%的宫颈癌是由HPV16和HPV18感染所致[5]。70%-80%的女性在其一生中会有至少一次感染HPV,大量流行病学资料表明人体HPV亚临床感染(SPI)更为常见[6],HPV感染中绝大部分为一过性感染,大多数病损可自行消退,有数据显示[7],约90%的HPV感染在2年内自我清除,仅有不足1%的HPV感染可能发展为恶性肿瘤[8]。由此说明机体的免疫系统在抗HPV感染中发挥着重要作用。近年来,对于高危型HPV感染细胞免疫功能在外周血T淋巴细胞亚群研究较多但结果不一,而对全身免疫功能研究较少。因为宫颈癌病理分型以鳞癌为主,腺癌及其他特殊类型癌少见,所以本研究中宫颈癌组选取宫颈鳞癌病人,通过检测各组外周血T、B淋巴细胞及NK细胞变化,来进一步研究和分析高危型HPV感染者全身免疫功能状态,为临床高危型HPV感染的免疫干预及预后提供客观依据。
1 材料与方法
1.1材料
1.1.1研究对象 选取2015年11月至2017年1月于我院妇科门诊及病房行宫颈癌筛查的患者,高危型HPV-DNA检测阳性且分别行TCT检查及阴道镜下病理活检者共133例为病例组,其中SPI 31例,平均年龄(43.06±7.98)岁;CINⅠ级24例,平均年龄(44.14±7.35)岁;CINⅡ级28例,平均年龄(42.28±6.96)岁、CINⅢ级26例,平均年龄(43.87±5.15)岁;SCC 24例,平均年龄(52.83±3.78)岁;另选择同期高危型HPV-DNA阴性且宫颈液基细胞学(TCT)阴性健康者30例为对照,平均年龄(40.12±5.66)岁。纳入标准:年龄:21-55岁;高危型HPV感染:16型,18型,其他12种高风险亚型:31,33,35,39,45,51,52,56,58,59,66和68b阳性。排除标准:妊娠或哺乳期的女性患者;近1年内使用过免疫抑制剂增强剂治疗,且伴有免疫性疾病者;经血清学或PCR法证实伴有其他病毒感染性疾病者;有重要脏器的器质性病变者;精神疾病患者;近半年内有重大手术、创伤等应急刺激者;近2月接受全身抗病毒治疗者;患有除宫颈癌以外的其他恶性肿瘤者;处于生殖道急性感染期者;双重或多重高危型HPV感染者。
1.1.2主要试剂和仪器 由贝克曼库尔特有限公司提供的四色淋巴细胞亚群试剂:CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5(PN.6607013)和CD45-FITC/CD16CD56-RD1/CD19-ECD/CD3-PC5(PN.6607073);溶血素(OptilyseC,PN.A11895);流式细胞仪(美国贝克曼库尔特有限公司,FC500)。
1.2方法
1.2.1病例组分组 严格按照纳入及排除标准将高危型HPV-DNA检测阳性,无临床症状和体征者归为SPI组,共31例;有宫颈病变且根据宫颈多点活检及P16/Ki67双染结果判定病变级别分为宫颈上皮内瘤变Ⅰ级(CINⅠ)组、 CINⅡ组、CINⅢ组及SCC组。
1.2.2HPV核酸分型检测 (1)标本采集:取患者宫颈脱落细胞,保存至专用细胞保存液,及时送检。(2)检测方法:使用罗氏cobas 4800 全自动核酸提取及荧光PCR分析系统对标本行HPV核酸检测及分型。
1.2.3淋巴细胞亚群检测 (1)标本采集:对符合标准的患者,在获取其知情同意的情况下采集空腹静脉血2 ml,EDTA抗凝。(2)实验操作:取流式管2只,将每个病人的样本管分别标记为A管和B管,用加样枪分别吸取10 μl四色淋巴细胞亚群试剂于A管(CD45+/CD3+/CD4+/CD8+)和B管(CD45+/CD3-/CD16+CD56+/CD19+)中,再分别向A、B两管中加入100 μl新鲜EDTA抗凝静脉血,涡旋混匀,室温避光放置15 min,然后分别向两管中加入溶血素500 μl,涡旋混匀,室温避光放置10 min,然后每管加入500 μl PBS,室温平衡5 min,充分涡旋混匀,2 h内上机检测(计数10000个细胞)。(3)结果判定:流式细胞仪计数每10000个细胞中标记细胞所占的百分比。
1.3统计学处理
2 结果
2.1HPV16/18型及其他高危型阳性在病例组间所占比例
从SPI到SCC,随着宫颈病理分期进展,HPV16型及HPV18型所占比例逐渐升高,其他型别所占比例相对降低,差异有统计学意义(χ2=9.551,P<0.05),见表1。

表1 HPV16/18型及其他高危型阳性在病例组间所占比例
2.2不同高危型别HPV感染各组间外周血淋巴细胞亚群表达水平比较
HPV16/18型与其他型别感染各细胞变化趋势一致:对照组、SPI及CINⅠ三组间各细胞变化无统计学意义(P>0.05);CINⅡ与CINⅢ组间比较差异无统计学意义(P>0.05);与对照组及亚临床组比较, CINⅡ、CINⅢ及SCC组CD4+、CD16+56+降低,CD8+升高,CD4+/CD8+降低,差异均有统计学意义(P<0.05);且随着病理分期的进展,CD4+、CD16+56+依次呈下降趋势,而CD8+逐渐上升, CD4+/CD8+逐渐降低,甚至SCC组的CD4+/CD8+显著低于CINⅠ组,出现倒置现象,差异均有统计学意义(P<0.05);CD3+、CD19+在各组间差异均无统计学意义(P>0.05),见表2。SCC组与对照组流式细胞仪检测结果比较见图1。
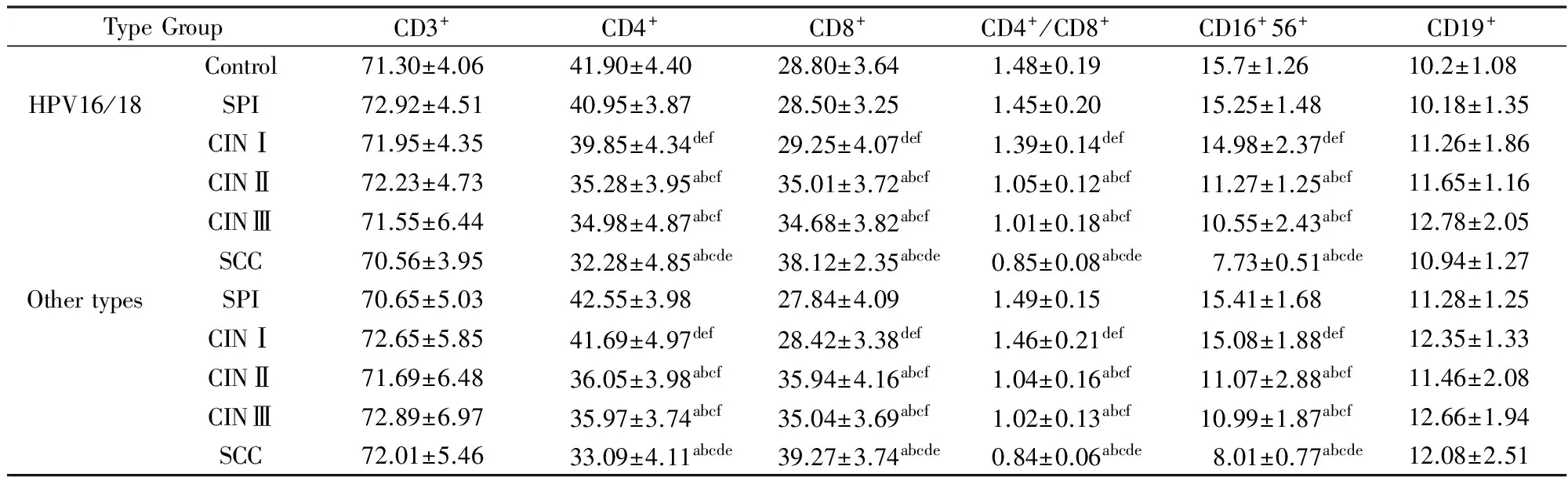
表2 不同型别HPV感染病例组及对照组外周血淋巴细胞亚群表达水平比较
Note:acompared with the control group,P<0.05; bcompared with the group of SPI,P<0.05;ccompared with the group of CINⅠ,P<0.05;dcompared with the group of CIN Ⅱ,P<0.05; ecompared with the group of CIN Ⅲ;P<0.05.fcompared with the group of SCC;P<0.05.
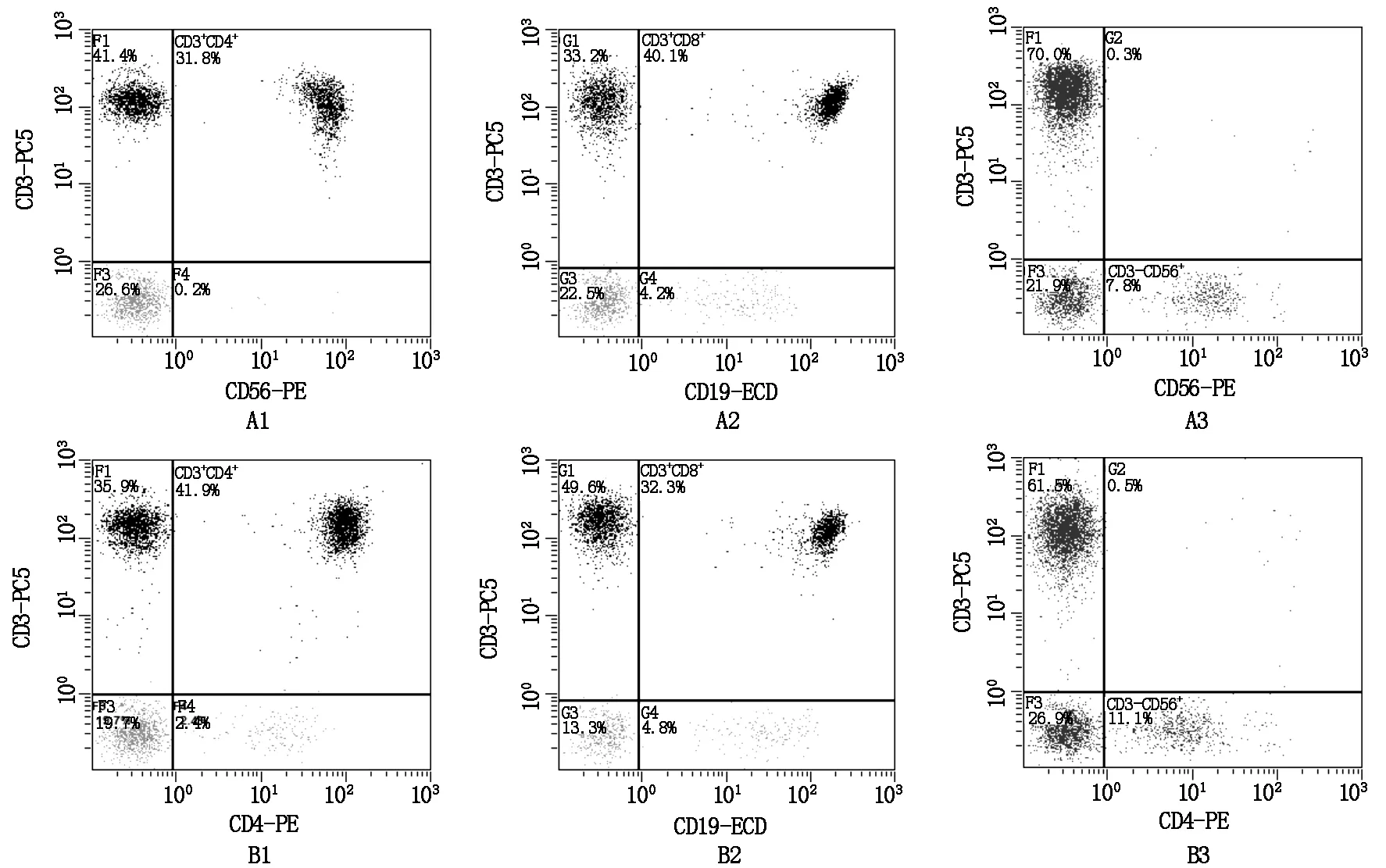
Note:A1:CD3+CD4+in group of SCC;A2:CD3+CD8+in group of SCC;A3:CD3-CD16+CD56+in group of SCC;B1:CD3+CD4+in control group;B2:CD3+CD8+in control group;B3:CD3-CD16+CD56+in control group.
图1SCC组与对照组外周血淋巴细胞流式细胞仪检测散点图
3 讨论
目前国内外学者一致认为高危型HPV持续感染是发生宫颈癌的主要危险因素[9,10]。机体感染HPV后,会启动一系列免疫应答来清除HPV感染,有研究报道[11]HPV进入人体96小时内为固有免疫,96小时后主要为适应性免疫。近年来研究表明机体抗HPV感染以细胞免疫为主,而T淋巴细胞亚群为细胞免疫中的关键成分[12]。本研究选取CINⅠ、CINⅡ、CINⅢ及SCC与对照组及SPI组比较,结果提示随着宫颈病变程度的加重,HPV16/18所占比例越来越高,这也提示HPV16/18是导致宫颈癌前病变及宫颈癌的重要因素。各组间淋巴细胞亚群比较结果提示宫颈高级别病变及宫颈鳞癌患者体内存在明显的淋巴细胞亚群偏移现象,可能与发生病毒免疫逃逸有关,表现为固有免疫及细胞免疫功能降低,SCC组CD4+/CD8+<1,说明已经出现免疫抑制,同时也说明患者体内可能存在HPV持续感染。
辅助性T细胞(Th 细胞)是淋巴细胞的一个亚群, 根据分泌细胞因子不同,主要分为Th1与Th2两种细胞,其中Th1主要参与细胞免疫反应,Th2可辅助B细胞分化为抗体分泌细胞,参与体液免疫应答。近年来大量研究表明Th细胞在抗HPV感染中具有重要意义[13,14],其Th1/Th2比值的恒定能够确保机体免疫功能的正常进行,大量临床研究表明,随着高危型HPV感染患者病情的不断加重,体内的Th1及Th2之间的平衡状态被消除,表现为Th2细胞应答增强,导致其所分泌的IL-4、IL-5等Th2型细胞因子占优势,进而对细胞免疫产生抑制,使CD4+T细胞增殖分化受抑,从而使IL-2、IFNγ等Th1型细胞因子分泌减少,进一步导致HPV感染者病情发展过快,致使机体对病毒产生耐受作用[15]。本研究中,随着宫颈病变程度加重,高危型HPV感染者CD4+T逐渐减低,而CD8+T逐渐上升,CD4+/CD8+比值逐渐降低,宫颈癌组甚至出现倒置,提示患者已经处于免疫抑制状态。近年来对于高危型HPV感染者全身细胞免疫(外周血T淋巴细胞亚群)变化的研究,结果尚无定论。Chen ZF等[16]和Hernandez等[17]研究认为高危型HPV感染者与非感染者相比,外周血T淋巴细胞亚群无明显变化;而国内有研究结果[18-20]表明有变化。而本研究显示各病例组外周血淋巴细胞亚群比例有差异,且与宫颈病变病理分期有关,高级别癌前病变及宫颈癌患者存在细胞免疫减低,病变程度与HPV感染型别有关。
NK细胞是参与机体固有免疫的一类重要细胞,NK细胞及活化的NK细胞数量减少能够使人体抗病毒、抗肿瘤的能力降低,而NK细胞自身所具有的活性是通过CD4+T细胞所分泌的IL-2、IFNγ实行调节的[21],本研究中,高级别宫颈病变组及SCC 组CD4+T细胞均低于对照组、SPI组及低级别宫颈病变组,这可能是导致NK细胞降低的原因。本研究结果提示CD19+B细胞在各组间差异均无统计学意义,说明与体液免疫相关的B细胞在高危型HPV感染中无明显变化。对于SPI组及CINⅠ来说,淋巴细胞亚群与对照组相比无明显变化,这说明亚临床感染及宫颈低级别病变的患者全身免疫功能基本正常。
综上所述,通过检测宫颈高危型HPV感染患者外周血T、B淋巴细胞及NK细胞的变化,可以了解患者从HPV亚临床感染至宫颈上皮内瘤变甚至发展为宫颈癌的整个病变进展过程中的全身免疫功能状态。同时,可为临床高危型HPV感染伴宫颈病变患者的免疫干预及预后提供客观依据。
[1]Schiffman M,Castle PE.Human papillomavirus:epidemiology and public health[J].Arch Pathol Lab Med,2013,127(8):930.
[2]IARC Working Group on the Evaluation of Carcinogenic Risks to Humans.Biological agents.Volume 100 B.A review of human carcinogens[J].IARC Monogr Eval Carcinogens Risks Hum,2012,100(Pt B) :1.
[3]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:Sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(10):359.
[4]De Oliveira CM,Rregnani JH,Carvalho JP,et al.Human papillomavirus genotypes distribution in 175 invasive cervical cancer cases from Brazil[J].BMC Cancer,2013,13(1):1.
[5]Wonqsena M,Suebsamran P,Panomket P,et al.Prognostic factors of human papillomavirus genotypes of invasive cervical carcinoma:an analytical crossesctional study in north-east Thailand[J].Med Assoc Thai,2014,97(Suppl 4):S12.
[6]麦丽霞,杨广智,张 婷,等.HPV亚临床感染与细胞免疫功能相关性分析[J].辽宁中医药大学学报,2016,18(8):127.
[7]Winer RL,Hughes JP,Feng Q,et al.Early natural history of incident,typ-e specific- human papillomavirus infections in newly sexually active young women[J].Canc Epide-miol Biomarkers,2011,20(4):699.
[8]Veldhuijzen NJ,Snijders PJ,Reiss P,et al.Factors affecting transmission of mucosal human papillomavirus[J].Lancet Infect Dis,2010,10(12):862.
[9]Enebe JT,Dim CC,Nnakenyi EF,et al.Effect of low CD4 cell count on cervical squamous intraepithelial lesions among HIV-positive women in Enugu,Southeastern Nigeria [J].Journal of Clinical& Diagnostic Research,2015,9(11):7.
[10]Ramanathan P,Ganeshrajah S,Raghanvan R,et al.Development and clinicalevaluation of dendritic cell vaccines for HPV related cervical cancer-a feasibility study[J].Asian Pacific Journal of Cancer Prevention Apjcp,2014,15(4):9.
[11]包振宇,邹先彪,张云杰.人乳头瘤病毒感染及其免疫学进展[J].实用皮肤病学杂志,2015,8(4):284.
[12]Xiao Y,Ren YK,Cheng HJ,et al.Modified Glasgow prognostic score is an independent prognostic factor in patients with cervical cancer undergoing chemoradiotherapy[J].International Journal of Clinical & Experimental Pathology,2015,8(5):73.
[13]Liang C,Duan R,Lai CC.Check coagulation determination of molecular markers in children the value of early diagnosis of infectious disease complicated with DIC[J].J Exp Lab Med,2013,31(4):322.
[14]温丽丽,李金明.流行性出血热发热期外周血T淋巴细胞亚群与血小板的检测[J].实验与检验医学,2013,31(4):326.
[15]Farmers RX.Pseudo platelet critical value analysis[J].J Exp Lab Med,2013,31(3):349.
[16]Chen ZF,Ding JB,Pang NN,et al.The Th17/Treg balance and the expression of related cytokines in Uygur cervical cancer[J].Diagnostic Pathology,2013,8(1):1.
[17]Hernandez-Montes J,Rocha-Iavaleta L,Monroy-Garcia A,et al.Peripheral blood lymphocytes from low-grade squamous intraepithelial lesions patients recognize vaccine antigens in the presence of activated dendritic cells,and produced high levels of CD8+IFNγ+T cells and low levels of IL-2 when induced to proliferate[J].Infectious Agents and Cancer,2012,7(1):12.
[18]全进毅,程琪辉,孙丽萍.T细胞亚群及Ki67在宫颈人乳头瘤病毒感染进程中的变化及意义[J].中华医院感染学杂志,2012,22(6):1126.
[19]孙 健.高危型人乳头瘤病毒(HPV) 感染者宫颈局部及外周血CD4+/CD8+变化的研究[D].甘肃兰州:甘肃中医药大学,2016.
[20]宋文君.HR-HPV感染合并不同宫颈病变与外周血T细胞亚群的研究[D].新疆石河子:石河子大学,2013.
[21]李泽文.超氧化物歧化酶(SOD)检测对老年性疾病病情和预后检测的临床意义[J].实验与检验医学,2013,31(4):397.
