高血压合并NAFLD的Scr、BMI、HDL-C检测及其临床意义
2018-03-26徐晓华
李 明,赵 彤,徐晓华
(吉林大学中日联谊医院 1.消化内科;2.超声科;3.肾内科,吉林 长春130033)
非酒精性脂肪肝(NAFLD)是指除外酒精和其他明确的损肝因素所致的,以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征[1]。发达国家非酒精性脂肪肝发病率达20%-30%,亚洲人群为5%-18%,成为仅次于病毒性肝炎的第二大肝病[2];其中的2%-5%发展为脂肪型肝炎(NASH),1%-2%肝纤维化加重演变为肝硬化,部分可进展为肝癌[3]。NAFLD为代谢综合征的一部分,与心血管疾病,尤其是与高血压密切相关。本研究旨在观察高血压合并NAFLD患者的相关指标的改变,探讨其发病危险因素。
1 对象与方法
1.1研究对象随机选取2016年1月至2017年8月就诊于吉林大学中日联谊医院的原发性高血压患者,分为单纯高血压(Hypertension)组[54例,24例男,30例女,平均年龄为(61.2±11)],与高血压合并NAFLD(Hypertension+NAFLD)组[53例,20例男,33例女,平均年龄为(61.04±10.89)],两组对象性别与年龄差异均无统计学意义(P>0.05)。入选者入院后均行B超/CT/MRI。NAFLD诊断符合2010年中华医学会肝脏病学分会制定的NAFLD诊断标准 ,高血压诊断及分级均符合1999年WHO/ISH高血压诊断标准[4],且单纯高血压组均经影像学诊断排除NAFLD。两组均排除大量饮酒者(男性>140 g/周,女性>70 g/周)、病毒性肝炎、PBC、PSC、自身免疫性肝病、药物性肝病、肿瘤或明确病因的肝病、继发性高血压、脑血管意外、血液系统疾病、肾脏原发疾病、严重心、肝、肺、脑、肾功能障碍等患者。
1.2仪器与方法
1.2.1标本采集 入院后24小时内,受试者明确高血压分级;采集空腹肘静脉血检测外周血红细胞计数(RBC)、血红蛋白(HGB)、红细胞平均体积(MCV)、红细胞平均血红蛋白浓度(MCHC)、平均红细胞体积分布宽度(RDW)、空腹血糖(FBG)、血肌酐(Scr)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、载脂蛋白A1(Apo-A1)、载脂蛋白B(Apo-B)、脂蛋白a[LP(a)]、天门冬氨酸氨基转移酶(AST)、谷丙转氨酶(ALT)、谷氨酰转肽酶(GGT);患者入院时常规检测身高、体重,计算得出BMI值。
1.2.2全血细胞计数检测 采用日本SYSMEX XN(B4)全自动五分类血球计数仪,配套试剂购自希美康生物科技有限公司,测定受试者RBC、HGB、MCV、MCHC、RDW。
1.2.3血生化测定 Scr测定采用尿素酶速率法,UA测定采用尿酸酶法,FBG测定采用己糖激酶法,TC、TG、HDL-C、LDL-C、Apo-A1、Apo-B、LP(a)测定采用酶比色法,AST、AL、GGT测定采用IFCC 速率法,仪器是日立7600全自动生化分析仪,试剂由北京利德曼生化股份有限公司提供。以上所有操作均严格按照操作规程进行。
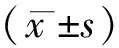
2 结果
2.1各指标差异性检验与单纯高血压组相比,高血压合并NAFLD组BMI、FBG、ALT显著升高,MCV、Scr、HDL-C显著降低(P<0.05,差异具有统计学意义),其中BMI、HDL-CP值≤0.01,差异有显著统计学意义(见表1)。经χ2检验得出两组糖尿病患病率存在统计学差异(χ2值5.789,P=0.016<0.05)。经Mann-whitneyU检验得出两组高血压分级无明显统计学差异(U值1.652,P=0.099,见图1)。

表1 两组检验指标的差异性检验

图1 两组高血压分级的独立样本mann-whitney U检验
2.2有统计学差异指标进行多因素回归分析对所有指标进行单因素分析后,选择具有统计学差异的指标BMI、MCV、FBG、Scr、HDL-C、ALT、糖尿病患病率,进行多因素回归分析。采用二元logistic回归分析后得出结论:高血压合并NAFLD组与单纯高血压相比,BMI、Scr、HDL-C差异仍具有统计学意义(P<0.05)。OR值为1.172,大于1,此指标为高血压是否合并NAFLD的独立危险因素,即可认为在其他因素不变的情况下,BMI升高的高血压患者合并NAFLD风险为BMI未升高患者的1.172倍。Scr、HDL-C的OR值分别为为0.964、0.056,均小于1,提示低Scr、低HDL-c为高血压是否合并NAFLD的独立危险因素(见表2)。
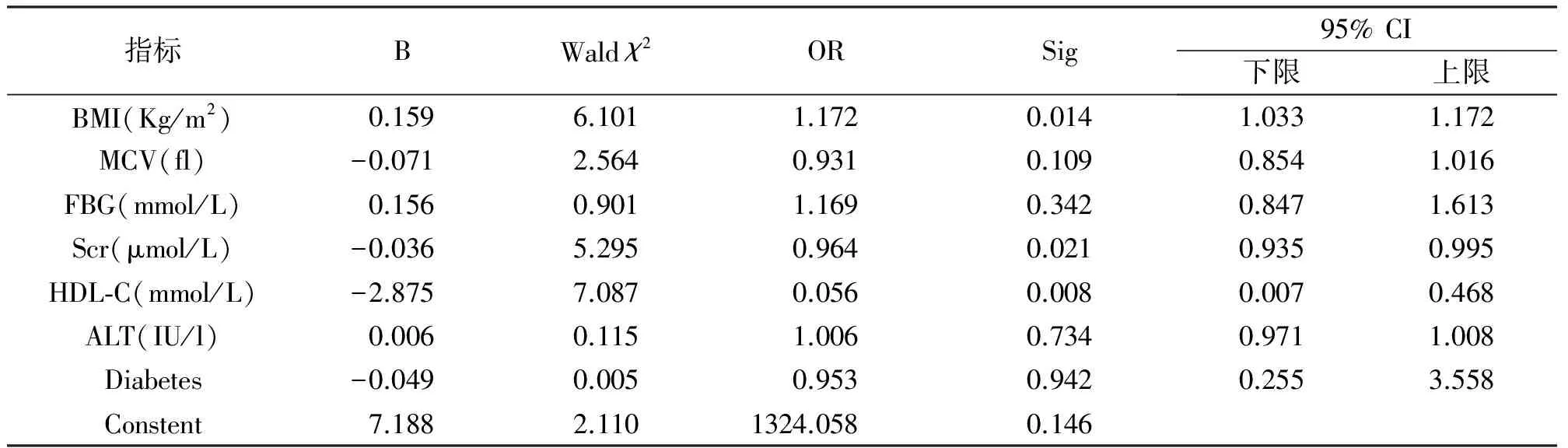
表2 两组检验指标的差异性检验
3 讨论
NAFLD的发生、发展涉及到遗传、环境、生活方式等多种因素。其分子学发病机制目前多倾向于“二次打击”学说。其中第一次打击以胰岛素抵抗为主,同时包括不良生活习惯导致的肝细胞内甘油三酯及游离脂肪酸堆积,而胰岛素抵抗可加重肝细胞脂肪酸生成增多、降解受抑制[5]。第二次打击为在胰岛素抵抗的基础上,沉积于肝细胞的脂质释放脂肪因子、炎症介质、脂毒性物质,引起氧化应激,导致细胞内活性氧基团大量产生,线粒体及内质网负荷加重,内质网过负荷激活未折叠蛋白,又加剧胰岛素抵抗[6]。另外,瘦素抵抗,自由基大量产生,IL-6、TGF-β、TNF-α等炎症介质介导的慢性炎症也参与NAFLD发病机制[7]。高血压是一种血液动力学异常的疾病,大量研究表明,高血压靶向器官损害主要机制包括炎症介质IL-6、氧化应激、RAAS系统激活、脂质紊乱、血管内皮细胞功能异常、脂联素,其发病与胰岛素抵抗密切相关[8,9]。作为代谢综合征重要组分,高血压与NAFLD相关性近年来成为研究热点,已证实NAFLD为高血压发病独立危险因素[9,10]。有meta分析表明肥胖为高血压的最重要危险因素[11],它也是NAFLD最主要危险因素之一。而BMI为反映肥胖常用指标,已被证实与NAFLD密切相关[12]。既往研究表明,内脏肥胖比整体肥胖更能体现脂肪聚集,以往研究中多着重LDL及VLDL在NAFLD发病中作用及机制,本研究中高血压合并NAFLD组HDL-C显著降低,这一结果与Cohen DE等人研究一致[13]。HDL-C由肝脏合成,主要生理功能是逆向转运磷脂和胆固醇。HDL-C对NAFLD的保护作用一方面通过稳定血管中脂肪斑块,抗高脂血症,控制心血管疾病发生发展,从而降低NAFLD发病率。另一方面,胆固醇在细胞内堆积是NAFLD肝细胞产生炎症及纤维化的重要基础机制;肝脏中生成的胆固醇除转化为HDL-C,卵磷酯胆固醇酰基转移酶(LCAT)能催化游离胆固醇的酯化,酯化胆固醇比游离的胆固醇更疏水,被紧紧地包裹在HDL的中心部位,以便HDL可以摄取更多的胆固醇,起到稳定肝细胞、保护肝脏的作用[14]。本研究在已排除肾脏原发疾病及肾功能不全情况下,证实低肌酐为高血压合并NAFLD的危险因素,肌酐与NAFLD的关系很少被阐述,结论不一,机制方面研究尤其少。曾有研究证实肌酐为肌肉中肌酸转化而来,全部由肾脏排泄,通常作为反映肾功能的指标。体内肌酐池相对稳定,其大小决定性因素为人体肌肉量,受蛋白或肌酸摄入、温度、胞间pH、性别、年龄影响[15]。其减低原因为摄入减少、代谢产生减少、排出增多,其中最主要的因素是代谢产生减少。脂肪肝患者肝细胞功能减退,肝脏肌酐合成功能减低。另外,有文献证实少部分肌酐由肠道排泄,其排泄率受肠道菌群变化影响[16],而肠道菌群与NAFLD及代谢综合征相关[17]。因此高血压合并NAFLD肌酐降低原因考虑主要为肥胖患者机体肌肉量相对较低,不排除肝脏肌酐合成减少、肠道途径排出肌酐减少所致。高血压合并NAFLD患者是否有饮食结构变化(蛋白、肌酐摄入减少)、肾脏功能改变导致肌酐排出增多尚需进一步研究。本研究样本量相对较低,纳入因素受限,实验结果不排除因混杂因素影响或样本量较低产生误差。低肌酐与NAFLD之间关系及其具体机制目前尚无定论,此方面相关文献少,需更多临床数据及分子水平研究支持。
综上所述,高BMI、低肌酐、低HDL-C是高血压合并NAFLD的独立危险因素。高血压及NAFLD作为代谢综合征的重要组成部分,改善BMI、肌酐、HDL-C相关因素是预防高血压并发NAFLD的重要手段。肌酐与高血压合并NAFLD关系相关报道少,可以作为临床实验研究的一个新的切入点。高血压合并NAFLD的危险因素、检验指标及相关作用机制亟待进一步研究。
[1]Sweet PH,Khoo T,Nquyen S.Nonalcoholic Fatty Liver Disease[J].Prim Care,2017,44(4):599.
[2]Sayiner M,Koenig A,Henry L,et al.Epidemiology of Nonalcoholic Fatty Liver Disease and Nonalcoholic Steatohepatitis in the United States and the Rest of the World[J].Clin Liver Dis,2016,20(2):205.
[3]Goh GB,McCullough AJ.Natural history of nonalcoholic fatty liver disease[J].Dig Dis Sci,2016,61:1226.
[4]Chalmers J.The 1999 WHO-ISH Guidelines for the Management of Hypertension[J].Med J Aust,1999,171(9):458.
[5]Townsend SA,Newsome PN.Non-alcoholic fatty liver disease in 2016[J].Br Med Bull,2016,119(1):143.
[6]Cusi K.Role of insulin resistance and lipotoxicity in non-alcoholic steatohepatitis[J].Clin Liver Dis,2009,13(4):545.
[7]Buzzetti E,Pinzani M,Tsochatzis EA.The multiple-hit pathogenesis of non-alcoholic fatty liver disease(NAFLD)[J].Metabolism,2016,65(8):1038.
[8]Kjeldsen SE.Hypertension and cardiovascular risk:General aspects[J].Pharmacol Res,2017,18(6):183.
[9]Kim D,Touros A,Kim WR.Nonalcoholic Fatty Liver Disease and Metabolic Syndrome[J].Clin Liver Dis,2018,22(1):133.
[10]Liu H,Lu HY.Nonalcoholic fatty liver disease and cardiovascular disease[J].World J Gastroenterol,2014,14,20(26):8407.
[11]Luo L,Luan RS,Yuan P.Meta-analysis of risk factors on hypertension in China[J].Zhanghua Liu Xing Bing Xue Za Zhi,2003,2420:50.
[13]Cohen DE,Fisher EA.Lipoprotein metabolism,dyslipidemia,and nonalcoholic fatty liver disease[J].Liver Dis,2013,33:380.
[14]Ampuero J,Ranchal I,et al.Oxidized low-density lipoprotein antibodies/high-density lipoprotein cholesterol ratio is linked to advanced non-alcoholic fatty liver disease lean patients[J].J Gastroenterol Hepatol,2016,31(9):1611.
[15]Perrone RD,Madias NE,Levey AS.Serum creatinine as an index of renal function:new insights into old concepts[J].Clin Chem,1992,38(10):1933.
[16]Cocchetto DM,Tschanz C,Biornsson TD.Decreased rate of creatinine production in patients with hepatic disease:implications for estimation of creatinine clearance[J].Ther Drug Monit,1983,5:161.
[17]Lau E,Carvalho D,Freitas P.Gut Microbiota:Association with NAFLD and Metabolic Disturbances[J].Biomed Res Int,2015,20(15):979.
