改善全球肾脏疾病预后组织急性肾损伤不同诊断标准对高龄老年住院患者90天预后的影响
2018-03-24李青霖李玉茹王小丹李凯
李青霖,李玉茹,王小丹*,李凯
(解放军总医院南楼临床部:1保健科,2检验科,100853 北京)
急性肾损伤(acute kidney injury,AKI),既往称为急性肾衰竭(acute renal failure,ARF),是临床各科室最常见的危急重症之一。AKI与患者病死率、慢性肾脏病(chronic kidney disease,CKD)的发生以及维持性透析率密切相关[1]。为了能尽早诊断AKI并且降低漏诊率,近10年AKI概念和诊断标准经历了3次变迁:2002年RIFLE(Risk,Injury,Failure,Loss of kidney function and End-stage renal failure)标准[2]、2004年急性肾损伤网络(acute kidney injury network,AKIN)标准[3]和2012年改善全球肾脏疾病预后组织(Kidney Disease Improving Global Outcomes,KDIGO)标准[4]。KDIGO的AKI指南增加了时间概念,定义为48 h内血清肌酐(serum creatinine,SCr)升高≥26.5 μmol/L,或7 d内SCr升高超过基线值的1.5倍及以上。目前临床上关于KDIGO指南中AKI的2种SCr诊断标准对高龄老年患者短期预后的影响及其临床特征的研究尚不多见。为此,我们回顾性分析了在解放军总医院老年病房住院患者的临床资料,以AKI发生后90 d为观察点进行回顾性队列研究,目的是了解不同AKI诊断标准的发生率、临床特点及对高龄老年人短期预后的影响。
1 对象与方法
1.1 研究对象
收集2007年1月1日至2015年12月31日在解放军总医院老年病房住院的≥75岁AKI患者的病历资料652例,中位年龄87(84~91)岁。根据诊断窗将所有患者分为2组:48 h诊断窗组(n=334)和7 d诊断窗组(n=318)。根据患者AKI发生后90 d内的生存情况分为2组:生存组(n=433)和死亡组(n=219)。AKI发生后随访90 d病死率为33.6%(219/652)。排除标准:(1)<75岁;(2)发生AKI前已存在有各种原因引起的CKD;(3)住院时间<48 h;(4)病历资料不全;(5)缺少2次以上的SCr值。
1.2 方法
1.2.1 收集临床资料 记录患者一般情况[姓名、年龄、性别、体质量指数(body mass index,BMI)]、基础疾病史[主要为冠心病、高血压、糖尿病、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)及CKD]、临床用药情况、AKI病因、AKI发生时伴随情况(机械通气、尿量、透析、平均动脉压等)。
1.2.2 实验室指标 基础SCr值、AKI发生时SCr值、SCr峰值、血尿素氮(blood urea nitrogen,BUN)、血清尿酸、血清前白蛋白、血清白蛋白、血镁、血钙、血磷、血红蛋白结果等。其中SCr基础值是指患者AKI发生前3个月内稳定状态时获得的SCr测量值[1];SCr峰值是指AKI病程中检测的SCr最高值。
1.2.3 AKI诊断及分期标准 采用KDIGO指南定义的SCr诊断及分期标准[4]。
1.2.4 CKD的定义和分期标准 采用2012年KDIGO指南制定的CKD标准[5]。
1.2.5 估算肾小球滤过率 采用2009年慢性肾脏病流行病学合作组公式获得估算肾小球滤过率(estimated glomerular filtration rate,eGFR)[6]。
1.3 统计学处理
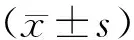
2 结 果
2.1 不同诊断标准患者一般情况和临床特征比较
48 h诊断窗组和7 d诊断窗组患者中,AKI 3期者分别为119例(占35.6%)和61例(占19.2%),AKI 2期者分别为86例(占25.7%)和78例(占24.5%),2组患者AKI分期间差异具有统计学意义(P<0.05)。与7 d诊断窗组患者比较,48 h诊断窗组患者的基础SCr值、肾毒性药物使用比率、平均动脉压、血清前白蛋白和白蛋白显著降低,而基础eGFR值、手术患者比例、SCr峰值、BUN水平、伴低血压者、伴机械通气者、伴少尿者、伴高镁血症者、伴低钙血症者和病死率显著增多,差异均具有统计学意义(P<0.05;表1)。
2.2 不同生存情况患者一般情况和临床特征比较
死亡组和存活组患者中,AKI 3期者分别为134例(占61.2%)和46例(占10.6%),AKI 2期者分别为66例(占30.1%)和98例(占22.6%),2组患者AKI分期间差异具有统计学意义(P<0.05)。死亡组和存活组患者中, 采用48 h诊断窗者分别为142例(占64.8%)和192例(占44.3%),采用7 d诊断窗者分别为77例(占35.2%)和241例(占55.7%),2组患者诊断窗间差异具有统计学意义(P<0.05)。与死亡组相比,存活组患者的BMI、伴有

表1 2组患者的一般情况和临床特征比较
BMI: body mass index; COPD: chronic obstructive pulmonary disease; SCr: serum creatinine; eGFR: estimated glomerular filtration rate; AKI: acute kidney injury; MAP: mean aortic pressure; MV: mechanical ventilation; BUN: blood urea nitrogen. 1 mmHg=0.133 kPa. Compared with 48-hour diagnostic window group,*P<0.05,**P< 0.01,***P<0.001
高血压病史者的比例、基础SCr值、肾毒性药物使用比率、平均动脉压、前白蛋白、血清白蛋白和血红蛋白值显著增高,而eGFR值、感染者比率、AKI确诊时SCr、SCr峰值、BUN、尿酸水平、机械通气者、少尿者、高镁血症者、高磷血症者比例显著降低,差异均具有统计学意义(P<0.05;表2)。
2.3 Kaplan-Meier生存曲线
采用Kaplan-Meier生存曲线比较不同诊断窗对住院老年患者90 d生存状况的影响,结果显示,采用7 d诊断窗患者的90 d生存状况要显著好于采用48 h诊断窗者(图1A;P<0.001);随着发生AKI时间的增加,患者90 d病死率显著减少(图1B;P<0.001)。
2.4 影响住院老年AKI患者90 d生存的多因素Cox分析
将单因素分析时P<0.05的变量进一步进行多因素Cox生存分析,结果显示,低BMI(HR=0.928,95%CI:0.886~0.973,P=0.002)、低平均动脉压(HR=0.969,95%CI:0.959~0.979,P<0.001)、低血清前白蛋白(HR=0.948,95%CI:0.920~0.977,P<0.001)、低白蛋白(HR=0.962,95%CI:0.930~0.995,P=0.025)、感染(HR=1.374,95%CI:1.027~1.840,P=0.033)、少尿(HR=2.069,95%CI:1.341~3.192,P=0.001)、BUN增高(HR=1.027,95%CI:1.015~1.038,P<0.001)、高镁(HR=2.485,95%CI:1.351~4.570,P=0.003)、更高的AKI分期(2期:HR=4.035,95%CI:2.381~6.837,P<0.001;3期:HR=7.184,95%CI:4.301~11.997,P<0.001)、AKI诊断时间≤48 h(HR=1.818,95%CI:1.256~2.631,P=0.002)是影响住院老年AKI患者90 d死亡的独立危险因素。
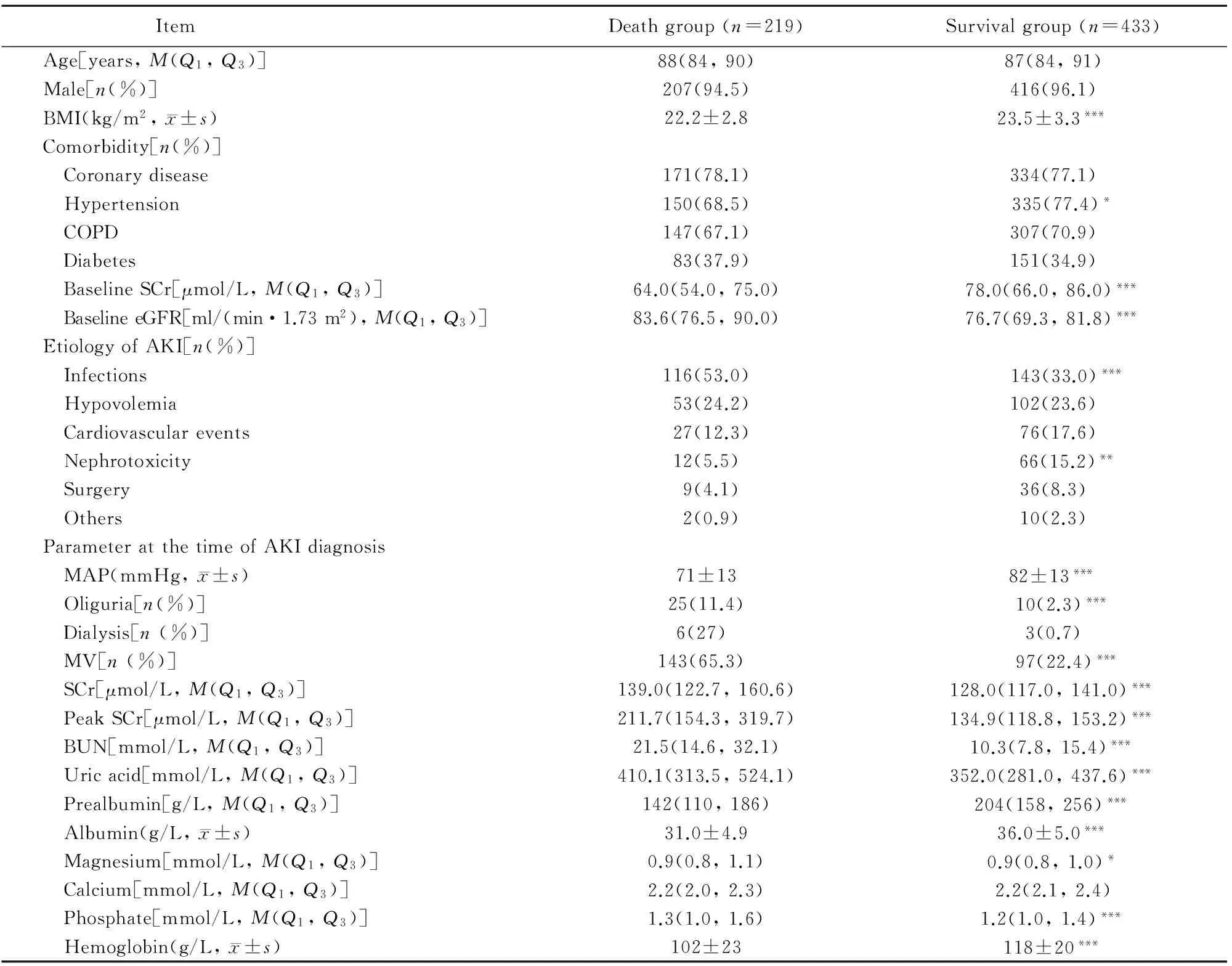
表2 2组患者的一般情况和临床特征比较
BMI: body mass index; COPD: chronic obstructive pulmonary disease; SCr: serum creatinine; eGFR: estimated glomerular filtration rate; AKI: acute kidney injury; MAP: mean aortic pressure; MV: mechanical ventilation; BUN: blood urea nitrogen. Compared with death group,*P<0.05,**P< 0.01,***P<0.001
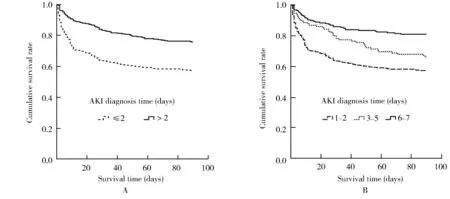
图1 不同AKI诊断窗患者的Kaplan-Meier生存曲线分析
3 讨 论
自ARF概念提出以来一直缺乏统一的定义和诊断标准,在各种文献中粗略统计其定义多达35种[7]。由于ARF的定义长期未达到共识,导致其发病率、病死率等流行病学研究结果存在巨大差异,使不同的研究结果难以比较,成为限制ARF诊治及研究的障碍[8]。鉴于此,自2002年以来,先后提出了AKI的RIFLE标准、AKIN标准及最新的KDIGO指南,以统一国际上关于AKI的定义和分期标准,这对于早期识别AKI起到了积极作用。很多研究已经比较RIFLE、AKIN和KDIGO标准在临床中的应用。文献报道,KDIGO诊断标准在预测AKI患者的病死率方面显著优于REFLE和AKIN诊断标准[9],但比较KDIGO标准中2个诊断时间窗的研究较少。本研究通过回顾性分析652例老年AKI患者的临床资料,探讨了KDIGO标准下AKI不同诊断时间窗的临床特征及对患者短期预后的影响。
为了早期诊断AKI并且降低漏诊率,KDIGO指南规定了48 h的诊断时间窗,即将“肾功能突然减退”限定在48 h内。因此理论上只有48 h内测定2次以上SCr值的患者才有可能被检出。在国内,超过70%的住院患者在整个住院过程中从未接受或者只接受过1次SCr值检测,只有25%~30%的患者检测了2次以上SCr值;而在发达国家的研究报道中,测2次以上SCr值者高达68%[10, 11],这种现象极有可能与医师对疾病的重视程度以及整体医疗投入等多种因素有关。客观上要求临床非肾科医师对AKI的定义和诊断标准熟悉和知晓,同时进行SCr动态监测以减少AKI漏诊率。
本研究中,有近49%(318/652)的患者通过基线SCr值(7 d 诊断窗)的标准诊断了AKI,因此确定基线SCr值对于诊断AKI和确定分期具有重要意义[12]。目前国际上较为认可的基线SCr值设定方法有以下几种[4]。(1)采用入院时的SCr值。由于很多患者在入院前就已经发生了AKI,这样的检出策略会极大程度忽视入院前已经发生AKI的患者,而且入院时的SCr值可能受到当时血液动力学或代谢状态的影响[13]。(2)采用住院期间最低SCr值。这也是KDIGO 指南建议的基线SCr值设定方法,但对营养不良的老年人可能会高估AKI的发生率[14]。(3)缺乏基线SCr值的患者,采用肾脏病改良膳食方程估算eGFR为75 ml/(min·1.73 m2),但有可能高估部分CKD患者尤其是老年患者的基础肾功能[15]。(4)采用住院前7~365 d SCr均值。这种方法可排除疾病状态导致的SCr值变化,最接近真实的基线SCr值水平,但是在实际操作中许多AKI患者没有基线SCr值记录,导致AKI的发病率始终存在高估或低估。本研究中全部患者均有基线SCr值记录,因此我们以AKI发生前3个月内稳定状态时获得的SCr测量值为基线SCr值,在一定程度上提高了AKI的诊断率。
本研究中,48 h诊断窗组和7 d诊断窗组患者的90 d病死率分别为42.5%和24.2%。采用Kaplan-Meier生存曲线比较显示,采用7 d诊断窗患者的 90 d生存状况要显著好于采用48 h诊断窗者。Cox多因素分析显示,AKI诊断时间≤48 h(HR=1.818,95%CI:1.256~2.631,P=0.002)是影响老年AKI患者90 d死亡的独立危险因素。分析原因可能与48 h诊断窗患者伴有低血压和机械通气比例高、营养状况差及AKI 3 期患者比例高有关。(1)AKI患者本身一般情况较差,且机械通气影响全身和肾脏血流,可引起低血压和液体反应性休克,导致肾脏灌注不足,引起或促进AKI的发生发展[16],增加了患者不良预后的发生。(2) AKI分期的递进意味着肾损害程度的上升和病情的加重[11],48 h内急剧升高的SCr值可能预示了更多的肾功能丧失,而与轻度肾功能下降相比,更严重的肾功能下降提示更差的预后。(3)老年人营养不良发生率高,而营养不良又增加了AKI的发病率与病死率[17]。研究发现,伴有低蛋白血症的AKI患者病死率增加[17]。另一项关于血清前白蛋白对老年AKI患者90 d病死率的研究发现[18],血清前白蛋白<200 g/L的患者院内病死率为48.9%,而≥200 g/L的患者病死率仅为19.7%。可见营养不良对于老年AKI患者的预后具有非常重要的意义。(4)48 h诊断窗虽然诊断时间早于7 d 诊断窗,但不代表肾脏损伤处于早期,原因在于SCr不是老年患者肾功能发生急性或突然变化时的可靠指标,肾细胞损伤与肾功能丧失之间存在时间上的滞后,48 h诊断窗不能及时、准确地反映老年人群肾功能的亚临床改变,需要寻找更为敏感的生物标志物[19]。
综上所述,KDIGO指南虽然将肾脏受损的诊断提前,利于AKI早期救治,但其诊断标准仍是基于SCr和尿量的测定,这2个指标均不能在早期反映肾小球滤过率的变化,也预示早期评价和早期诊断的体系仍不完善。由于细胞损伤早于临床表现,要想更好地实现老年人AKI的早期诊断,需要寻找新的、更为敏感的生物标志物。作为单中心的回顾性队列研究,本研究尚存在一些不足。(1)本中心患者群体主要是退休人员,以高龄老年男性为主,接受治疗的女性较少,只能代表近年来我院老年患者AKI发生情况;而且本中心医疗资源优越,设备精良,可能对结论产生一定程度的偏倚。(2)由于很多科室对尿量的数据记录并不完整,AKI诊断标准只采用SCr标准,这在一定程度上可能会造成AKI漏诊。(3)观察时间只有3个月,且观察对象为平均近87岁的高龄老年人,基础疾病多,一般情况差,多种综合因素会影响对预后分析的精准性。
[1] 李青霖, 王小丹, 赵锰. 高龄老年患者急性肾损伤后肾功能恢复调查及危险因素分析: 652例报告[J]. 中华老年多器官疾病杂志, 2017, 16(11): 801-806. DOI: 10.11915/j.issn.1671-5403.2017.11.187.
Li QL, Wang XD, Zhao M. Outcomes of renal function and risk factors in elderly patients with acute kidney injury: analysis of 652 cases[J]. Chin J Mult Organ Dis Elderly, 2017, 16(11): 801-806. DOI: 10.11915/j.issn.1671-5403.2017.11.187.
[2] Bellomo R, Ronco C, Kellum JA,etal. Acute renal failure-definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group[J]. Crit Care, 2004, 8(4): R204-R212. DOI: 10.1186/cc2872.
[3] Mehta RL, Kellum JA, Shah SV,etal. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury[J]. Crit Care, 2007, 11(2): R31. DOI: 10.1186/cc5713.
[4] Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO clinical practice guideline for acute kidney injury[J]. Kidney Int Suppl, 2012, 2(1): 1-138. DOI: 10.1038/kisup.2012.1.
[5] Levin A, Stevens PE. Summary of KDIGO 2012 CKD Guideline: behind the scenes, need for guidance, and a framework for moving forward[J]. Kidney Int, 2014, 85(1): 49-61. DOI: 10.1038/ki.2013.444.
[6] Levey AS, Stevens LA, Schmid CH,etal. A new equation to estimate glomerular filtration rate[J]. Ann Intern Med, 2009, 150(9): 604-612.
[7] James M, Bouchard J, Ho J,etal. Canadian Society of Nephrology commentary on the 2012 KDIGO clinical practice guideline for acute kidney injury[J]. Am J Kidney Dis, 2013, 61(5): 673-685. DOI: 10.1053/j.ajkd.2013.02.350.
[8] 蔡广研, 卜茹. 急性肾损伤概念和诊断标准的变迁[J]. 中华肾病研究电子杂志, 2013, 2(3): 115-119. DOI: 10.3877/cma.j.issn.2095-3216.2013.03.002.
Cai GY, Bu R. Evolution of definition and diagnostic criteria for acute kidney injury[J]. Chin J Kidney Dis Invest(Electron Ed), 2013, 2(3): 115-119. DOI: 10.3877/cma.j.issn.2095-3216.2013.03.002.
[9] Pan HC, Chien YS, Jenq CC,etal. Acute kidney injury classification for critically Ⅲ cirrhotic patients: a comparison of the KDIGO, AKIN, and RIFLE classifications[J]. Sci Rep, 2016, 17: 23022. DOI: 10.1038/srep23022.
[10] Yang L, Xing G, Wang L,etal. Acute kidney injury in China: a cross-sectional survey[J]. Lancet, 2015, 386(10002): 1465-1471. DOI: 10.1016/S0140-6736(15)00344-X.
[11] Xu X, Nie S, Liu Z,etal. Epidemiology and clinical correlates of AKI in Chinese hospitalized adults[J]. Clin J Am Soc Nephrol, 2015, 10(9): 1510-1518. DOI: 10.2215/CJN.02140215.
[12] Thongprayoon C, Cheungpasitporn W, Srivali N,etal. The impact of fluid balance on diagnosis, staging and prediction of mortality in critically ill patients with acute kidney injury[J]. J Nephrol, 2016, 29(2): 221-227. DOI: 10.1007/s40620-015-0211-3.
[13] Choi JS, Kim YA, Kim MJ,etal. Relation between transient or persistent acute kidney injury and long-term mortality in patients with myocardial infarction[J]. Am J Cardiol, 2013, 112(1): 41-45. DOI: 10.1016/j.amjcard.2013.02.051.
[14] Siew ED, Matheny ME, Ikizler TA,etal. Commonly used surrogates for baseline renal function affect the classification and prog-nosis of acute kidney injury[J]. Kidney Int, 2010, 77(6): 536-542. DOI: 10.1038/ki.2009.479.
[15] Pickering JW, Endre ZH. Back-calculating baseline creatinine with MDRD misclassifies acute kidney injury in the intensive care unit[J]. Clin J Am Soc Nephrol, 2010, 5(7): 1165-1173. DOI: 10.2215/CJN.08531109.
[16] Broden CC. Acute renal failure and mechanical ventilation: reality or myth?[J]. Crit Care Nurse, 2009, 29(2): 62-75. DOI: 10.4037/ccn2009267.
[17] Wiedermann CJ, Wiedermann W, Joannidis M. Hypoalbuminemia and acute kidney injury: a meta-analysis of observational clinical studies[J]. Intensive Care Med, 2010, 36(10): 1657-1665. DOI: 10.1007/s00134-010-1928-z.
[18] Wen J, Cheng Q, Zhao J,etal. Hospital-acquired acute kidney injury in Chinese very elderly persons[J]. J Nephrol, 2013, 26(3): 572-579. DOI: 10.5301/jn.5000182.
[19] Chao CT, Tsai HB, Lin YF,etal. Acute kidney injury in the elderly: only the tip of the iceberg[J]. J Clin Gerontol Geriatr, 2014, 5(1): 7-12. DOI: 10.1016/j.jcgg.2013.04.002.
