14-3-3η蛋白的生物信息学分析及原核表达
2018-03-24安冬洁魏调霞高春辰曹秀丽赵俊龙秦鸿雁
安冬洁,魏调霞,高春辰,曹秀丽,赵俊龙,秦鸿雁
(空军军医大学基础医学部遗传学与发育生物学教研室,西安 710032)
14-3-3蛋白是一类广泛表达的酸性调控蛋白家族,其在哺乳动物中存在7种亚型(β,ε,η,γ,τ,ζ和σ)[1],且不同亚型间氨基酸顺序具有高度的一致性和保守性[2]。14-3-3蛋白通常以同源或异源二聚体和靶蛋白通过特定的磷酸化基序相互作用[3],通过改变靶蛋白细胞亚定位、 磷酸化状态和活化状态来参与许多重要的生命过程[2],包括转录翻译、细胞内信号转导、蛋白运输、细胞周期和细胞凋亡等[4,5]。
单核巨噬细胞分布在体内各组织器官当中,在天然免疫、系统代谢、血管生成、恶性肿瘤中具有重要的调控作用[6]。不同的微环境信号刺激下,巨噬细胞可以发生表型和功能的改变,分为经典活化的M1型巨噬细胞和替代活化的M2型巨噬细胞。M1型巨噬细胞高表达肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、IL-1等促炎因子,具有抗菌抗肿瘤的作用;M2型巨噬细胞则高表达精氨酸酶1(arginase 1)、类几丁质酶3样分子3(chitinase 3-like 3,Ym1)、IL-10、甘露糖受体(Mrcl)等,具有抗炎促肿瘤和促进组织修复的功能[7]。研究表明,14-3-3对巨噬细胞功能的活化和生存起着重要的作用,已报道的亚型主要有14-3-3ζ、14-3-3β和14-3-3ε。在炎性细胞因子干扰素-γ(interferon-γ,INF-γ)的刺激下,14-3-3ζ通过调节coronin 1蛋白亚细胞定位来调控巨噬细胞吞噬功能[8]。上皮性卵巢癌及阿尔茨海默病(Alzheimer disease,AD)中相关巨噬细胞14-3-3ζ和14-3-3ε表达异常升高[9,10],提示14-3-3可能通过改变巨噬细胞的功能参与调控疾病的发生发展。研究发现[11],14-3-3η亚型在脂肪组织巨噬细胞M2型极化中扮演重要角色,但是其具体分子机制尚不明确。
本研究在探究不同极化类型巨噬细胞中14-3-3η mRNA表达水平差异的基础上,对其进行生物信息学分析,构建小鼠14-3-3η基因的原核表达载体后诱导表达,得到含有谷胱甘肽-S-转移酶(glutathione S-transferase,GST)标签的14-3-3η蛋白,为今后研究14-3-3蛋白对巨噬细胞功能的作用奠定实验基础。
1 材料与方法
1.1 材料
原核表达载体pGEX-4T-3、大肠杆菌DH5α和BL21菌株(空军军医大学基础医学部遗传学与发育生物学教研室);胰化蛋白胨、酵母提取物和琼脂粉(Oxoid公司);14-3-3抗体(Santa Cruz公司);辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔IgG(博士德公司);rTaq酶、限制性内切酶、连接酶、DNA marker、蛋白预染maker、质粒提取试剂盒、胶回收试剂盒(TaKaRa公司);HiScript Ⅱ Q RT SuperMix for qRT-PCR和ChamQTMSYBR@qPCR Master Mix(Vazyme公司);GST标签蛋白纯化试剂盒(碧云天生物技术公司);异丙基硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG;科昊生物)。
1.2 方法
1.2.1 RNA提取 野生型C57BL/6小鼠骨髓原代巨噬细胞中加入TRIzol,静置5 min后加入氯仿震荡离心,上清加入异丙醇沉淀RNA,用75%乙醇洗2遍RNA,干燥后加入RNase free ddH2O溶解,定量。
1.2.2 qRT-PCR 每个样品取1000 ng RNA反转录,总体系20 μl,4 μl反转录Mix,剩余体积用RNaes free ddH2O补平。反应条件为37℃ 30 min,85℃ 15 s。以其作模板进行qRT-RCR(ABI 7500),反应条件:95℃ 30 s,96℃ 5 s,60℃ 34 s,β-actin作为内参基因,其中14-3-3η上游引物序列为5’-ACCATGGCAGATGGGAATGAG-3’,下游引物序列为5’-GGTAGCGGTAGTAATCGCCC-3’;β-actin上游引物序列为5’-CATCCGTAAAGACCTCTATGCCAAC-3’,下游引物序列为5’-ATGGAGCCACCGATCCACA-3’。
1.2.3 pGEX-4T-3-14-3-3η的构建 根据小鼠14-3-3η基因编码区序列设计扩增引物,上下游引物分别加入EcoRⅠ和SalⅠ酶切位点,上游引物:5’-CGGAATTCAATGGGGGATCGAGAGCAGCT-3’,下游引物:5’-GCGTCGACTCAGTTGCCTTCTCCTGCTTCTT-3’;以小鼠原代巨噬细胞cDNA为模板进行扩增,PCR反应条件:95℃ 5 min,95℃ 30 s,55℃ 30 s,72℃ 1 min,共35个循环;72℃延伸10 min。扩增好的14-3-3η基因进行琼脂糖凝胶电泳,胶回收PCR产物后用EcoRⅠ和SalⅠ 双酶切,连接pGEX-4T-3载体。连接产物转化感受态DH5α,37℃培养过夜挑取单克隆,37℃摇菌16 h,提取质粒,进行酶切鉴定和测序。
1.2.4 原核表达载体pGEX-4T-3-14-3-3η的小量诱导表达 测序正确的质粒转化入大肠杆菌BL21中,挑取单克隆37℃摇菌过夜,次日以1∶100的比例转接到4 ml LB培养基中,37℃振荡培养到菌液A600 nm达到0.6~1.0时加入IPTG诱导表达,37℃ 5 h。 收集菌液,经SDS-PAGE考马斯亮蓝染色法检测。
1.2.5 GST-14-3-3η 蛋白的纯化 按照1∶100的比例接种菌液到100 ml培养液中,37℃常规培养至菌液A600 nm值达到0.6~1.0,加入IPTG至终浓度为0.2 mmol/L,37℃诱导表达5 h。收集菌液至离心管中,离心收集沉淀。加入裂解缓冲液重悬菌体,冰上超声裂解,收集上清,加入GST-tag Purification Resin,4℃孵育60 min,将混合物装入亲和层析空柱管中,洗柱5次后洗脱目的蛋白,二辛可宁酸(bicinchoninic acid,BCA)法对纯化蛋白进行定量后,用SDS-PAGE考马斯亮蓝染色进行鉴定。
1.2.6 融合蛋白Western blotting分析 取15 μg融合蛋白行SDS-PAGE凝胶电泳,恒流170 mA转聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)2 h,脱脂牛奶封闭2 h,一抗为兔源14-3-3抗体,4℃孵育过夜,二抗为HRP标记的羊抗兔抗体,37℃孵育1 h后,使用3,3-二氨基联苯胺(diaminobenzidine,DAB)发光显色,观察目的条带。
1.2.7 14-3-3η蛋白的生物信息学分析 蛋白理化性质预测:ProtParam tool(http://web.expasy.org/protparam/);二级结构预测:SOPMA (http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html);疏水性分析由ProtScale(http://web.expasy.org/protscale/)软件完成。
1.3 统计学处理
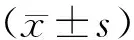
2 结 果
2.1 qRT-PCR检测14-3-3η在原代巨噬细胞不同极化状态下mRNA表达水平
培养野生型C57BL/6小鼠骨髓原代巨噬细胞,
脂多糖(lipopolysaccharides,LPS)和INF-γ诱导M1型极化,IL-4诱导M2型极化。提取RNA,反转录后用qRT-PCR检测14-3-3η表达水平。结果表明:14-3-3η在M1型巨噬细胞中表达量降低,在M2型巨噬细胞中表达量升高,差异具有统计学意义(P<0.05;图1),提示14-3-3η可能对巨噬细胞极化起作用。

图1 14-3-3η mRNA的表达
Compared with control,*P<0.05,**P<0.01; compared with M1,##P<0.01
2.2 14-3-3η蛋白二级结构预测
采用SOPMA对14-3-3η蛋白的二级结构进行预测,结果以α-螺旋和无规则卷曲为主,α-螺旋占62.60%,无规则卷曲占29.27%,另外有11.38%的延伸链和5.69%的β转角,其中α-螺旋对蛋白质骨架具有稳定作用,无规则卷曲决定了蛋白质的功能,表明14-3-3η蛋白结构具有较高的稳定性(图2)。
2.3 14-3-3η蛋白理化性质分析
使用ProtParam tool分析14-3-3η蛋白序列,分子量为28.2 ku,理论等电点为4.81,其中酸性氨基酸总数(天冬氨酸+谷氨酸)为45个,碱性氨基酸总数(精氨酸+赖氨酸)为32个。用ProtScale程序对14-3-3η蛋白进行疏水性分析,纵坐标0之上为疏水区,0之下为亲水区,可知14-3-3η第100位氨基酸的疏水系数最高(1.900);第237位氨基酸的疏水系数最低(-2.600)。疏水性氨基酸在肽链中均匀分布,14-3-3η蛋白的疏水系数为-0.607,疏水性较差。一般疏水性较强的分子原核表达时易形成包涵体,此时需采用促进目的蛋白可溶性表达菌株,而14-3-3η疏水性较差,因此我们采用GST可溶标签载体构建14-3-3η原核表达载体,并选用大肠杆菌BL21菌株进行原核表达。

图2 14-3-3η蛋白二级结构预测
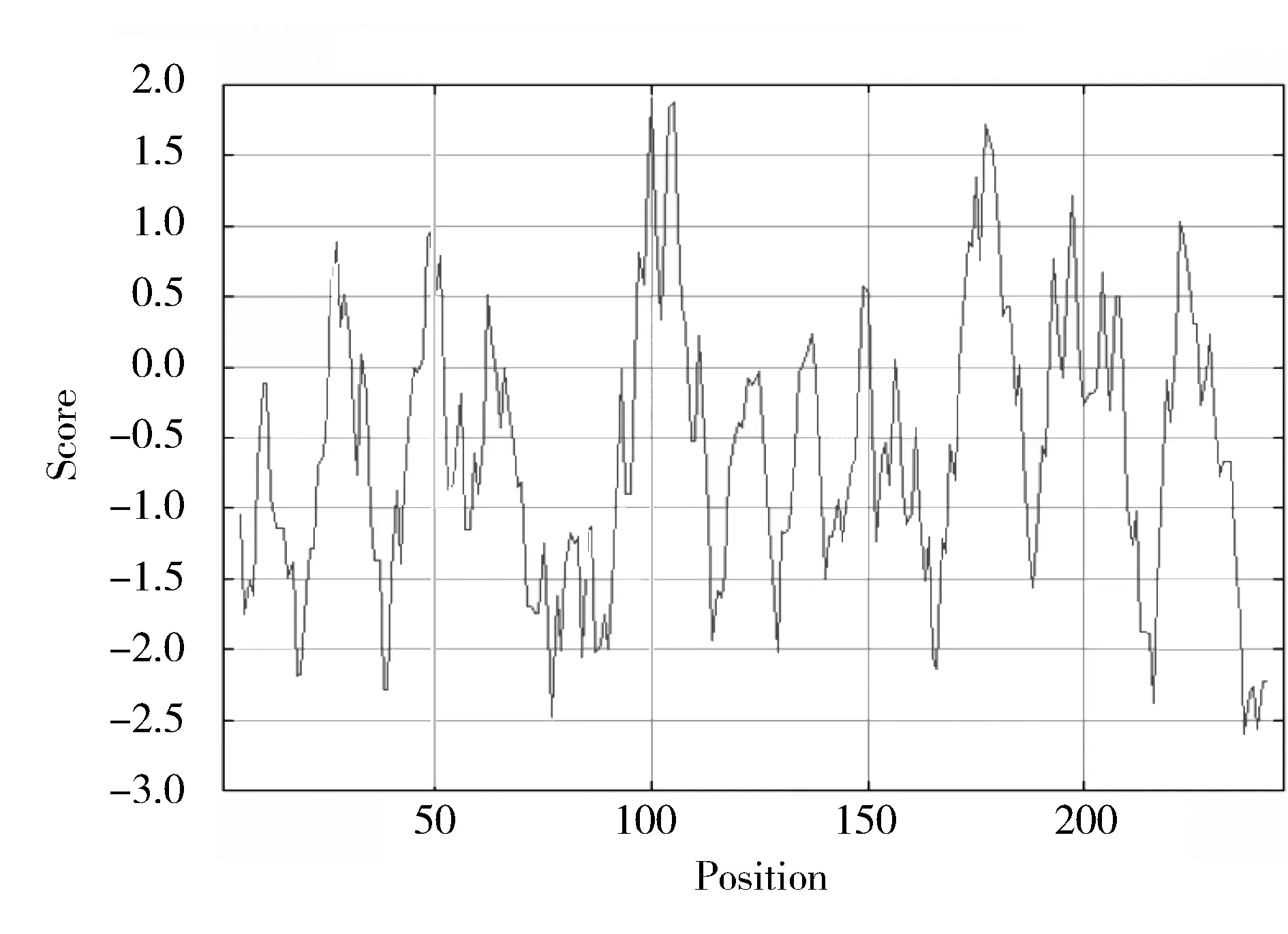
图3 14-3-3蛋白的疏水性分析
2.4 14-3-3η基因的扩增
以小鼠骨髓来源巨噬细胞cDNA为模板扩增目的序列,特异性扩增出14-3-3η(744 bp),与预期片段大小一致(图4)。
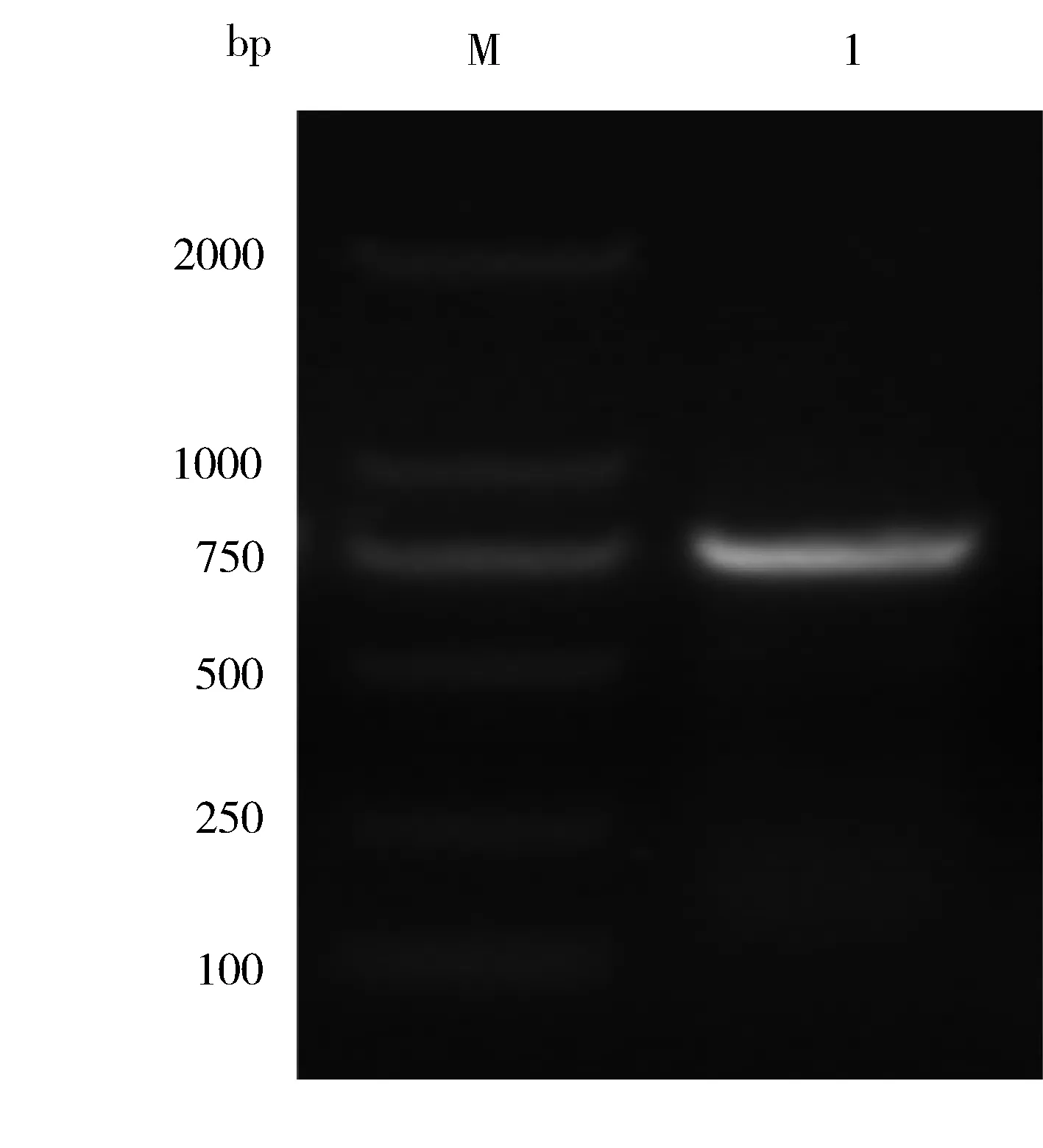
图4 目的基因14-3-3η的PCR扩增
2.5 重组质粒pGEX-4T-3-14-3-3η的构建及鉴定
将扩增出的目的片段与pGEX-4T-3空载体经EcoRⅠ和SalⅠ双酶切后连接,转化入大肠杆菌后挑取单克隆摇菌,提取质粒。pGEX-4T-3-14-3-3η质粒经EcoRⅠ和SalⅠ 双酶切后,可见744 bp条带,符合目的片段大小(图5)。测序结果经比对后同14-3-3η序列一致,提示重组质粒构建成功(图6)。
图5 重组载体pGEX-4T-3-14-3-3η双酶切鉴定结果
2.6 重组表达质粒pGEX-4T-3-14-3-3η的诱导表达
将pGEX-4T-3-14-3-3η重组质粒转化入大肠杆菌BL21菌株中,37℃过夜培养后挑取单克隆活化菌液。首先摸索诱导表达时最佳IPTG浓度,当菌液A600 nm值达到0.6时加入不同终浓度IPTG诱导融合蛋白GST-14-3-3η的表达,融合蛋白预期大小约55 ku。选取最佳IPTG浓度,再用不同温度和不同时间诱导融合蛋白GST-14-3-3η的表达,使融合蛋白尽量表达在细菌裂解液上清液里,收集菌液,裂解后经SDS-PAGE考马斯亮蓝染色法检测,结果表明可溶性融合蛋白最佳表达条件为IPTG浓度0.1 mmol/L,25℃诱导表达16 h(图7)。
2.7 可溶性融合蛋白GST-14-3-3η的纯化
IPTG诱导表达后的菌液经超声裂解,离心后收集上清,按照GST标签蛋白纯化试剂盒操作步骤对融合蛋白GST-14-3-3η进行纯化。纯化蛋白用BCA法进行蛋白定量,蛋白浓度为6 mg/ml,行SDS-PAGE电泳,考马斯亮蓝染色和Western blotting(使用14-3-3抗体)鉴定结果显示GST-14-3-3η融合蛋白得到了较高效的纯化(图8)。
3 讨 论
组织定居巨噬细胞在组织稳态维持、疾病损伤修复方面起着关键的作用[12,13]。在不同的细胞因子刺激下,巨噬细胞可以发生表型和功能的转变,其中M1型巨噬细胞由Toll样受体(Toll-like receptor,TLR)配体蛋白、INF-γ活化,M2型巨噬细胞由IL-4、IL-13、转化生长因子-β(transforming growth factor-β,TGF-β)等诱导活化,分别调控TH1和TH2型免疫应答[7]。巨噬细胞的极化则依赖于体内多种信号通路及信号分子在转录水平或翻译后水平的调控[14]。

图6 pGEX-4T-3-14-3-3η部分测序结果

图7 GST和GST-14-3-3η融合蛋白在大肠杆菌中的诱导表达
A: lysis of whole bacteria solution (1: empty vector; 2: empty vector induced by 0.5 mmol/L IPTG; 3: GST-14-3-3η; 4-8: GST-14-3-3η induced by 0.1, 0.2, 0.5, 0.8, 1.0 mmol/L IPTG respectively); B: supernatant of bacteria lysis (1-5: expression induction under the condition of 16℃ 16 h, 20℃ 16 h, 25℃ 16 h, 30℃ 16 h, 37℃ 5 h respectively). M: protein marker; GST: glutathione S-transferase; IPTG: isopropyl β-D-1-thiogalactopyranoside

图8 GST-14-3-3η蛋白的纯化
14-3-3蛋白在细胞内可以和蛋白激酶B、叉头族转录因子O等超过200种分子相互作用[15],主要依赖靶蛋白上2种特定的14-3-3结合基序:RSXpS/TXP和RXXXpSXP(pS为磷酸化的丝氨酸,X为任意氨基酸)[1]。由于14-3-3靶蛋白的多样性,14-3-3蛋白在细胞周期、细胞分化、生存、凋亡、迁移当中都起着重要作用[16]。研究表明,外泌体中的14-3-3η通过与细胞膜上配体氨肽酶N(aminopeptidase N,APN)相互作用可以促进单核巨噬细胞IL-1β、IL-6、TNF-α炎性因子的表达,并且促进基质金属蛋白酶(matrix metalloproteinases,MMPs)MMP-1和MMP-9的表达[17]。但是,巨噬细胞本身的14-3-3η对巨噬细胞表型和功能的调控机制尚未知。
本研究分析了14-3-3η亚型在骨髓来源原代巨噬细胞不同极化状态下mRNA表达水平差异,发现14-3-3η在M1型巨噬细胞中表达较低,M2型巨噬细胞中表达较高,据此推测14-3-3η可能参与巨噬细胞的极化。为了进一步探究14-3-3η参与巨噬细胞活化的分子机制,我们拟原核表达GST-14-3-3η蛋白。首先对14-3-3η蛋白氨基酸序列进行生物信息学分析,发现其二级结构中主要为α-螺旋,说明其结构较稳定,并且疏水性较差,推测GST-14-3-3融合蛋白可溶性好,因此选用BL21常规菌株进行原核表达。其后构建pGEX-4T-3-14-3-3η融合表达载体,成功表达并纯化出较高纯度的GST-14-3-3融合蛋白,为后续在巨噬细胞中使用GST-pull-down实验手段研究14-3-3相互作用分子以及其在巨噬细胞活化和生存上的生物学功能奠定实验基础。
[1] Sluchanko NN, Tugaeva KV, Greive SJ,etal. Chimeric 14-3-3 proteins for unraveling interactions with intrinsically disordered partners[J]. Sci Rep, 2017, 7(1): 12014. DOI: 10.1038/s41598-017-12214-9.
[2] Aguilera C, Fernández-Majada V, Inglés-Esteve J,etal. Efficient nuclear export of p65-IκBα complexes requires 14-3-3 proteins[J]. J Cell Sci, 2006, 119(17): 3695-3704. DOI: 10.1242/jcs.03086.
[3] Kaplan A, Bueno M, Fournier AE. Extracellular functions of 14-3-3 adaptor proteins[J]. Cell Signal, 2017, 31: 26-30. DOI: 10.1016/j.cellsig.2016.12.007.
[4] Obsil T, Obsilova V. Structural basis of 14-3-3 protein functions[J]. Semin Cell Dev Biol, 2011, 22(7): 663-672. DOI: 10.1016/j.semcdb.2011.09.001.
[5] Aghazadeh Y, Papadopoulos V. The role of the 14-3-3 protein family in health, disease, and drug development[J]. Drug Discov Today, 2016, 21(2): 278-287. DOI: 10.1016/j.drudis.2015.09.012.
[6] Zhou D, Huang C, Lin Z,etal. Macrophage polarization and function with emphasis on the evolving roles of coordinated regulation of cellular signaling pathways[J]. Cell Signal, 2014, 26(2): 192-197. DOI: 10.1016/j.cellsig.2013.11.004.
[7] Liu YC, Zou XB, Chai YF,etal. Macrophage polarization in inflammatory diseases[J]. Int J Biol Sci, 2014, 10(5): 520. DOI: 10.7150/ijbs.8879.
[8] BoseDasgupta S, Moes S, Jenoe P,etal. Cytokine-induced macro-pinocytosis in macrophages is regulated by 14-3-3ζ through its interaction with serine-phosphorylated coronin 1[J]. FEBS J, 2015, 282(7): 1167-1181. DOI: 10.1111/febs.13214.
[9] Kobayashi R, Deavers M, Patenia R,etal. 14-3-3 zeta protein secreted by tumor associated monocytes/macrophages from ascites of epithelial ovarian cancer patients[J]. Cancer Immunol Immunother, 2009, 58(2): 247-258. DOI: 10.1007/s00262-008-0549-7.
[10] Eufemi M, Cocchiola R, Romaniello D,etal. Acetylation and phosphorylation of STAT3 are involved in the responsiveness of microglia to beta amyloid[J]. Neurochem Int, 2015, 81: 48-56. DOI: 10.1016/j.neuint.2015.01.007.
[11] Sreedhar R, Arumugam S, Thandavarayan RA,etal. Role of 14-3-3η protein on cardiac fatty acid metabolism and macrophage polarization after high fat diet induced type 2 diabetes mellitus[J]. Int J Biochem Cell Biol, 2017, 88: 92-99. DOI: 10.1016/j.biocel.2017.05.009.
[12] Mantovani A, Biswas SK, Galdiero MR,etal. Macrophage plasticity and polarization in tissue repair and remodelling[J]. J Pathol, 2013, 229(2): 176-185. DOI: 10.1002/path.4133.
[13] Mantovani A, Locati M. Tumor-associated macrophages as a paradigm of macrophage plasticity, diversity, and polarization[J]. Arterioscl Throm Vas, 2013, 33(7): 1478-1483. DOI: 10.1161/ATVBAHA.113.300168.
[14] Zhou D, Yang K, Chen L,etal. Promising landscape for regulating macrophage polarization: epigenetic viewpoint[J]. Oncotarget, 2017, 8(34): 57693. DOI: 10.18632/oncotarget.17027.
[15] Mori M, Vignaroli G, Botta M. Small molecules modulation of 14-3-3 protein-protein interactions[J]. Drug Discov Today Technol, 2013, 10(4): e541-e547. DOI: 10.1016/j.ddtec.2012.10.001.
[16] 梨星, 霍聪, 刘艳, 等. 双去甲氧基姜黄素对星型孢菌素诱导心肌细胞凋亡的影响[J]. 中华老年多器官疾病杂志, 2017, 16(1): 56-60. DOI: 10.11915/j.issn.1671-5403.2017.01.013.
Li X, Huo C, Liu Y,etal. Effect of bisdemethoxycurcumin on staurosporine-induced apoptosis in cardiomyocytes[J]. Chin J Mult Organ Dis Elderly, 2017, 16(1): 56-60. DOI: 10.11915/j.issn.1671-5403.2017.01.013.
[17] Tollenaere MA, Villumsen BH, Blasius M,etal. p38- and MK2-dependent signalling promotes stress-induced centriolar satellite remodellingvia14-3-3-dependent sequestration of CEP131/AZI1[J]. Nat Commun, 2015, 6: 10075. DOI: 10.1038/ncomms10075.
