高龄男性血清25羟基维生素D水平与LUTS相关性调查研究
2018-03-23许婷媛彭华生常彬宾钟景页
许婷媛,张 汝,彭华生,孙 瑛,常彬宾,吴 婉,钟景页
引起老年男性下尿路症状(LUTS)常见的原因主要是前列腺增生及膀胱逼尿肌受损,尤其高龄患者,发病率更高。LUTS症状包括尿频、尿急、尿失禁、排尿不畅等,常引起尿路感染、皮肤蜂窝组织炎、跌倒风险增高,直接影响患者日常活动、睡眠及情绪等。目前临床主要采用药物治疗,包括抗雄激素、α受体阻断剂、M受体阻断剂及中成药治疗,但依然不能很好地缓解LUTS给患者带来的痛苦。近年研究表明,维生素D受体(VDR)激动剂可抑制前列腺增生[1],从而改善前列腺增生引起的LUTS症状,且研究发现VDR存在于泌尿生殖窦来源的组织,如前列腺及膀胱[2-3]。因此,推测血清维生素D水平可能影响前列腺及膀胱功能,故探讨高龄患者血清25羟基维生素D[25(OH)D]水平及与前列腺增生及膀胱逼尿肌功能下降的相关性为本试验的主要目的。
1 对象与方法
1.1 研究对象 选择2016年9月~2017年6月在医院住院的年龄≥80岁男性LUTS患者205例,LUTS症状包括尿频、尿急、尿失禁、尿等待、尿线变细、射程缩短、排尿时间延长、排尿后尿淋漓等,符合上述症状≥1项者纳入本研究,排除恶性肿瘤、严重心肝肾功能不全、急性感染、原发性甲状腺及甲状旁腺功能异常及近半年服用维生素D药物者。患者年龄80~101(88.3+12.5)岁。按年龄将患者分为 3 组,80~85 岁组、86~90岁组和>90岁组。
1.2 资料收集 在患者入院后,由专门医务人员对研究对象进行病史询问及体格检查,并做好记录。
1.3 检测指标
1.3.1 生化指标 于入院次日抽取患者空腹外周静脉血,检测相关生化指标,包括糖化血红蛋白、血脂、肾功、血钙、前列腺特异性抗原、血清25(OH)D等。
1.3.2 生活质量 采用国际前列腺症状评分法(IPSS)评定患者下尿路梗阻情况,IPSS评分表有7个问题,每个问题0~5分,将所得分值相加即为总分值,分值越大下尿路症状越重。采用生活质量测定量表(QOL)评定下尿路症状对患者生活质量的影响,QOL包括7个选择,分值越高,对患者生活质量影响越大。
1.3.3 前列腺体积 由本院超声科技师专人检查,使用彩色超声仪,探头经腹部分别测量前列腺纵经(A)、横径(B)及前后径(C),计算前列腺体积(PV),PV(ml)=A×B×C×0.52。
1.3.4 排尿期膀胱逼尿肌压力(Pdet) 采用USD64-Ⅲ型尿动力学检测仪(美国Laborie公司)行尿动力学检测,记录 Pdet。 Pdet<40 cmH20 为收缩力下降。
1.4 统计学方法 应用SPSS13.0统计软件分析数据,计量资料以±s表示,多组间比较采用方差分析和两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 基 线 资 料 分 析 3组 BMI、HbA1c、LDL-C、BUN、CR、Ca、fPSA/PSA 值比较均无统计学差异(P> 0.05);>90岁组血清25(OH)D水平和Pdet值显著低于80~85组和86~90岁组(P<0.05);3组QOL和IPSS间有显著差异 (P<0.05), 均以>90 岁组最高,86~90 岁组次之,80~85 岁组最低。见表1。
2.2 25(OH)D正常与否两组LUTS相关指标比较 按照25(OH)D水平正常与否将患者分为正常组与降低组(≥50 nmol/L为正常组,<50 nmol/L为降低组)。两组fPSA/PSA 比较无统计学差异(P>0.05);血清 25(OH)D 降低组 QOL、IPSS、PV 值显著大于正常组(P< 0.05),而 Pdet降低小于正常组(P<0.05)。各年龄组按血清25(OH)D正常与否再分为两个亚组,同组内比较,fPSA/PSA无统计学差异(P>0.05)。80~85岁组内比较,降低组IPSS升高,而 Pdet降低(P<0.05)。86~90岁内比较,降低组PV升高,Pdet降低(P < 0.05);>90 岁组内比较,降低组 Pdet降低(P <0.05)。 见表 2。
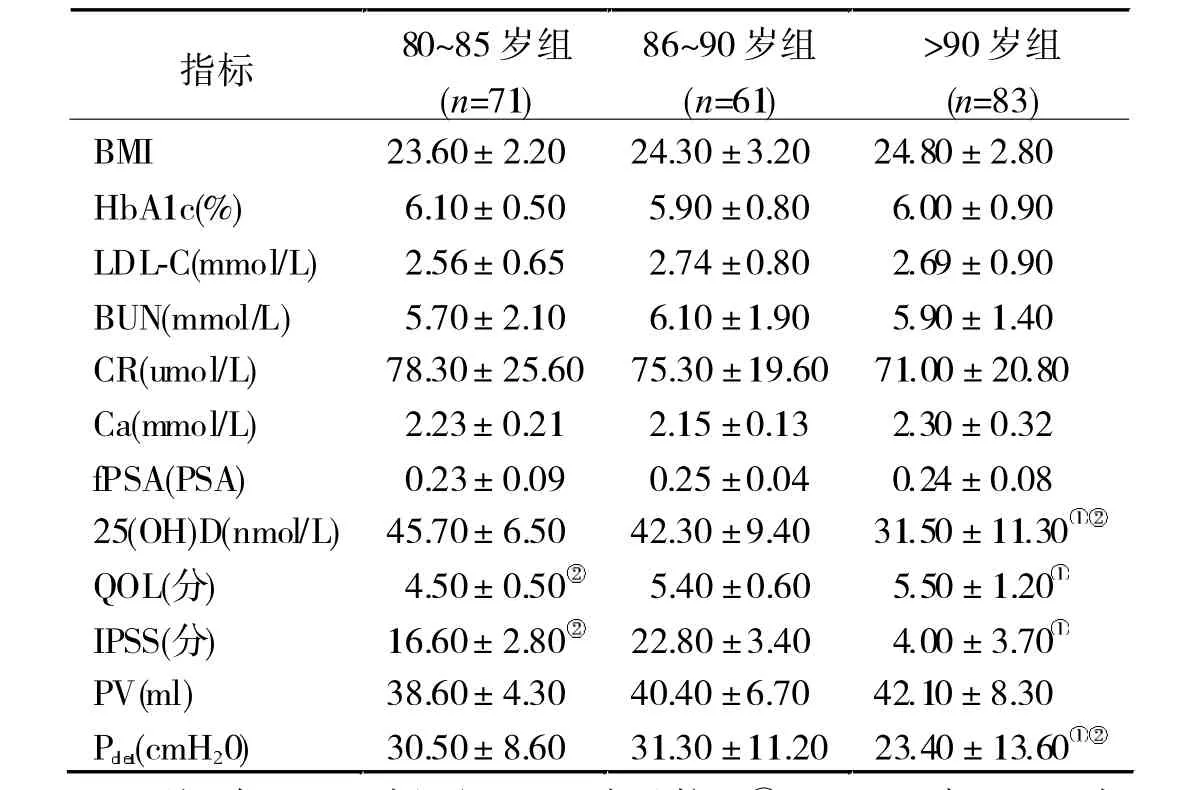
表13 组基线资料及LUTS相关指标比较
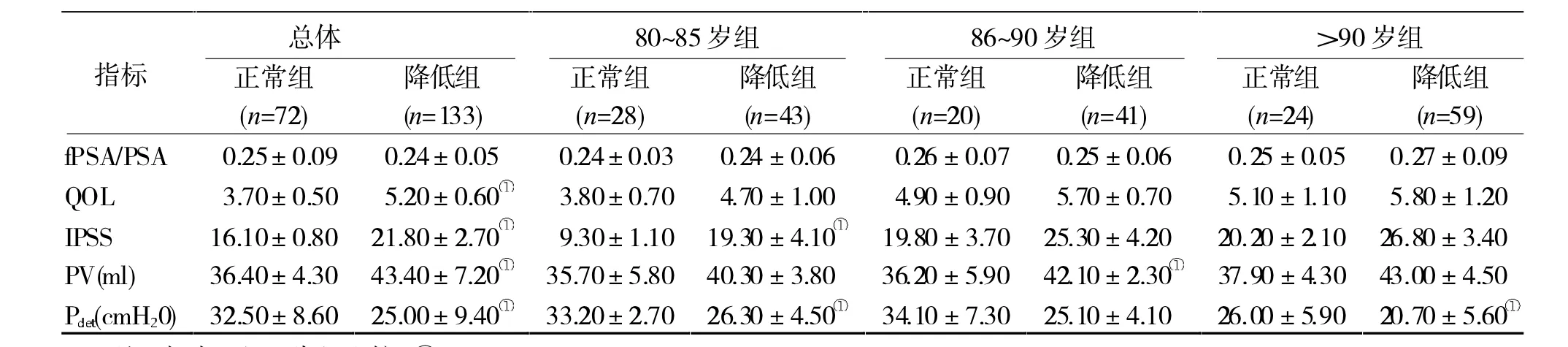
表2 25(OH)D正常与否两组LUTS相关指标比较
3 讨论
本研究发现,随着医疗水平提高,医务人员对患者慢病知识的宣教,使其依从性提高,故在高龄老年人群中血压、血糖、血脂控制较理想,各基线资料比较无差异。但针对LUTS症状的控制依然不满意,从调查结果可以看出,患者LUTS症状随着年龄增长愈加严重,且影响其生活质量。与此同时,前列腺体积持续增大,膀胱逼尿肌不稳定及排尿期压力降低,针对以上问题目前药物治疗效果有限。
近年发现,维生素D受体存在于前列腺及膀胱组织中,服用维生素D后在体内经过羟化转变成活性成分1.25(OH)2D3,可调节机体细胞生长及分化,同时均有免疫调节及抗炎作用。已有研究表明,1.25(OH)2D3可以保护前列腺细胞免受氧化应激反应所导致的细胞死亡,改善由年龄因素引起的前列腺增生[4]。维生素D对膀胱及前列腺的保护机制主要包括:(1)前列腺增生导致尿路梗阻常伴有膀胱壁代偿性肥厚,使得收缩力下降,其中生长因子参与其增生肥厚。有学者发现,1.25(OH)2D3可明显减少成纤维细胞生长因子与其相应受体结合,阻滞细胞进入分裂期,切断前列腺增生信号通路[3]。(2)膀胱壁肥厚常产生无意识活动,在储尿期表现为尿失禁,在排尿期表现为膀胱压力降低,排空能力减弱。1.25(OH)2D3可以通过影响肌动蛋白和肌球蛋白相互作用,改变其平滑肌细胞的收缩,抑制其过度活动,但不会影响逼尿肌的正常功能[5]。 (3)1.25(OH)2D3可调节多种炎症因子的表达,包括前炎症细胞因子IL-8、IL-1、IL-2、TNF-α、抗炎症细胞因子 IL-6、IL-10。 通过对以上细胞因子的调控,可促进前列腺细胞的凋亡,对抑制前列腺增生起到重要作用[6]。从本试验结果也可以看出,随着年龄增长,血清25(OH)D水平随之降低,前列腺体积持续增加,排尿期膀胱逼尿肌压力Pdet降低,LUTS症状也更显著,验证了Bao等[4]提出的1.25(OH)2D3参与了与年龄相关的良性前列腺增生。在同年龄段内,25(OH)D<50 nmol/L患者前列腺体积及LUTS症状更显著;而25(OH)D≥50 nmol/L的患者前列腺体积相对较小,LUTS症状较轻。虽然可能由于样本量较小,结果没有统计学差异,但可以根据数据分析发现其变化趋势。除此之外,Pdet在各组内比较有统计学差异。Morelli等[5]认为25(OH)D可以改变膀胱逼尿肌过度活动,而不影响逼尿肌本身的收缩力,但本试验发现,Pdet随着 25(OH)D水平的降低而降低,可能是随着25(OH)D降低,加速前列腺增生,促进了尿路梗阻,长期梗阻使得膀胱内压力增加,损害逼尿肌功能,出现不自主收缩及逼尿肌收缩力降低,患者易发生尿潴留[7-8],因此认为25(OH)D缺乏可以降低膀胱逼尿肌收缩力。
综上所述,25(OH)D水平与高龄男性患者年龄相关,25(OH)D水平的下降可能参与了前列腺增生及膀胱逼尿肌收缩力下降而导致的LUTS的发生。
[1] Collie E,Rigatti P,Montotsi F,et al.BXL628,a novel vitamin D3 analog arrests prostate growth in patentswith benign prostatic hyperplasia:a randomized clinical trial[J].Eururol,2006,49(1):82-86.
[2] Crescioli C,Maggi M,Luconi M,et al.Vitamin D3 analogue inhibits keratinocyte growth factor signaling and induces apoptosis in human prostate cancer cells[J].Prostate,2002,50:15-26.
[3] Crescioli C,Morellia A,Adorini L,et al.Human bladder as a novel target for vitamin D receptor ligands[J].JClin Endocrinol Metab,2005,90:962-972.
[4] Bao B,Ting Huiju,Hsul Jongwei,et al.Protective role of 1a,25-dihydroxyvitamin D3 against oxidative stress in nonmalignant human prostate epithelial cells [J].Int J Cancer,2008,122:2699-2706.
[5] Morelli A,Vignozzi L,Filippi S,et al.BXL-628,a vitamin D receptor agonist effective in benign prostatic hyperplasia treatment,prevents Rho A activation and inhibits rhoA/Rhokinase signaling in rat and human bladder[J].Prostate,2007,67:234-247.
[6] Sun J,Kong J,Duan Y,et al.Increased NF-B activity in fibroblasts lacking the vitamin D receptor [J].Am J Physiol Endocrinol Metal,2006,291(2):E315-E322.
[7] Strope SA,Yang L,Nepple KG,et al.Population based comparative effectiveness of transurethral resection of the prostate and laser therapy for benign prostatic hyperplasia[J].J Urol,2012,187(4):1341-1345.
[8] Kang YJ,Kim KH,Seo Y,et al.Effect of transurethral resection of the prostate on storage symptoms in patients with benign prostatic hyperplasia of less than 30m l[J].World JMens Health,2013,3(1):64-69.
