NF-κB信号通路在动脉粥样硬化中的作用及机制研究进展
2018-03-23郑学忠万怡轩王清岑
郑学忠,万怡轩,王清岑,王 红
动脉粥样硬化(AS)是心脑血管疾病的关键致病因素,目前认为AS是一种多因素、多步骤的疾病,涉及到氧化性低密度脂蛋白(OX-LDL)、黏附分子、细胞因子、生长因子、炎症细胞、血管内皮细胞 (ECs)和血管平滑肌细胞(VSMCs)等多种因素的相互作用[1-2]。NF-κB信号通路是由细胞因子介导的经典的信号转导通路,不仅参与炎症反应,也调控内皮细胞损伤、氧化应激、平滑肌增殖迁移、血管细胞凋亡等过程。本研究围绕NF-κB信号通路及其抑制剂在AS发生、发展中的作用及其机制进行阐述,以期为AS中的有效干预靶点提供思路。
1 NF-κB信号的组成和传导
NF-κB转录因子只存在于核提取物中,而胞质中的NF-κB 与一种抑制蛋白(IκB)结合存在。 IκB 蛋白家族包括IκBα、IκBβ、IκBγ 等成员,它们都能抑制 NF-κB 的活性并将其滞留在胞质中,位于IκB上游的是IκB激酶复合物(IKK),IKK 复合体由 IKKα、IKKβ、IKKγ 组成 。
应激和损伤时,TNF-α、脂多糖(LPS)等促炎因子能与细胞膜TNF受体结合,最先激活的是IKKα和IKKβ,IKK能特异性的磷酸化IκB的丝氨酸残基,导致NF-κB与IκB解离,NF-κB得以活化,活化的NF-κB进入细胞核,作用于相应基因的启动子,从而介导基因的转录[3](图1)。
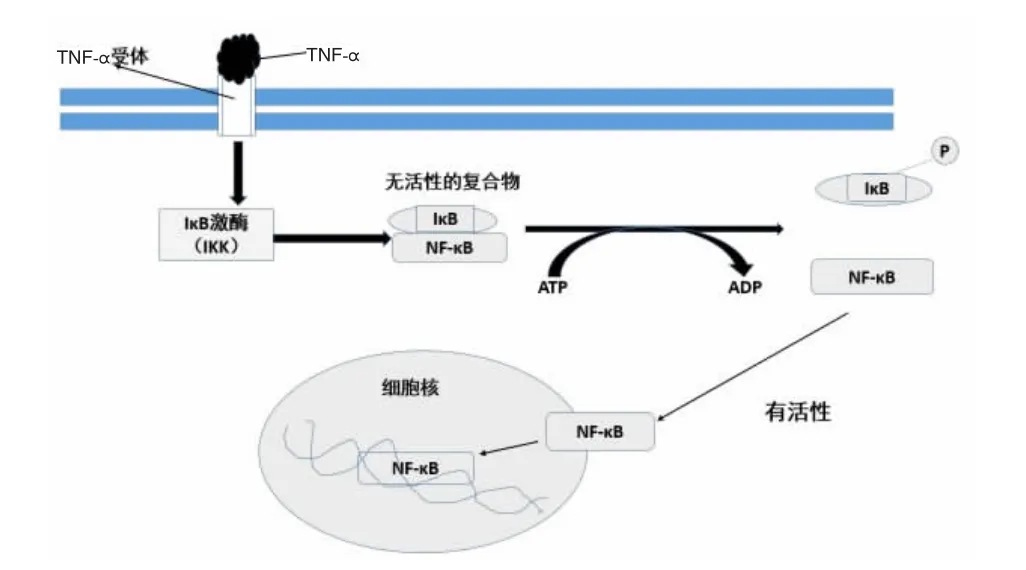
图1 NF-κB信号转导通路
2 NF-κB信号与AS的关系
2.1 NF-κB 与氧化应激 生理条件下,活性氧(ROS)为细胞代谢的产物,可以平衡抗氧化剂分子;在病理情况下,ROS过度积累削弱抗氧化机制,导致了氧化应激性损伤。在AS形成过程中,ECs功能紊乱、巨噬细胞活化、VSMCs增殖和迁移等过程均涉及到ROS的产生[4]。
Sun等[5]研究显示,OX-LDL能诱导VSMCs产生ROS,并通过激活NF-κB信号通路增加低密度脂蛋白受体(LOX-1)的表达;Masai等[6]证实,尿毒素提取物吲哚酚硫酸盐诱导脐静脉内皮细胞产生的NADPH氧化酶源性ROS,并通过NF-κB途径增加MCP-1的表达。其机制为ROS产生过多时能能够激活IKK,使NF-κB抑制蛋白IxB磷酸化,随后NF-κB与IxB分离并转入到细胞核内,启动炎症相关基因的转录[7]。
2.2 NF-κB与炎症 炎症细胞浸润是AS病变的重要特征。炎症细胞向血管壁浸润首先需要黏附到ECs,此过程涉及ECs对黏附分子的表达,如血管细胞黏附分子(VCAM-1)、细胞间黏附分子(ICAM-1)等,而单核细胞趋化蛋白(MCP-1)表达促进单核细胞向ECs的迁移。大量研究表明,激活 NF-κB 信号能显著增加 MCP-1[2]、P-选择素[8]、VCAM-1[9]、ICAM-1[10]的表达。
此外,促炎膜蛋白分子也参与了AS形成,Martin等分析了人颈AS斑块,发现CD74表达量明显比纤维斑块区高;体外实验证实在人VSMCs中CD74分子能够激活NF-κB信号通路增加MCP-1表达[2]。
2.3 NF-κB与ECs损伤 各种刺激因素都可以使ECs结构功能发生损伤,ECs损伤是血管性疾病和AS发病机制中的一个重要的起始步骤[11]。基质相互作用分子1(STIM1)能调节ECs外钙离子内流,增加ECs的通透性。DebRoy等[12]用 LPS诱导 ECs,STIM1表达增加,用 NF-κB 抑制剂处理后STIM1表达降低,并证明了NF-κB信号的激活促使NF-κB和STIM1启动子结合,增加STIM1的表达导致内皮损伤。
在ECs中,OX-LDL、溶血磷脂酸、极低密度脂蛋白、血管紧张素II、葡萄糖、病毒感染、湍流可激活NF-κB信号通路,使促炎因子 TNF-a、IL-1、IL-8、E-选择素、α5β1 整合素蛋白、VCAM-1、ICAM-1 表达增加[13-15]。 NF-κB 信号激活可导致ECs损伤,并促进AS的形成和发展。
2.4 NF-κB与VSMCs的增殖迁移 VSMCs增殖和迁移在AS的发生和进展中发挥重要作用[16]。研究显示,小鼠颈动脉损伤后,激活了NF-κB信号通路,血管中层VSMCs从静态表型向增殖表型转化,并迁移至内膜促进AS内膜增生[17]。NF-κB信号通路的激活,也促进人主动脉平滑肌的增殖[18]。基质金属蛋白酶(MMPs)使细胞外基质(ECM)降解或重塑,它能促进平滑肌的增殖迁移,进而加剧AS的病理过程。而在MMPs中,MMP-9调节平滑肌的增殖迁移最为重要。NF-κB被认为是诱导MMPs表达必须的转录因子。正常情况下,MMP-9在平滑肌细胞中的合成和分泌量很少。在肿瘤坏死因子的刺激下,能激活NF-κB信号通路,使MMP-9表达上调,促进平滑肌增殖和迁移[19-20]。总之,AS中NF-κB信号的激活能促进VSMCs的增殖迁移。
2.5 NF-κB与血管细胞凋亡 在AS斑块中存在着多种细胞的凋亡,如内皮细胞 、平滑肌细胞 、巨噬细胞等。既往证据支持NF-κB信号激活促进内皮细胞、巨噬细胞的凋亡。血清淀粉样蛋白A(SAA)能通过NF-κB信号介导巨噬细胞调亡[21]。Tan等[22]用SAA处理巨噬细胞后导致NF-κB活化,继之Fas蛋白水平上调,降低抗凋亡蛋白BCL-2以及聚腺苷二磷酸-核糖聚合酶水平,并激活Caspase-3凋亡信号通路,导致巨噬细胞调亡。Lee等[23]在小鼠和人ECs中,证实了TNF-α能通过NF-κB信号转导诱导内皮细胞衍生的微粒(EMPs)的产生,沉默TNF受体(TNFR-1)或抑制 NF-κB能减少 TNF-α诱导 EMP生成,产生的EMPs促进促凋亡蛋白分子和黏附分子的表达,进而导致ECs凋亡和血管炎症。
3 NF-κB 信号抑制剂
3.1 抑制氧化应激 长春西汀为一种强效型磷酸二酯酶抑制剂,Zhuang等[24]研究发现,长春西汀能减少IKKα/β、IκBα磷酸化抑制NF-κB的核转位,从而显著抑制ox-LDL诱导的活性氧产生。Xu等[25]研究了苹果多酚(APS)在AS的作用,发现APS处理大鼠主动脉内皮细胞后,抑制了ROS/MAPK/NF-κB信号通路,降低了细胞中ROS的产生,从而抑制氧化应激。表明长春西汀和苹果多酚发挥抗AS的效果是依赖NF-κB信号通路介导的。
3.2 抑制血管炎症 颗粒蛋白生长因子(progranulin)一直被视为炎症过程的一个重要的调节剂,Hwang等[26]用Progranulin处理的人脐静脉内皮细胞,IκB磷酸化水平和NF-kappaB的水平降低,Progranulin能阻断从胞浆到细胞核的易位,并有效抑制脂多糖介导的炎症信号传导;Progranulin能抑制NF-κB结合于相关基因启动子区域,显著减少VCAM-1、ICAM-1、肿瘤坏死因子受体-α和 MCP-1的表达。Hsueh等[27]研究发现,柚皮苷通过NF-κB信号通路抑制TNF-α诱导的人脐静脉内皮VCAM-1、ICAM-1、E-选择素和趋化因子的表达,其机制为柚皮苷抑制IKKα、IKKβ、IκBα 磷酸化,从而减少 NF-κB 的核转位,进而抑制NF-κB介导的炎症反应。
3.3 抑制平滑肌增殖迁移 Cao等[28]研究青蒿素对小鼠平滑肌细胞作用时发现,青蒿素能降低细胞中增殖细胞核抗原、MMP-2、MMP-9、NF-κB p65 的表达,从而抑制平滑肌的增殖迁移,并证实青蒿素通过NF-κB信号通路呈剂量依赖方式明显抑制平滑肌的增殖、迁移。Suh等[29]从海洋动物海绵属中筛选MMP9抑制剂乙酸乙酯提取物(ECC),证实ECC能有效地抑制肿瘤坏死因子诱导的人主动脉平滑肌细胞的迁移。其机制为ECC通过NF-κB信号途径抑制MMP9启动子的活性,从而降低MMP9的表达。
3.4 抑制血管细胞凋亡 细胞毒性物质7-酮胆固醇(7-KC)参与了AS的病理生理过程,它能诱导血管单核细胞/巨噬细胞凋亡,7-KC血清水平升高与稳定型冠心病患者心血管事件、总死亡和复合结局风险增加相关[30]。Tesoriere等[31]用7-KC诱导巨噬细胞IκBα磷酸化水平增加,伴随着NF-κB p65的核转位增加,而加入梨果仙人掌黄素(indicaxanthin)后,NF-κB 活化显著减少。 Indicaxanthin通过阻断NF-κB激活,抑制了巨噬细胞的凋亡。在ECs中,卵泡抑素相关蛋白(FRP)通过PI3K-AKT-NF-κB通路上调细胞抗凋亡蛋白BCL-2的转录,从而阻止内皮细胞凋亡。FRP对ECs损伤的预防和治疗提供了潜在靶点[32]。
综上所述,NF-κB信号通路能够作用于 AS形成的多个方面,包括炎症反应、氧化应激、内皮细胞损伤及凋亡、平滑肌增殖迁移等病理生理过程。NF-κB信号机制在AS的形成、发展和稳定中起着重要作用,NF-κB信号可以促进AS产生及发展,阻断该通路则具有抗AS保护作用。然而,目前对NF-κB信号抑制剂使用仅限于实验研究,其性能及疗效需要进一步在临床中得到评估。寻找有效药物阻止NF-κB信号转导,可能是抑制AS发生和发展的有效途径,将为预防和治疗AS提供新靶点。
[1] Tabas I,Garcia-Cardena G,Owens GK.Recent insights into the cellular biology of atherosclerosis [J].JCell Biol,2015,209(1):13-22.
[2] Pateras I,Giaginis C,Tsigris C,et al.NF-kappaB signaling at the crossroads of inflammation and atherogenesis:searching for new therapeutic links[J].Expert Opin Ther Targets,2014,18(9):1089-1101.
[3] Yu XH,Zheng XL,Tang CK.Nuclear factor-kappaB activation as a pathologicalmechanism of lipid metabolism and atherosclerosis[J].Adv Clin Chem,2015,70:1-30.
[4] Bryk D,Olejarz W,Zapolska-Downar D.The role of oxidative stress and NADPH oxidase in the pathogenesis of atherosclerosis[J].Postepy Hig Med Dosw(Online),2017,71:57-68.
[5] Sun Y,Chen X.Ox-LDL-induced LOX-1 expression in vascular smooth muscle cells:role of reactive oxygen species[J].Fundam Clin Pharmacol,2011,25(5):572-579.
[6] Masai N,Tatebe J,Yoshino G,et al.Indoxyl sulfate stimulates monocyte chemoattractant protein-1 expression in human umbilical vein endothelial cells by inducing oxidative stress through activation of the NADPH oxidase-nuclear factor-kappaB pathway[J].Circ J,2010,74(10):2216-2224.
[7] Kaulmann A,Bohn T.Carotenoids,inflammation and oxidative stress-implications of cellular signaling pathways and relation to chronic disease prevention[J].Nutr Res,2014,34(11):907-929.
[8] Wang Y,Wang X,Sun M,et al.NF-kB activity-dependent P-selectin involved in ox-LDL-induced foam cell formation in U937 cell[J].Biochem Biophys Res Commun,2011,411(3):543-548.
[9] Liu M,Yu P,Jiang H,et al.The essential role of pin1 via NF-kappaB signaling in vascular inflammation and atherosclerosis in ApoE-/-mice[J].Int JMol Sci,2017,18(3).
[10] Li Q,Syrovets T,Simmet T,et al.Plasmin induces intercellular adhesion molecule 1 expression in human endothelial cells via nuclear factor-kappaB/mitogen-activated protein kinasesdependent pathways[J].Exp Biol Med(Maywood),2013,238(2):176-186.
[11] Gimbrone MA, Jr., Garcia-Cardena G. Endothelial cell dysfunction and the pathobiology of atherosclerosis[J].Circ Res,2016,118(4):620-636.
[12] DebRoy A,Vogel SM,Soni D,et al.Cooperative signaling via transcription factors NF-kappaB and AP1/c-Fos mediates endothelial cell STIM1 expression and hyperpermeability in response to endotoxin [J].JBiol Chem,2014,289(35):24188-24201.
[13] Yurdagul A,Green J,Albert P,et al.alpha5beta1 integrin signaling mediates oxidized low-density lipoprotein-induced inflammation and early atherosclerosis [J].Arterioscler Thromb Vasc Biol,2014,34(7):1362-1373.
[14] Go YM,Son DJ,Park H,et al.Disturbed flow enhances inflammatory signaling and atherogenesis by increasing thioredoxin-1 level in endothelial cell nuclei[J].PLoSOne,2014,9(9):e108346.
[15] Xiao L,Liu Y,Wang N.New paradigms in inflammatory signaling in vascular endothelial cells [J].Am J Physiol Heart Circ Physiol,2014,306(3):H317-325.
[16] Xie B,Zhang C,Kang K,et al.miR-599 inhibits vascular smooth muscle cells proliferation and migration by targeting TGFB2[J].PLoSOne,2015,10(11):e0141512.
[17] Yoshida T, Yamashita M, Horimai C, et al. Smooth muscle-selective inhibition of nuclear factor-kappaB attenuates smooth muscle phenotypic switching and neointima formation following vascular injury [J].J Am Heart Assoc,2013,2(3):e000230.
[18] Lamers D,Schlich R,Horrighs A,et al.Differential impact of oleate,palmitate,and adipokines on expression of NF-kappaB target genes in human vascular smooth muscle cells[J].Mol Cell Endocrinol,2012,362(1-2):194-201.
[19] Jeong JW,Kim JW,Ku SK,et al.Essential oils purified from Schisandrae semen inhibits tumor necrosis factor-alpha-induced matrix metalloproteinase-9 activation and migration of human aortic smooth muscle cells [J].BMC Complement Altern Med,2015,15:7.
[20] Zhu X,Wang Z,Hu C,et al.Honokiol suppresses TNF-alpha-induced migration and matrix metalloproteinase expression by blocking NF-kappaB activation via the ERK signaling pathway in rat aortic smooth muscle cells[J].Acta Histochem,2014,116(4):588-595.
[21] Kuiper J,Quax PH,Bot I.Anti-apoptotic serpins as therapeutics in cardiovascular diseases [J].Cardiovasc Hematol Disord Drug Targets,2013,13(2):111-122.
[22] Tan SZ,Ooi DS,Shen HM,et al.The atherogenic effects of serum amyloid A are potentially mediated via inflammation and apoptosis[J].JAtheroscler Thromb,2014,21(8):854-867.
[23] Lee SK,Yang SH,Kwon I,et al.Role of tumour necrosis factor receptor-1 and nuclear factor-kappaB in production of TNF-alpha-induced pro-inflammatory microparticles in endothelial cells[J].Thromb Haemost,2014,112(3):580-588.
[24] Zhuang J,Peng W,Li H,et al.Inhibitory effects of vinpocetine on the progression of atherosclerosis are mediated by Akt/NF-kappaB dependent mechanisms in apoE-/-mice [J].PLoS One,2013,8(12):e82509.
[25] Xu ZR,Li JY,Dong XW,et al.Apple polyphenols decrease atherosclerosis and hepatic steatosis in ApoE-/-mice through the ROS/MAPK/NF-κB pathway[J].Nutrients,2015,7(8):7085-7105.
[26] Hwang HJ,Jung TW,Hong HC,et al.Progranulin protects vascular endothelium against atherosclerotic inflammatory reaction via Akt/eNOS and nuclear factor-kappaB pathways[J].PLoSOne,2013,8(9):e76679.
[27] Hsueh TP,Sheen JM,Pang JH,et al.The anti-atherosclerotic effect of naringin is associated with reduced expressions of cell adhesion molecules and chemokines through NF-kappaB pathway[J].Molecules,2016,21(2).
[28] Cao Q,Jiang Y,Shi J,et al.Artemisinin inhibits the proliferation,migration,and inflammatory reaction induced by tumor necrosis factor-alpha in vascular smooth muscle cells through nuclear factor kappa B pathway[J].JSurg Res,2015,194(2):667-678.
[29] Suh SJ,Kwak CH,Song KH,et al.Triple inhibitory activity of Cliona celata against TNF-alpha-induced matrix metalloproteinase-9 production via downregulated NF-kappaB and AP-1,enzyme activity,and migration potential [J].Inflammation,2012,35(2):736-745.
[30] Song J,Wang D,Chen H,et al.Association of plasma 7-Ketocholesterol with cardiovascular outcomes and total mortality in patients with coronary artery disease[J].Circ Res,2017,120(10):1622-1631.
[31] Tesoriere L,Attanzio A,Allegra M,et al.Phytochemical indicaxanthin suppresses 7-ketocholesterol-induced THP-1 cell apoptosis by preventing cytosolic Ca(2+)increase and oxidative stress[J].Br JNutr,2013,110(2):230-240.
[32] Liu S,Shen H,Xu M,et al.FRP inhibits ox-LDL-induced endothelial cell apoptosis through an Akt-NF-{kappa}B-Bcl-2 pathway and inhibits endothelial cell apoptosis in an apoE-knockoutmousemodel[J].Am JPhysiol Endocrinol Metab,2010,299(3):E351-363.
