卡培他滨联合化疗治疗HER-2阴性晚期乳腺癌的效果观察
2018-03-23郑晨晨
郑晨晨
2014年9月美国临床肿瘤学会(ASCO)推荐紫杉类、蒽环类药物作为HER-2阴性晚期乳腺癌患者的一线化疗方案[1],但仍有相当一部分患者两类药物治疗失败,后续化疗方案是临床关注重点。ASCO指南提出,吉西他滨、长春瑞滨、卡培他滨、铂类等也可作为治疗表皮生长因子受体(HER-2)阴性的晚期乳腺癌选择,但尚未达成共识。对此,本研究选取紫杉类、蒽环类药物治疗失败的HER-2阴性晚期乳腺癌患者作为研究对象,对比卡培他滨联合顺铂(XP)或多西他赛(TX)两种化疗方案治疗的效果及对预后的影响,为临床治疗方案的选择提供参考。
1 资料与方法
1.1 病例资料 选取2014年1月~2016年12月医院接受含卡培他滨联合化疗方案治疗的HER-2阴性晚期乳腺癌患者112例。纳入标准:经临床病理确诊为HER-2阴性的原发性乳腺癌(HER-2阴性定义为免疫组化0、+1或荧光原位杂交结果未扩增);入组前使用过蒽环类或至少一种紫杉醇类药物治疗失败;美国东部肿瘤协作组(ECOG)体力状况评分为0~2分,预计生存期>3个月;至少有一个可测量病灶;无相关化疗禁忌证,患者及家属知情并自愿签署知情同意书。排除标准:既往接受过含卡培他滨联合化疗方案化疗;合并其他恶性肿瘤;精神病患者。以患者入院先后顺序编号,按照奇偶数法分为XP组和TX组,各56例。XP组年龄27~68(49.34±5.26)岁;ECOG 评分:0~1 分 52 例,2 分 4例;化疗用药情况:含蒽环类化疗方案44例,含紫杉类化疗方案12例。TX组年龄30~69(451.02±6.12)岁;ECOG评分:0~1分51例,2分5例;化疗用药情况:含蒽环类化疗方案40例,含紫杉类化疗方案16例。两组年龄、化疗用药情况、ECOG评分、月经状况比较均无统计学差异(P>0.05)。
1.2 治疗方法 XP组:口服卡培他滨(江苏恒瑞医药股份有限公司,国药准字H20133366)1000mg/m2,2次/d,d1-14;静滴顺铂(锦州九泰药业有限责任公司,国药准字 H20033936)75mg/m2,1 次/d,d1-3。 TX组:口服卡培他滨 1000mg/m2,2 次/d,d1-14;静滴多西他赛(江苏恒瑞医药股份有限公司,国药准字H20030561)75mg/m2,d1,多西他赛用药前 1 d 口服地塞米松7.5 mg,2次/d,联用3 d。 两组化疗1~3 d时,均口服托烷司琼预防胃肠道反应;均以21 d为1个周期,至少治疗2个周期。
1.3 观察指标 (1)化疗2个周期后,参照实体瘤的疗效评价标准(RECIST)评估近期疗效,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、进展(PD),疾病控制率=(CR+PR+SD)例数/总例数×100%。(2)采用电话、门诊及住院复查方式对患者进行随访,治疗开始后每1~2个月随访1次,随访截止时间为2017年12月。统计患者无进展生存期(PFS)及总生存期(OS)。PFS定义:化疗开始至第一次发生疾病进展或任何原因死亡或末次随访时间;OS定义:化疗开始至任何原因引起死亡的时间或末次随访时间。(3)参照WHO抗癌药物常见毒副反应分级标准,评估化疗毒副反应,分为0~Ⅳ度。
1.4 统计学方法 应用SPSS18.0统计学软件分析,计数资料以例和百分率表示,采用χ2检验;计量资料以±s表示,采用t检验;生存率使用Kapaln-Meier法计算,采用Log-rank检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组近期疗效比较 至随访结束时,XP组疾病控制率显著高于TX组(P<0.05,表1)。
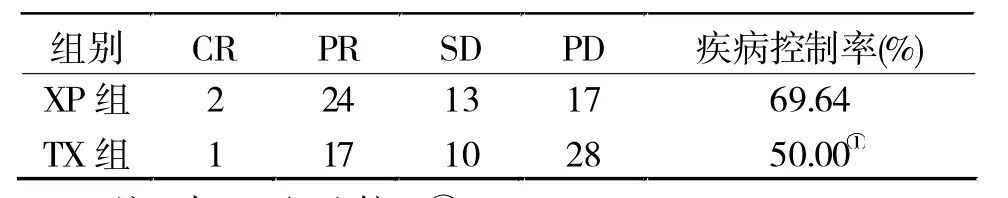
表1 两组近期疗效比较(n=56,例)
2.2 两组生存情况比较 两组随访时间为11~32个月,中位时间为17个月。XP组中位PFS为7.2(5~22)个月,中位 OS 为 17.6(9~40)个月;TX 组中位 PFS 为 5.7(3~13)个月,中位 OS 为 14.1(7~30)个月,两组比较有统计学差异(P<0.05)。
2.3 两组化疗毒副反应比较 XP组脱发发生率低于TX组(P<0.05),其余毒副反应比较无统计学差异(P> 0.05),见表 2。
3 讨论
乳腺癌发病率居于女性恶性肿瘤发病首位,《2012年中国肿瘤登记年报》显示,全国乳腺癌发病率为43/10万,且呈年轻化发病趋势[3]。化疗是治疗晚期乳腺癌的重要手段,2014年ASCO推荐紫杉类、蒽环类药物作为治疗HER-2阴性晚期乳腺癌的一线方案,但对于治疗失败的患者尚缺乏标准方案。
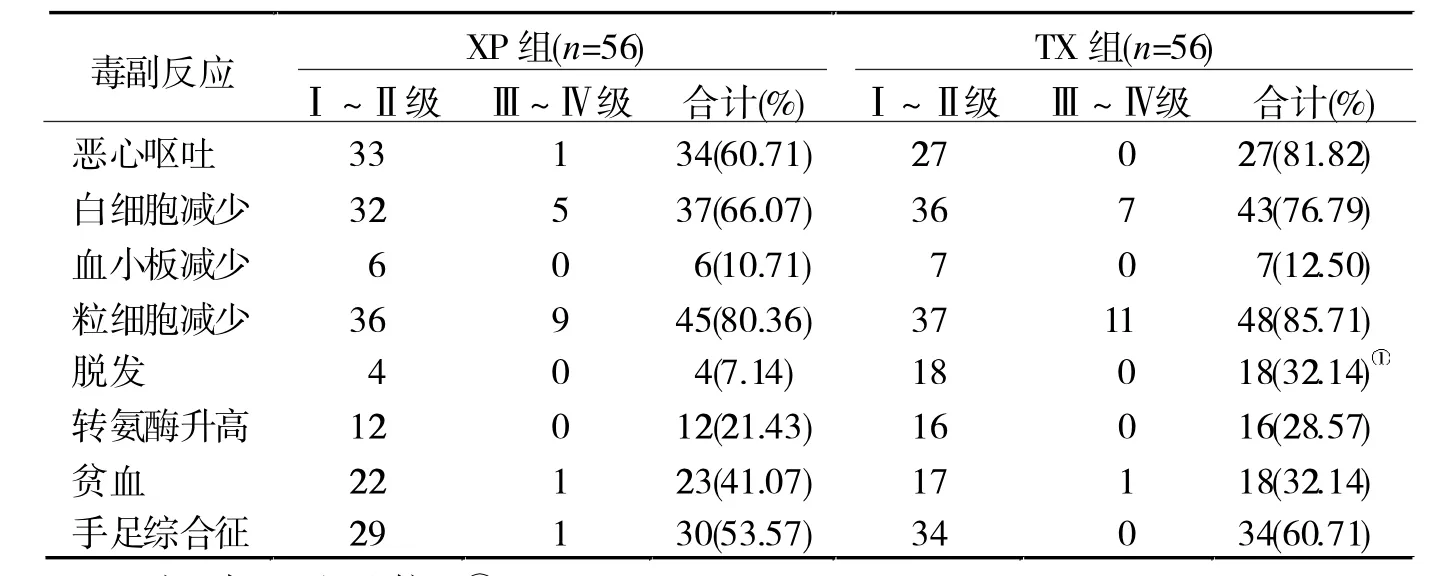
表2 两组化疗毒副反应比较(例)
卡培他滨作为一种新型的氟尿嘧啶类口服化疗药物,对蒽环类和紫杉类治疗失败患者也有一定效果,可单药治疗,也可与铂类、多西他赛、长春瑞滨等多种药物联合应用[4]。李俏等[5]采用XP(卡培他滨+顺铂)方案治疗蒽环类和紫杉类耐药的晚期三阴性乳腺癌,治疗有效率为62%;Lee等[6]使用XP方案治疗蒽环类及紫杉类耐药的HER-2阴性转移性乳腺癌,治疗总PFS为1.1~33.57个月。张会强等[7]报道,含铂方案治疗蒽环类和紫衫类治疗失败的HER-2阴性晚期乳腺癌总有效率为29.60%。TX(卡培他滨+多西他赛)方案也是临床治疗晚期乳腺癌较为常用的化疗方案之一,杨波等[8]报道指出,TX方案治疗HER-2阴性转移性乳腺癌的客观有效率为72.00%。
本研究比较XP与TX方案治疗HER-2阴性晚期乳腺癌的效果,发现XP组治疗近期疾病控制率高于 TX 组(P<0.05),中位 PFS、OS时间长于 TX组(P<0.05),说明XP方案治疗蒽环类和紫杉类治疗失败的HER-2阴性晚期乳腺癌的近远期效果优于TX方案,原因可能为卡培他滨和多西他赛均属于细胞周期特异性药物(作用于S期和M期),而顺铂为细胞周期非特异性药物,对增殖各期和G0期的细胞均有效,覆盖范围较为广泛有关;是否还有其他原因,有待进一步探讨。张彦武等[9]对比XP方案与TX方案治疗三阴性转移复发性乳腺癌的效果,发现XP方案的治疗总有效率高于TX方案(P<0.05),本研究结果与其一致。
药物毒性反应也是临床关注重点,分析两组化疗毒副反应,发现XP组脱发发生率低于TX组(P<0.05),原因为脱发是多西他赛较为常见的不良反应[10],而卡培他滨和顺铂化疗无明显脱发反应。另外,两组手足综合征发生率均较高,此为卡培他滨用药较为常见的不良反应,与既往多数研究结果一致[11],有待研究其防治措施。
综上所述,与TX方案相比,XP方案化疗治疗蒽环类和紫衫类治疗失败的HER-2阴性晚期乳腺癌不会增加不良反应发生率,但在提高临床近期疗效和延长患者生存期上更具优势。
[1] 高国璇,刘荫华.2014年ASCO乳腺癌临床实践指南解读——HER-2阴性(或未知)晚期乳腺癌化学和靶向治疗[J].中国实用外科杂志,2015,35(1):27-29.
[2] 单海琳,苏瑛,周斌,等.血循环肿瘤细胞检测在中晚期乳腺癌疗效评价及转移监测中的应用[J].标记免疫分析与临床,2017,24(9):988-991.
[3] 王乐,张玥,石菊芳,等.中国女性乳腺癌疾病负担分析[J].中华流行病学杂志,2016,37(7):970-976.
[4] Vincent MD,Breadner D,Cripps MC,et al.Phase I/II trial of dose-reduced capecitabine in elderly patients with advanced colorectal cancer[J].Current Oncology,2017,24(4):e261.
[5] 李俏,徐兵河,李青,等.顺铂联合卡培他滨治疗蒽环和紫杉类耐药晚期三阴性乳腺癌的近期疗效与安全性[J].中华肿瘤杂志,2015,37(12):938-941.
[6] Lee J,Kim HH,Sang MR,et al.Capecitabine and cisplatin(XP)combination systemic chemotherapy in heavily pre-treated HER-2 negative metastatic breast cancer [J].Plos One,2017,12(2):e0171605.
[7] 张会强,王涛,边莉,等.含铂方案治疗HER-2阴性蒽环和紫杉类治疗失败晚期乳腺癌的临床研究[J].中华肿瘤防治杂志,2014,21(22):1820-1824.
[8] 杨波,杨俊兰,施伟伟,等.多西他赛联合卡培他滨或表柔比星一线治疗HER-2阴性晚期乳腺癌的临床观察[J].中华医学杂志,2013,93(18):1397-1400.
[9] 张彦武,吕以东,牛耀东,等.卡培他滨联合顺铂与卡培他滨联合多西他赛治疗三阴性复发转移性乳腺癌的临床研究[J].中国现代医学杂志,2017,27(10):66-70.
[10] Kim J,You JL,Kim YA,et al.Aqueous extract of phragmitis rhizoma ameliorates myelotoxicity of docetaxel in vitro and in vivo[J].BMC Complementary&Alternative Medicine,2017,17(1):393.
[11] Naito M,Yamamoto T,Hara S,et al.Hemoglobin value is the most important factor in the development of hand-foot syndrome under the capecitabine regimen[J].Chemotherapy,2017,62(1):23-29.
