高效液相色谱-串联质谱法同时测定配制酒中5种紫杉烷
2019-11-28,*
,*
(1.湖北省食品质量安全监督检验研究院,湖北武汉 430075;2.湖北省食品质量安全检测工程技术研究中心,湖北武汉 430075)
紫杉烷是以紫杉醇为首的一类具有五甲基十五碳烯骨架的二萜类化合物的总称,包括紫杉醇、三尖杉宁碱、巴卡亭Ⅲ、7-表紫杉醇和10-脱乙酰基巴卡丁Ⅲ(10-DAB)等[1-2]。紫杉烷主要存在于红豆杉属植物中,是红豆杉属植物的一个显著特性。紫杉烷为新一代抗肿瘤药物,临床上用于治疗乳腺癌等多种癌症[3-5],然而会产生抑制骨髓造血功能、神经毒性等副作用[6-9]。鉴于红豆杉中紫杉烷的毒副作用,我国将红豆杉列入“保健食品禁用物品名单”,禁止其作为保健食品和食品原料使用。但在利益驱使下,不法商家为了宣传配制酒的保健功效,非法将红豆杉添加到配制酒中的案例仍有发生。目前,我国尚未有专门识别与确证配制酒中是否添加红豆杉的方法,因此,建立一种通过测定配制酒中紫杉烷含量来鉴别配制酒中是否非法添加红豆杉的方法,具有重要现实意义。
目前,有关紫杉烷的检测研究已有很多,检测对象多为红豆杉[10]、动物血液[11]和药品[12]等,有关测定配制酒中紫杉烷从而鉴别配制酒中非法添加红豆杉的研究未见报道。紫杉烷的检测方法主要有紫外分光光度计法、液相色谱法、高效液相色谱-串联质谱法(HPLC-MS/MS)等[13-16],其中以HPLC-MS/MS检测方法灵敏度最高,特异性好,耗时较短,且能应用于多种紫杉烷的同时测定。为了准确测定配制酒中紫杉烷含量,从而鉴别配制酒中非法添加红豆杉的行为。本文选用HPLC-MS/MS技术,选取5种红豆杉中标志性紫杉烷(紫杉醇、三尖杉宁碱、巴卡亭Ⅲ、7-表-紫杉醇和10-脱乙酰基巴卡丁Ⅲ)作为研究对象,通过液-液萃取除杂,氮吹浓缩富集目标物,甲醇复溶后过膜上机测定。该方法操作简单,灵敏度高,具有较好的准确度和精密度,满足配制酒中5种紫杉烷的量检测和非法添加的识别需求,为配制酒的科学监管提供有效的技术支撑。
1 材料与方法
1.1 材料与仪器
网购红豆杉酒(1种) 酒精度38% vol,配料为白酒、红豆杉和松茸,产地江西省余江县,购自淘宝网;自制红豆杉酒(3种) 酒精度50% vol,实验室自制;添健酒(阴性空白基质) 酒精度35% vol,湖北天健酒业有限公司;红豆杉干果 产地云南省昭通市;紫杉醇、三尖杉宁碱 纯度≥99.9%,中国食品药品检定研究院;巴卡亭Ⅲ、7-表-紫杉醇 纯度≥98%,上海源叶生物科技有限公司;10-DAB 纯度≥95%,上海阿拉丁生化科技股份有限公司;乙腈、甲醇 色谱级,默克公司;甲酸 色谱级,赛默飞世尔公司;二氯甲烷,高锰酸钾 分析纯,国药集团化学试剂有限公司;95%食用酒精 食品级,郑州市万久化工产品有限公司;超纯水 美国密理博公司纯水机制备。
Triple Quad 4500液相色谱串联质谱联用仪 美国AB Sciex公司;XS204电子天平 梅特勒-托利多仪器(上海)有限公司;Allegra X-15R离心机 贝克曼库尔特有限公司;DC-24氮吹仪 上海安谱科学仪器有限公司;Elmasonic S180H超声仪 德国艾尔玛公司;Talboys数显型多管式旋涡混合器 上海安谱实验科技股份有限公司。
1.2 实验方法
1.2.1 标准溶液的配制 分别精确称取紫杉醇、三尖杉宁碱、巴卡亭Ⅲ、7-表-紫杉醇、10-DAB标准品各10.0 mg,以甲醇溶解配制成1.0 mg/mL的单标标准储备液,于-20 ℃避光储存。分别移取各单标标准储备液适量,用甲醇配制为300 ng/mL的混合标准中间溶液,于-20 ℃避光储存。
1.2.2 自制红豆杉酒 食用酒精稀释至50% vol,采用0.09 g/L高锰酸钾氧化处理8 h,再用0.02%活性炭吸附处理24 h,达到脱臭要求[17]。参照李万祥[18]的方法并做适当改动,将红豆杉干果粉碎(过40目筛),加入适量50% vol食用酒精,使红豆杉干果含量分别为0.2%、1.0%和2.0%,浸提温度20 ℃,浸提24 h,前12 h每1 h搅拌5 min,过滤得自制红豆杉酒,实验室编码依次为S1~S3。
1.2.3 样品前处理 精确称取5 g(精确到0.01 g)配制酒样品(网购红豆杉酒、自制红豆杉酒和添健酒)于50 mL离心管中,40 ℃氮吹浓缩至近干,采用6 mL二氯甲烷与3 mL超纯水萃取,振荡涡旋3 min,4000 r/min离心3 min,去除水相,将萃取液二氯甲烷于35 ℃氮吹至干,2 mL甲醇复溶,经0.22 μm有机系微孔滤膜过滤后供HPLC-MS/MS检测分析分析样本中5种紫杉烷的含量。
1.2.4 实验条件
1.2.4.1 液相条件 色谱柱:Thermo Hypersil Gold C18(100×2.1 mm,3 μm);流动相:0. 1%甲酸水(A)和100%乙腈(B);梯度洗脱程序:见表1,流速为0.3 mL/min,进样体积3 μL,柱温30 ℃。

表1 梯度洗脱程序表Table 1 Gradient elution schedule
1.2.4.2 质谱条件 电离模式:电喷雾电离正离子模式(ESI+);喷雾电压(IS):5500 V;检测方式:多反应监测(MRM);离子化温度(TEM):450 ℃;气帘气(CUR):35 psi;雾化气(GS1):40 psi;辅助加热气(GS2):40 psi;碰撞气(CAD):Medium;所有气体由氮气提供(纯度,99.999%),各化合物组分的质谱采集参数见表2。

表2 质谱分析参数Table 2 Mass spectrometry parameters for 5 taxanes
注:*为定量离子。
1.3 数据处理
使用Analyst和MultiQuantTM软件(美国AB Sciex公司)采集数据并积分,使用Microsoft Excel 2010(美国微软公司)进行数据统计分析和绘图。
2 结果与分析
2.1 样品前处理优化
2.1.1 浓缩温度的选择 紫杉烷为热敏性物质,在提取过程中易降解成小分子物质或发生转化[19]。配制酒含有较高比例的水,常温浓缩耗时过长,本课题选取水浴温度为40、50、60 ℃进行浓缩试验。结果表明(图1),5种紫杉烷回收率在温度为40 ℃时最高,50 ℃次之,60 ℃最低,这可能是由于高温环境下紫杉烷发生了降解或转化。因此,本实验最终选择40 ℃进行浓缩。
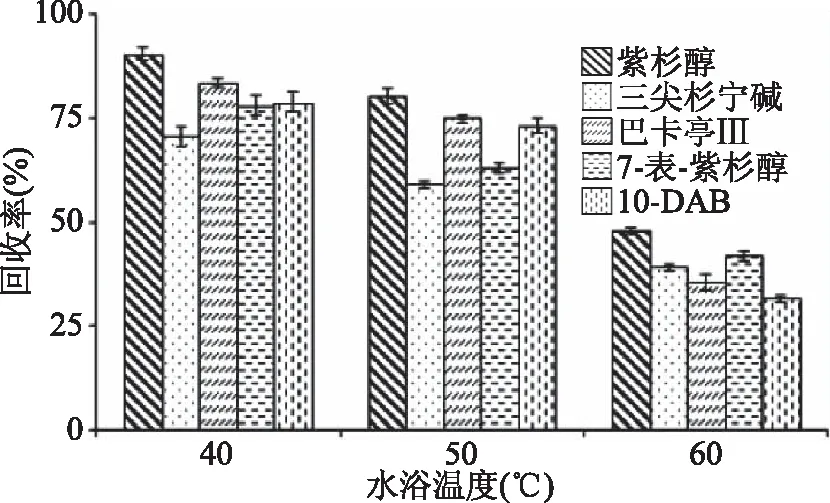
图1 不同水浴温度对5种紫杉烷回收率的影响Fig.1 Effect of different temperatureon the recovery of 5 taxanes
2.1.2 净化条件的选择 市售配制酒通常原料多样化,往往呈黄褐色,基质较为复杂,因此需净化除杂,消除基质干扰,提高灵敏度。大量研究表明[10,19-20],二氯甲烷与水萃取能较好分离紫杉烷与水溶性杂质,因此,本实验采用二氯甲烷与水萃取去除配制酒中水溶性杂质,如糖、水溶性色素等,并优化了萃取溶剂配比。分别选取二氯甲烷与水配比为6∶1、6∶3、6∶6和6∶9 (v∶v)进行试验,结果显示,二氯甲烷与水配比为6∶6和6∶9时,紫杉醇和10-DAB的回收效果有所降低(图2)。综合考虑除杂效果和5种紫杉烷的回收率,最终选择二氯甲烷与水6∶3 (v∶v)进行液-液萃取。

图2 不同萃取溶剂配比对5种紫杉烷回收率的影响Fig.2 Effect of different extraction solventratios on the recovery of 5 taxanes
2.2 色谱条件的选择
考察了不同流动相对5种紫杉烷色谱峰的影响。分别以乙腈-水、乙腈-0.1%甲酸水、乙腈-5 mmol/L乙酸铵水(含0.1%甲酸)作为流动相对标准品进行梯度洗脱。结果表明,各流动相体系下5种紫杉烷均能呈现良好的峰型,但乙腈-水流动相体系信号响应略低,其余两体系信号相应差异不大。考虑乙酸铵溶液长期作为流动相可能会堵塞管路以及操作的简便性,最终选择乙腈-0.1%甲酸水作为流动相。对梯度洗脱条件进行优化,结果表明采用0.1%甲酸水-乙腈为流动相梯度洗脱能够实现5种紫杉烷化合物目标峰的有效分离(图3),5种紫杉烷化合物在11 min内出峰完毕。

图3 5种紫杉烷总离子流色谱图Fig.3 Total ions chromatogram of 5 taxanes注:1:10-DAB;2:巴卡亭Ⅲ;3:三尖杉宁碱;4:紫杉醇;5:7-表-紫杉醇。
2.3 质谱条件的选择
研究发现,紫杉烷化合物呈现[M+Na]+和[M+H]+两种电离模式[12,21-22],且结构中富含氧原子的结构容易形成[M+Na]+离子[23-24]。200 ng/mL的紫杉烷单标溶液分别注入离子源(ESI源)中,正离子模式下,5种紫杉烷一级质谱图中[M+Na]+为主要基峰,[M+H]+响应较弱,这可能与紫杉烷含有多个含氧基团有关。但对标准品进行HPLC-MS/MS测定时,4种紫杉烷以[M+H]+模式下产生的定量和定性离子对的响应明显高于[M+Na]+所产生的,约为10~30倍,仅巴卡亭Ⅲ差异不大,其原因可能是流动相乙腈-0.1%甲酸水更有利于紫杉烷[M+H]+离子的形成。依据碎片离子响应,最终选取[M+H]+电离模式下产生的母离子和子离子作为定性、定量离子对,并优化质谱参数,具体见表2,碎片离子与文献报道大致吻合[12]。

表3 5种紫杉烷的线性关系与检出限Table 3 Linear relationship and detection limit for 5 taxanes

表5 红豆杉酒中5种紫杉烷含量测定结果(μg/kg)Table 5 Determination results of 5 taxanes in Chinese yew wine(μg/kg)
2.4 线性范围及检出限
分别按0、6、15、30、45、60、90、120 ng/mL的水平配制5种紫杉烷化合物标准品溶液,以5种紫杉烷的色谱峰面积(y)和质量浓度(x)做线性回归,结果显示,5种紫杉烷在0~120 ng/mL范围内线性关系均良好(r≥0.9982),具体见表3。以S/N=3确定方法检出限,紫杉醇、7-表-紫杉醇、巴卡亭Ⅲ检出限为4 μg/kg,三尖杉宁碱、10-DAB检出限为2 μg/kg。
2.5 方法回收率及精密度实验
准确称取一定量的添健酒(阴性空白基质)样品,分别按低、中、高3种不同浓度水平添加含5种紫杉烷混合标准溶液,样品按1.2.2处理后进行测定,分别计算5种紫杉烷的平均回收率。结果见表4,5种紫杉烷的回收率为71.84%~87.68%,相对标准偏差为1.33%~8.82%,与文献[25]中采用二氯甲烷与水萃取净化的方法测定毛榛中紫杉醇含量,当紫杉醇添加量为520 μg/kg时平均回收率为83.3%的结果接近。该方法具有较好的准确度及精密度,可对配制酒中5种紫杉烷进行准确定量检测。

表4 5种紫杉烷加标回收率和精密度(n=6)Table 4 Sampling recovery and relativestandard deviation of 5 taxanes(n=6)
2.6 样品测定
将红豆杉酒按照1.2.2进行预处理,测定样品中5种紫杉烷含量,重复测定两次。结果见表5,在红豆杉干果添加量为0.2%、1%、2%的自制红豆杉酒和网购红豆杉酒中,均能检出5种紫杉烷化合物,并且各样本中5种紫杉烷含量均以紫杉醇为最高,这可能是红豆杉果实中紫杉醇含量高于其它4种紫杉烷所致[2]。在红豆杉干果添加量为0.2%的配制酒中,紫杉醇含量为(157.80±8.77) μg/kg,约为检出限的40倍;其余四种紫杉烷含量较低,其中三尖杉宁碱和10-DAB的含量仅与检出限接近。因此,当配制酒中红豆杉添加量较低(干果添加量<0.2%)时,可以仅以紫杉醇作为指标来辅助鉴别配制酒中是否加入红豆杉。由此说明,通过本方法对配制酒中5种红豆杉标志性紫杉烷的定性定量检测,能够有效识别配制酒中非法添加红豆杉的行为。
3 结论
本文建立并优化了配制酒中5种红豆杉标志性紫杉烷(紫杉醇、三尖杉宁碱、巴卡亭Ⅲ、7-表-紫杉醇、10-DAB)的高效液相色谱-串联质谱检测方法。样品采用液-液萃取净化,操作简便,可在12 min内实现5种紫杉烷的检测分析。5种紫杉烷在0~120 ng/mL范围内线性关系良好(r≥0.9982);紫杉醇、巴卡亭Ⅲ、7-表-紫杉醇检出限为4 μg/kg,三尖杉宁碱、10-DAB检出限为2 μg/kg;回收率为71.84%~87.68%,相对标准偏差为1.33%~8.82%。该方法操作简单,灵敏度高,能对配制酒中5种紫杉烷进行准确定量检测,解决了配制酒中非法添加红豆杉难以识别和确证的难题,为配制酒的科学监管提供有效技术有段。
