miR-451对肝癌细胞增殖、糖酵解及相关基因表达的影响
2018-03-23周艳华张鹏飞戴广海
周艳华,茅 慧,张鹏飞,戴广海
(解放军总医院,北京 100853)
肿瘤细胞生长增殖活跃,其代谢机制也相当复杂,其中活跃的糖酵解代谢是恶性肿瘤细胞显著的生化特征。恶性肿瘤细胞主要以碳水化合物通过糖酵解产能,而这一现象也被称为沃伯格效应,该效应是细胞恶性转化过程中最根本的代谢改变之一[1]。这种代谢方式的转变为针对糖酵解途径进行抑制靶向治疗肿瘤细胞提供了可能性[2-3]。microRNA(miRNA)为广泛存在于细胞内的非编码小RNA,主要作用是调控基因的表达[4]。新近的研究显示,miRNA对肿瘤细胞糖酵解途径的异常调控是影响肿瘤细胞生物学特性,促进其快速生长、增殖的重要原因之一,而miR-451作为抑癌基因在恶性肿瘤的发生发展中发挥着重要作用[5-6],其中miR-451在恶性肿瘤细胞糖酵解途径中所起的调控作用尤其值得关注[7-8]。本研究通过转染来增强或抑制肝癌细胞中miR-451的表达,旨在探讨miR-451对肝癌细胞糖酵解以及相关信号通路和基因表达的影响,为miRNA在肿瘤代谢方面的研究提供理论依据。
1 实验资料
1.1 主要材料与试剂
人肝癌细胞MHCC97购自上海复旦大学中山医院肝癌研究所;四甲基偶氮唑盐(MTT)购自Sigma公司;DMEM F12培养基、小牛血清购于Gibco公司;TIANscript RT Kit 购自天根生化科技(北京)有限公司;Hot Start Fluorescent PCR Core Reagent Kits(SYBR Green I) 购自Ambion公司;葡萄糖检测试剂盒、乳酸检测试剂盒购自美国Invitrogen公司;miR-451、U6引物序、miR-451 mimics和miR-451 inhibitors购自Applera公司;CO2培养箱购自美国Thermo公司;XL-71台式高速冷冻离心机购自德国Eppendorf公司;Prism®7300实时荧光定量PCR仪购自ABI公司。
1.2方法
1.2.1细胞培养将MHCC97细胞接种于DMEM F12 培养液(10%小牛血清+青霉素100 IU/mL +链霉素100 IU/mL)中,置于细胞培养箱中培养(孵育条件:37 ℃+5% CO2); 0.25%胰蛋白酶消化、传代,取对数生长期细胞进行实验。
1.2.2细胞转染 实验分为普通组、增强组和抑制组。将MHCC97细胞接种于6孔板中,培养24 h(细胞融合度达60%左右)后,增强组和抑制组按脂质体Lipofectamine2000说明进行SP细胞miR-451 mimics和miR-451 inhibitors的转染,转染48 h后采用RT-PCR法检测3组细胞中miR-451表达量。
1.2.3MTT实验 实验分为普通组、增强组和抑制组。将MHCC97细胞接种于96孔板培养,平均每孔5×104个细胞,培养24 h后,每孔加入20 μL MTT(5 mg/mL),置于37 ℃、5% CO2饱和湿度条件下孵育4 h。终止反应后弃上清液,加入150 μL DMSO,振荡10 min。在全自动酶标仪上在490 nm波长处检测各孔的吸光度(OD),计算肝癌细胞增殖情况并绘制细胞生长曲线图。
1.2.4肝癌细胞糖酵解相关基因表达检测 实验分为普通组、增强组和抑制组,采用实时荧光定量PCR法检测各组AMPK/mTOR、Ki-67、血管内皮生长因子(VEGF)、基质金属蛋白酶9 (MMP-9)、胰岛素样生长因子(IGF-1)表达情况。 ①细胞总RNA提取:采用Trizol法抽提浓缩组织RNA(每1×106~1×107细胞加入1 mL Trizol试剂)。Agilent 2100 生物分析仪检测RNA分子完整性,NanoDrop@ ND-1000测定RNA浓度和纯度。② cDNA 合成:按照TIANscript RT Kit 的说明进行操作。反应体系:Total RNA 40 μg,10×DNase I buffer 5 μL, RNase Inhibitor 20 IU,DNase I(RNase-free) 2 μL (10 IU),加入RNase free dH2O至总体积50 μL。反应条件:42 ℃反转录50 min,85 ℃ 5 min灭活反转录酶。③ RT-PCR反应:构建20 μL的反应体系,即RT product 1 μL, 10 μmol/L 的PCR特异引物F 1 μL,10 μmol/L 的PCR特异引物R 1 μL,2×Master Mix 10 μL,Nucleasr-Free Water 7 μL。反应条件:95 ℃ 30 s;40个循环,95 ℃ 5 s;60 ℃ 34 s。以U6为内参基因,采用2-ΔΔCT法分析检测基因表达的相对定量值。
1.2.5葡萄糖消耗和乳酸产量检测 实验分为普通组、增强组和抑制组,将转染前后MHCC97细胞以1×105/孔接种于24孔板,培养24 h后收集培养基,3 000 r/min离心10 min去除细胞碎片,取上清。按葡萄糖检测试剂盒和乳酸检测试剂盒说明书检测并计算各组MHCC97细胞葡萄糖消耗值和乳酸产量。
1.3 统计学方法

2 结 果
2.1
各组肝癌细胞中miR-451表达情况 普通组MHCC97细胞中miR-451的相对表达量为0.476±0.052,增强组MHCC97细胞中miR-451的相对表达量为1.153±0.242,明显高于普通组(P<0.05);抑制组MHCC97细胞中miR-451的相对表达量为0.284±0.030,明显低于增强组(P<0.05)。
2.2
各组肝癌细胞增殖情况 3组转染前OD值比较差异均无统计学意义(P均>0.05)。转染24 h和48 h后,增强组OD值均明显低于普通组和抑制组(P均<0.05),抑制组OD值均明显高于普通组(P均<0.05)。见表1。
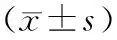
表1 3组转染前后不同时间肝癌细胞增殖情况
注:①与增强组比较,P<0.05;②与普通组比较,P<0.05。
2.3
各组肝癌细胞糖酵解相关基因表达情况 增强组肝癌细胞AMPK mRNA表达量明显高于普通组和抑制组(P均<0.05),而抑制组明显低于普通组(P<0.05);增强组肝癌细胞mTOR、Ki-67、MMP-9、VEGF和IGF-1 mRNA表达量均明显低于普通组和抑制组(P均<0.05),而抑制组均明显高于普通组(P均<0.05)。见表2。
2.4
各组肝癌细胞糖酵解情况 转染前3组肝癌细胞葡萄糖消耗值和乳酸分泌值比较差异均无统计学意义(P均>0.05)。转染后增强组葡萄糖消耗值和乳酸分泌值均明显低于转染前及普通组和抑制组(P均<0.05),抑制组葡萄糖消耗值和乳酸分泌值均明显高于转染前和普通组(P均<0.05)。见表3。
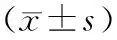
表2 3组肝癌细胞糖酵解相关基因表达情况
注:①与增强组比较,P<0.05;②与普通组比较,P<0.05。
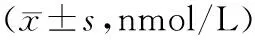
表3 3组转染前后肝癌细胞葡萄糖消耗和乳酸分泌量比较
注:①与转染前比较,P<0.05;②与增强组比较,P<0.05;③与普通组比较,P<0.05。
3 讨 论
恶性肿瘤细胞存在明显的能量代谢异常,而沃伯格效应是目前公认的恶性肿瘤细胞最重要的能量代谢特性,即在氧充足的条件下,肿瘤细胞无法通过线粒体氧化磷酸化方式获取更多的能量,而只能通过糖酵解方式进行葡萄糖代谢以满足其活跃的合成代谢需求。沃伯格效应的发现为恶性肿瘤的治疗提供了新的途径和思路,即针对糖酵解途径的靶向干预来抑制肿瘤细胞的能量代谢[9-10]。miRNA是普遍存在于真核细胞,具有高度保守序列的小RNA。目前已知miRNA在细胞的生长、增殖、凋亡、分化、信号转导及代谢等生物学进程中起着非常重要的调控作用[11],其能够对糖酵解相关基因进行调控,导致糖酵解相关酶的表达及活性异常,最终影响肿瘤细胞的生长和增殖[12-13]。
miR-451为新近发现的具有抑癌作用的小RNA,与多种恶性肿瘤的增殖、侵袭和转移密切相关[14-15]。Godlewski等[16]的研究显示,miR-451在胶质瘤细胞中呈低表达,高葡萄糖条件下会使细胞miR-451表达增强,抑制AMPK功能,进而抑制胶质细胞瘤增殖迁移;而当葡萄糖缺乏时会激活AMPK信号,抑制miR-451表达,一方面增强胶质瘤细胞迁移能力,另一方面增加对mTOR的抑制,抑制胶质瘤细胞的增殖。进一步通过荧光素酶报告基因分析提示miR-451 通过直接抑制靶基因CAB39的表达,进而抑制LKB1/AMPK信号传导。本研究中,通过脂质体miR-451 mimics和inhibitors转染来增强和抑制肝癌细胞miR-451的表达,结果显示增强miR-451表达能抑制肝癌细胞增殖,减少肝癌细胞葡萄糖消耗值和乳酸分泌值;抑制miR-451表达则促进肝癌细胞的增殖,会增加肝癌细胞葡萄糖消耗值和乳酸分泌值。提示过表达miR-451会抑制肝癌细胞糖酵解,抑制miR-451表达则会增强肝癌细胞糖酵解。
miR-451能够通过抑制糖酵解来抑制肿瘤细胞的生长,但是其涉及的信号通路和基因目前尚未明确。AMPK/mTOR通路是已知的调控肿瘤细胞生长和能量代谢的一条重要的信号途径[17]。mTOR基因活化能够促进细胞糖酵解,进而促进细胞生长和增殖,AMPK则负向调控mTOR的功能。当细胞能量缺乏时,AMP/ATP比例升高,激活AMPK并磷酸化形成TSC1/2二聚体,抑制mTOR活性[18-19]。Ki-67、MMP-9、VEGF和IGF-1是目前公认的癌基因,这些指标高表达提示肿瘤生长增殖活跃,易发生转移,且Ki-67、MMP-9、VEGF和IGF-1在肿瘤细胞中的表达与糖酵解过程中的信号通路存在密切相关性[20-21]。本实验结果显示,增强miR-451表达后肝癌细胞中mTOR、Ki-67、MMP-9、VEGF和IGF-1 mRNA表达量明显降低,而AMPK mRNA表达量明显增高;抑制miR-451表达后肝癌细胞中mTOR、Ki-67、MMP-9、VEGF和IGF-1 mRNA表达量增高,而AMPK mRNA表达量明显降低。提示miR-451可能通过调控AMPK/mTOR传导通路以及细胞中Ki-67、MMP-9、VEGF、IGF-1的表达,进而影响肿瘤细胞代谢途径,最终达到抑制肿瘤生长增殖的作用。
综上所述,miR-451参与调控肝癌细胞增殖糖酵解,其调控机制可能通过影响AMPK/mTOR信号通路,进而影响细胞中Ki-67、MMP-9、VEGF、IGF-1的表达而实现。未来可以针对肿瘤糖酵解相关miRNAs进行靶向性研究来干预肿瘤细胞能量代谢,进而为肿瘤的治疗提供新的途径和思路。
[1] Bensinger SJ,Christofk HR. New aspects of the Warburg effect in cancer cell biology[J]. Semin Cell Dev Biol,2012,23(4):352-361
[2] Ponisovskiy MR. Warburg effect mechanism as the target for theoretical substantiation of a new potential cancer treatment[J]. Crit Rev Eukaryot Gene Expr,2011,21(1):13-28
[3] Chiu M,Ottaviani L,Bianchi MG,et al. Towards a metabolic therapy of cancer?[J]. Acta Biomed,2012,83(3):168-176
[4] Huang Y,Shen XJ,Zou Q,et al. Biological functions of microRNAs[J]. Bioorg Khim,2010,36(6):747-752
[5] Liu X,Zhang A,Xiang J,et al. miR-451 acts as a suppressor of angiogenesis in hepatocellular carcinoma by targeting the IL-6R-STAT3 pathway[J]. Oncol Rep,2016,36(3):1385-1392
[6] Zhu S,Huang Y,Su X. Mir-451 correlates with prognosis of renal cell carcinoma patients and inhibits cellular proliferation of renal cell carcinoma[J]. Med Sci Monit,2016,22:183-190
[7] Suresh PS,Venkatesh T,Tsutsumi R. In silico analysis of polymorphisms in microRNAs that target genes affecting aerobic glycolysis[J]. Ann Transl Med,2016,4(4):69
[8] Wang J,Lei ZJ,Guo Y,et al. miRNA-regulated delivery of lincRNA-p21 suppresses beta-catenin signaling and tumorigenicity of colorectal cancer stem cells[J]. Oncotarget,2015,6(35):37852-37870
[9] Rao SG. Mitochondrial changes in cancer[J]. Handb Exp Pharmacol,2017,240:211-227
[10] Maximchik PV,Kulikov AV,Zhivotovsky BD,et al. Cellular energetics as a target for tumor cell elimination[J]. Biochemistry (Mosc),2016,81(2):65-79
[11] Jansson MD,Lund AH. MicroRNA and cancer[J]. Mol Oncol,2012,6(6):590-610
[12] Arora A,Singh S,Bhatt AN,et al. Interplay between metabolism and oncogenic process:Role of microRNAs[J]. Transl Oncogenomics,2015,7:11-27
[13] Chen B,Li H,Zeng X,et al. Roles of microRNA on cancer cell metabolism[J]. J Transl Med,2012,10:228
[14] Wang J,Zhao X,Shi J,et al. miR-451 suppresses bladder cancer cell migration and invasion via directly targeting c-Myc[J]. Oncol Rep,2016,36(4):2049-2058
[15] Zeng T,Peng L,Chao C,et al. miR-451 inhibits invasion and proliferation of bladder cancer by regulating EMT[J]. Int J Clin Exp Pathol,2014,7(11):7653-7662
[16] Godlewski J,Nowicki MO,Bronisz A,et al. MicroRNA-451 regulates LKB1/AMPK signaling and allows adaptation to metabolic stress in glioma cells[J]. Mol Cell,2010,37(5):620-632
[17] Sorokin DV,Scherbakov AM,Yakushina IA,et al. The mechanism of adaptation of breast cancer cells to hypoxia: Role of AMPK/mTOR signaling pathway[J]. Bull Exp Biol Med,2016,160(4):555-559
[18] Liu LL,Long ZJ,Wang LX,et al. Inhibition of mTOR pathway sensitizes acute myeloid leukemia cells to aurora inhibitors by suppression of glycolytic metabolism[J]. Mol Cancer Res,2013,11(11):1326-1336
[19] Masui K,Tanaka K,Akhavan D,et al. mTOR complex 2 controls glycolytic metabolism in glioblastoma through FoxO acetylation and upregulation of c-Myc[J]. Cell Metab,2013,18(5):726-739
[20] Yamashita S,Moroga T,Tokuishi K,et al. Ki-67 labeling index is associated with recurrence after segmentectomy under video-assisted thoracoscopic surgery in stage I non-small cell lung cancer[J]. Ann Thorac Cardiovasc Surg,2011,17(4):341-346
[21] Wang Q,Diao X,Sun J,et al. Regulation of VEGF,MMP-9 and metastasis by CXCR4 in a prostate cancer cell line[J]. Cell Biol Int,2011,35(9):897-904
