脯氨酰异构酶1沉默抑制缺氧/复氧H9c2心肌细胞凋亡①
2018-03-23郭红雨段永珂何瑞利程冠昌
郭红雨 段永珂 何瑞利 程冠昌
(河南大学淮河医院心内科,开封 475000)
心肌缺血是造成心脏病患者死亡的主要原因[1],及时恢复心脏血液供应是防治缺血损伤最有效的措施,然而缺血再灌注造成的心肌细胞损伤是亟待解决的问题[2]。细胞凋亡被认为是心肌缺血再灌注损伤的重要病理基础,细胞凋亡的数量决定了心肌缺血再灌注损伤的严重程度[3]。因此,阐明调控缺血再灌注导致的心肌细胞凋亡的机制,对防治缺血再灌注损伤具有重要意义[4]。
肽基脯氨酰顺反异构酶1(Peptidyl-prolyl cis/trans isomerase,NIMA-interacting 1,Pin1)参与多条信号通路的调控,在心血管疾病发病过程中发挥重要作用[5],此外,Pin1在心肌肥大和心脏衰老中也具有重要作用[6-8]。研究报道Pin1可诱导细胞凋亡[9-11]。然而,Pin1蛋白在缺氧复氧心肌细胞中的作用未见报道,因此本文以大鼠H9c2细胞为对象,研究Pin1对心肌细胞缺氧/复氧损伤的作用。
1 材料与方法
1.1材料 大鼠胚胎H9c2心肌细胞系购自中国科学院上海细胞库;DMEM培养基购自美国Hyclone公司;胎牛血清购自美国Gibco公司;TRIzol试剂盒和LipofectamineTM2000转染试剂购自美国Invitrogen公司;噻唑蓝(MTT)购自美国Sigma公司;细胞凋亡检测试剂盒均购自南京建成生物工程研究所;兔抗大鼠Pin1抗体购自美国Cell Signaling公司;兔抗大鼠Bcl-2抗体、兔抗大鼠Bax抗体和兔抗大鼠GAPDH抗体购自中杉金桥生物技术有限公司;Annexin V-FITC/PI双染试剂盒购自南京凯基生物科技发展有限公司;逆转录试剂盒购自日本TaKaRa公司;Pin1 siRNA(序列:TACGTCCAAGGTC-GGGCAGGAAGA)、scramble siRNA(序列:CAACCCGCTCCAAGGAATCG)均购于美国Invitrogen公司;Caspase-3活性检测试剂盒购自南京建成有限公司;Pin1引物、GAPDH引物由上海生工生物工程有限公司合成,见表1。
1.2主要方法
1.2.1细胞培养 细胞在含10%胎牛血清的DMEM培养基,37℃、5%CO2细胞培养箱中培养,待细胞生长至80%融合时进行传代。
1.2.2细胞分组及处理 将细胞分为空白对照组、缺氧/复氧(H/R)组、Pin1 siRNA组、scramble siRNA(scramble)组。空白对照组细胞在37℃、5%CO2和95%空气的培养箱中正常培养;缺氧/复氧组细胞在无血清无糖的DMEM培养基,95%N2和5%CO2培养3 h后,于含10%胎牛血清的DMEM培养基,5%CO2和95%空气中培养1 h[12];Pin1 siRNA组转染Pin1 siRNA 24 h后进行缺氧/复氧处理;scramble组转染非特异性siRNA后进行缺氧/复氧处理。
1.2.3细胞转染 将细胞接种于6孔板,待汇合率达90%,用LipofectamineTM2000将100 nmol/L Pin1 siRNA转染细胞,转染24 h后进行缺氧/复氧处理。
表1引物序列
Tab.1Sequencesofprimers
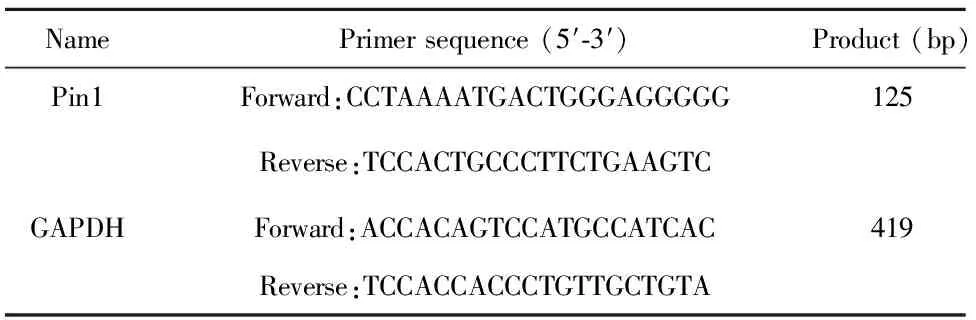
NamePrimersequence(5′⁃3′)Product(bp)Pin1Forward:CCTAAAATGACTGGGAGGGGG125Reverse:TCCACTGCCCTTCTGAAGTCGAPDHForward:ACCACAGTCCATGCCATCAC419Reverse:TCCACCACCCTGTTGCTGTA
1.2.4MTT法检测细胞存活率 取对数生长期的H9c2细胞接种于96孔板(3×104个/孔),培养24 h后,每孔加20 μl MTT溶液(5 g/L),继续培养4 h,弃去孔内液体,加150 μl DMSO,摇床10 min充分溶解结晶物后,用酶标仪检测490 nm的光吸收值A。细胞存活率(%)=(各组A490值/空白对照组A490值)×100%。
1.2.5Annexin V-FITC/PI双染流式细胞术分析细胞凋亡率和坏死率 培养并收集各组细胞,用冰PBS清洗后,加入500 μl Binding Buffer调整细胞浓度至1×106个/ml,分别加入5 μl Annexin V-FITC和5 μl PI,室温避光反应10 min,进行流式细胞术检测。
1.2.6Caspase-3活性的检测 收集各组细胞,加入裂解液,冰浴裂解15 min,4℃、15 000 r/min离心5 min,10 μl,加入Ac-DEVD-pNA 10 μl,37℃孵育2 h,用酶标仪测定405 nm的光吸收值A405。样品的A405扣除空白对照的A405为样品中Caspase-3催化产生的pNA产生的吸光度。按照Caspase-3活性检测试剂盒说明书,测定并绘制标准曲线。根据标准曲线,对比计算出样品中催化产生的pNA量计算Caspase-3活性。
1.2.7RT-qPCR实验 用Trizol试剂提取细胞总RNA,逆转录合成cDNA,以cDNA为模板进行PCR扩增。PCR反应条件:95℃变性30 s,95℃变性5 s,60℃退火30 s,72℃延伸1 min,35个循环,72℃延伸10 min。
1.2.8Western blot检测蛋白表达 裂解细胞后,用BCA法定量,取20 μg蛋白样品进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转移至聚偏氟乙烯膜上,放入5%脱脂奶粉封闭1 h,加入兔抗大鼠Pin1抗体(1∶1 000)、Bcl-2抗体(1∶200)、Bax抗体(1∶200)、Caspase-3抗体(1∶500)4℃过夜。漂洗后,加入辣根过氧化物酶标记的山羊抗兔Ⅱ抗(1∶3 000)孵育2 h。TBST漂洗后用ECL显色观察。
2 结果
2.1Pin1在缺氧/复氧H9c2细胞中表达升高 由图1所示,和空白对照组相比,缺氧/复氧H9c2细胞中Pin1的mRNA和蛋白表达显著升高(PmRNA=0.000;P蛋白=0.003)。
2.2Pin1 siRNA转染抑制Pin1表达 与对照组比,scramble siRNA组Pin1 mRNA和蛋白表达无显著性差异(PmRNA=0.839;P蛋白=0.696),Pin1 siRNA组Pin1的mRNA和蛋白表达显著降低(均P=0.000),见图2。
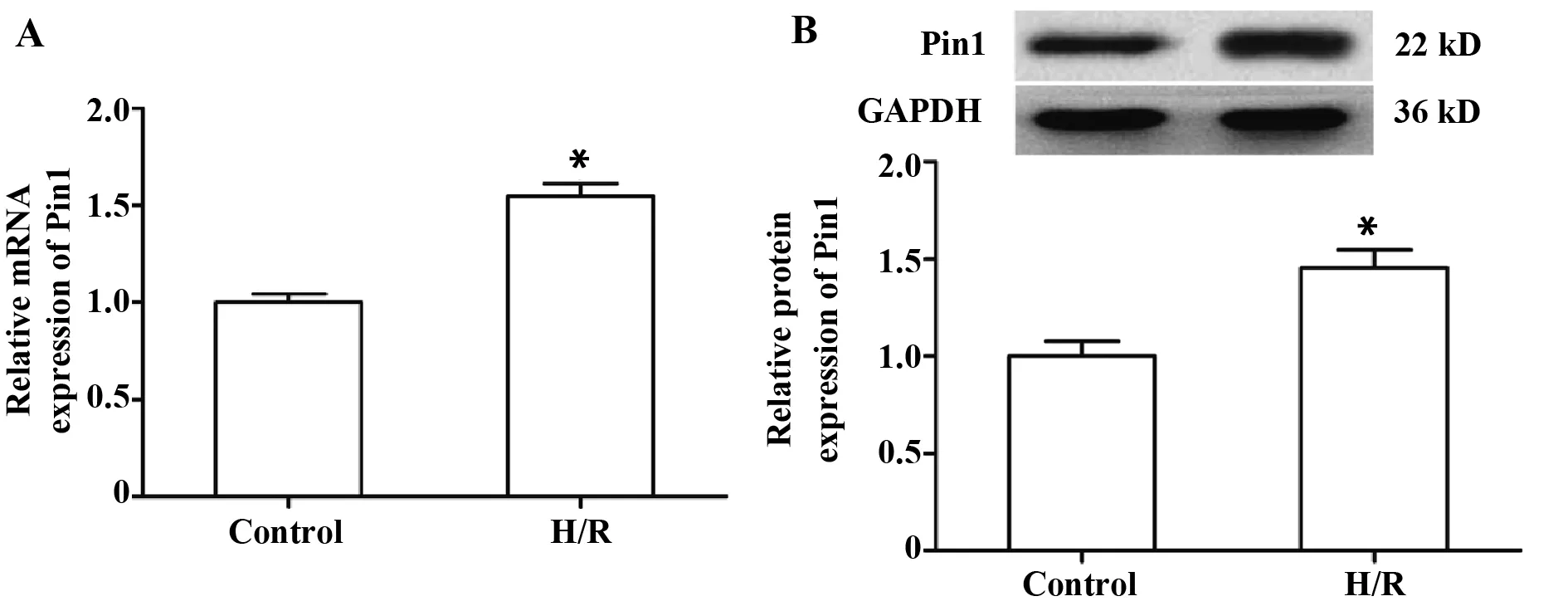
图1 Pin1 RT-qPCR和Western blot检测Pin1的表达Fig.1 RT-qPCR and Western blot detection for Pin1 expression(±s,n=3)Note:A.Pin1 mRNA expression;B.Pin1 protein expression.*.P<0.05,vs control group.
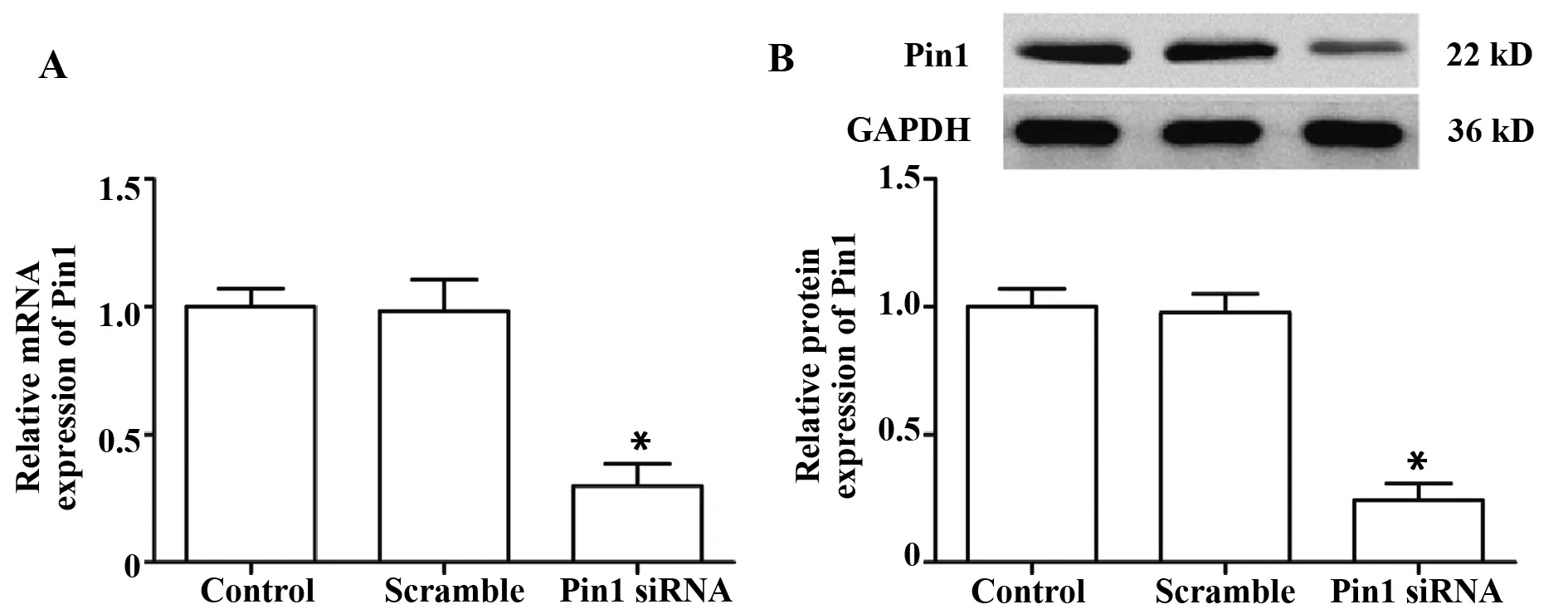
图2 Pin1 siRNA转染结果Fig.2 Pin1 siRNA transfection results (±s,n=3)Note:A.Pin1 mRNA expression;B.Pin1 protein expression.*.P<0.05 vs other groups.
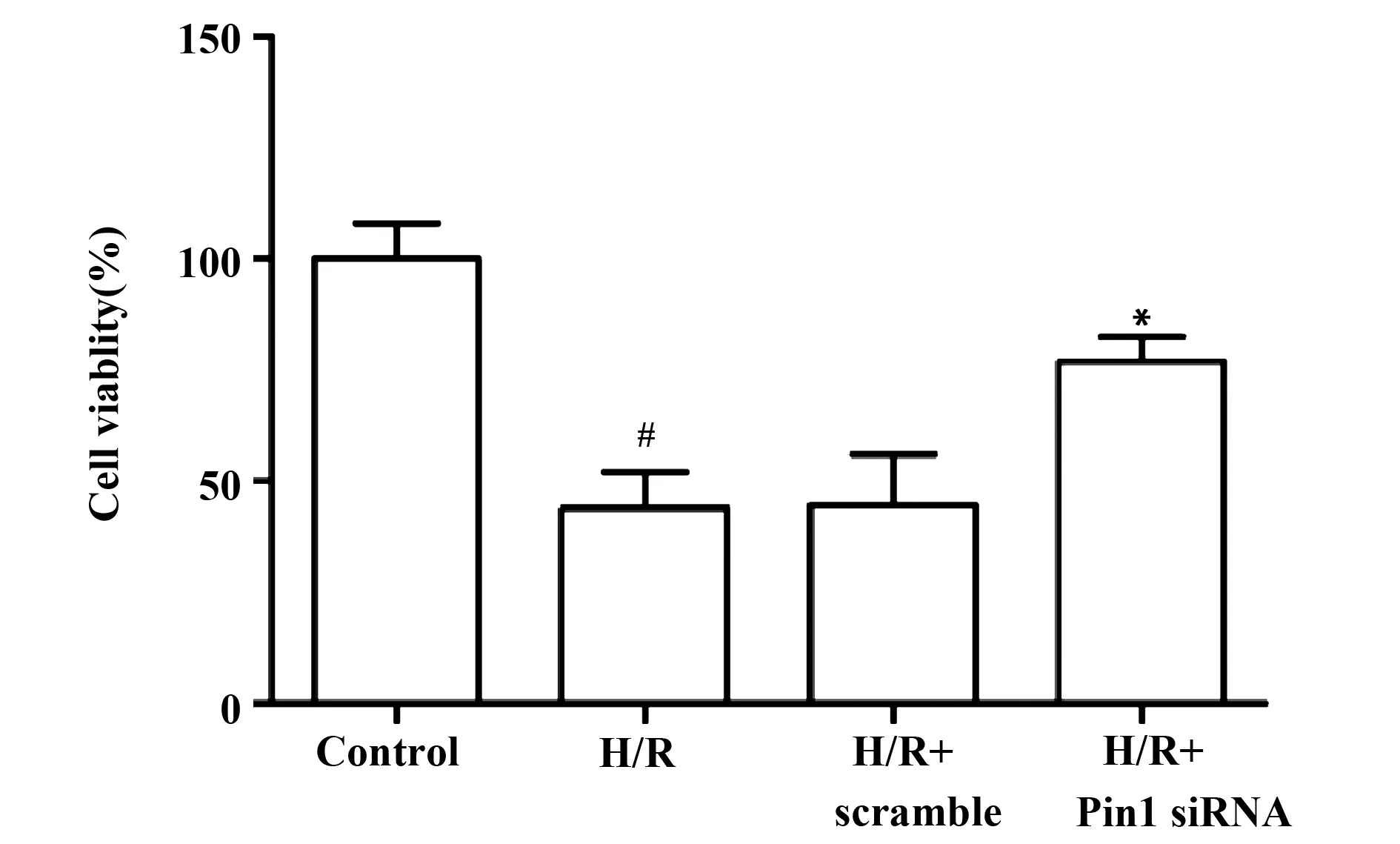
图3 Pin1 siRNA对细胞存活率的影响Fig.3 Effects of Pin1 siRNA on cell viability of H9c2 cells(±s,n=6)Note:#.P<0.05 vs control group;*.P<0.05 vs H/R group.
2.3Pin1 siRNA增加缺氧/复氧H9c2细胞存活率 MTT结果显示,和对照组相比,缺氧/复氧组细胞的存活率显著降低(P=0.000);而Pin1 siRNA转染后,缺氧/复氧H9c2细胞的存活率显著增加(P=0.001),见图3。
2.4Pin1 siRNA对缺氧/复氧H9c2细胞凋亡和坏死的影响 实验结果表明,和对照组相比,缺氧/复氧组细胞凋亡率显著增多(P=0.000),坏死率无显著差异(P=0.103);Pin1 siRNA组的细胞凋亡率明显少于缺氧/复氧组(P=0.000),坏死率无显著差异(P=0.789),见图4。
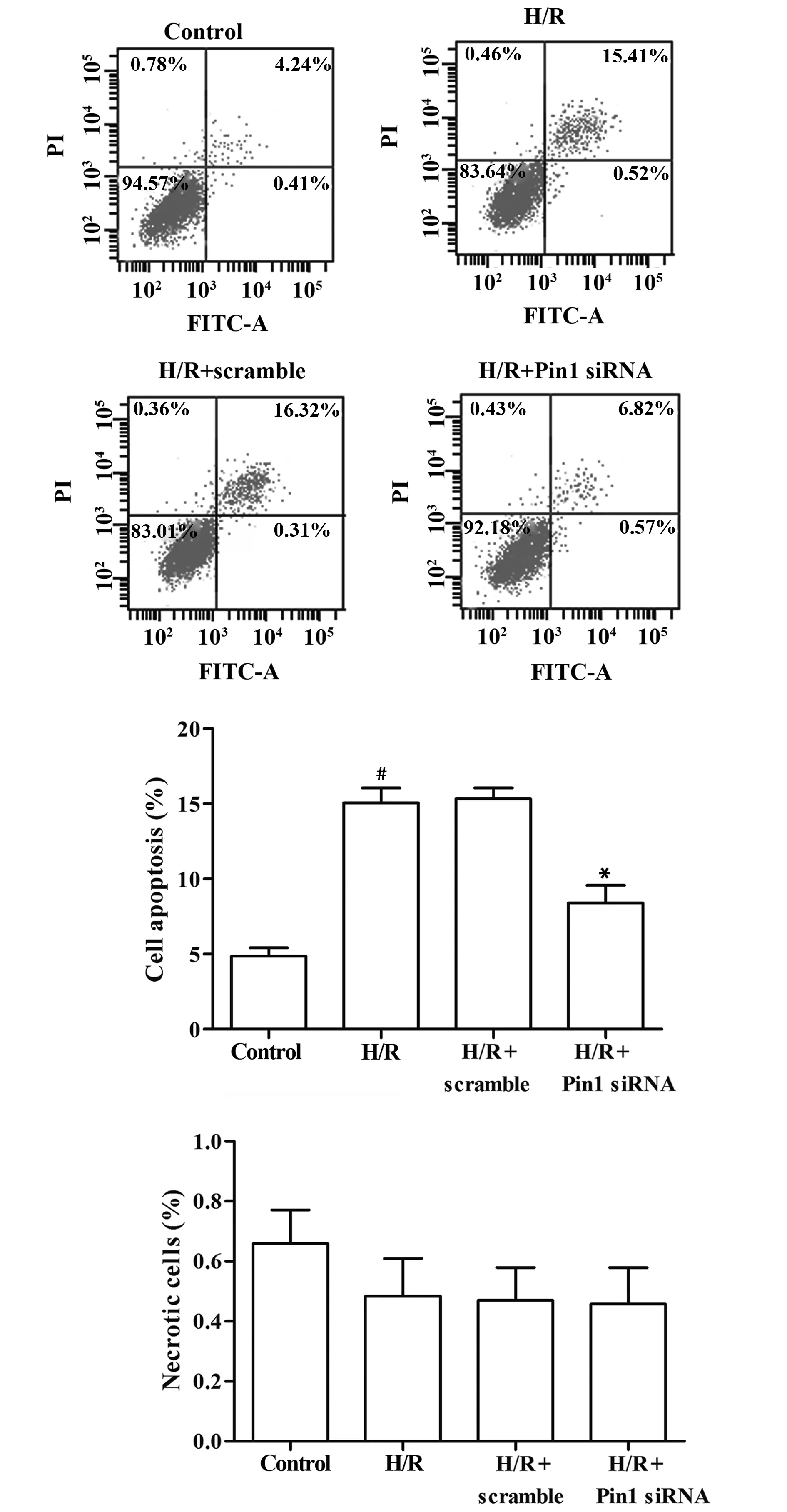
图4 流式细胞术检测Pin1 siRNA对H9c2细胞凋亡率和坏死率的影响Fig.4 Effects of Pin1 siRNA on cell apoptotic rate (%) and necrotic rate (%) of H9c2 cells detected by flow cytometry(±s,n=3)Note:#.P<0.05 vs control group;*.P<0.05 vs H/R group.
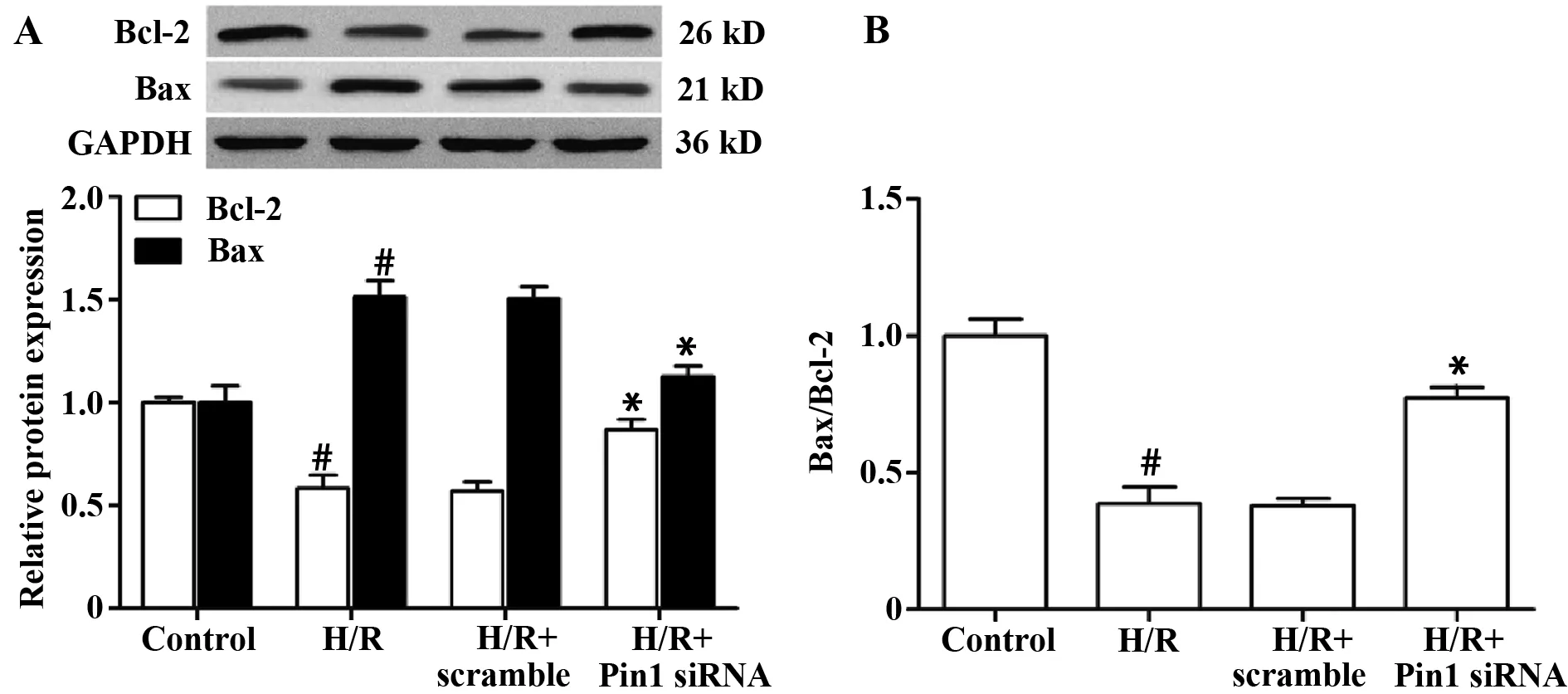
图5 Pin1 siRNA对Bcl-2和Bax蛋白表达的影响n=3)Fig.5 Effects of Pin1 siRNA on protein expression of Bcl-2 and Bax(±s,n=3)Note:A.The protein expression of Bcl-2 and Bax;B.Comparison of Bcl-2/Bax.#.P<0.05 vs control group;*.P<0.05 vs H/R group.
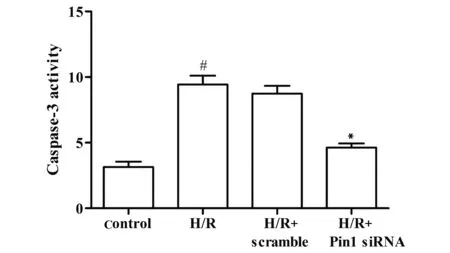
图6 Pin1 siRNA对Caspase-3活性影响Fig.6 Effects of siRNA on activity of Caspase-3(±s,n=6)Note:#.P<0.05 vs control group;*.P<0.05 vs H/R group.
2.5Pin1 siRNA对Bcl-2和Bax蛋白表达的影响Western blot检测凋亡相关蛋白表达的变化,结果如图5所示。和对照组相比,缺氧/复氧组细胞Bcl-2蛋白表达降低、Bax表达增高,Bcl-2/Bax降低(均P=0.000)。和缺氧/复氧组相比,Pin1 siRNA组Bcl-2表达升高,Bax表达减少,Bcl-2/Bax升高(均P=0.000)。
2.6Pin1 siRNA抑制Caspase-3活性的影响 和对照组相比,缺氧/复氧组细胞Caspase-3活性增加(均P=0.000)。和缺氧/复氧组相比,Pin1 siRNA组细胞Caspase-3活性显著降低(均P=0.000),见图6。
3 讨论
Pin1是一个进化上保守的肽基脯氨酰异构酶,能够特异性识别和结合特定的磷酸化蛋白,调节蛋白质结构,从而改变磷酸化蛋白质的功能,影响细胞过程[13]。Pin1在调节心脏的病理生理过程中起着举足轻重的作用[14]。研究表明,Pin1调控心肌肥厚信号[7],可通过调节磷酸化分子的活性决定肥大心肌细胞的大小[6]。Pin1过表达可抑制心脏祖细胞衰老与死亡[8],而抑制Pin1能够减轻心肌纤维化和功能障碍[15]。本实验通过心肌细胞缺氧/复氧模拟心脏缺血再灌注损伤,检测Pin1对缺氧/复氧心肌细胞的作用。结果表明,Pin1在缺氧/复氧大鼠心肌细胞高表达,提示Pin1可能在心肌细胞缺氧/复氧损伤中发挥重要作用。为进一步探索Pin1对缺氧/复氧心肌细胞损伤的影响,我们用Pin1 siRNA沉默Pin1的表达,检测了Pin1 siRNA对缺氧/复氧损伤心肌细胞的作用。结果发现Pin1沉默能够显著增加缺氧/复氧H9c2细胞存活率,提示Pin1沉默可能对心肌细胞缺氧/复氧损伤有重要的保护作用。由于只用了一种siRNA,不能排除脱靶效应,但是图2 中Pin1 siRNA转染结果显示,和对照组及scramble siRNA组比较,Pin1表达下降了约75%,其功能性是可以保证的。
缺血再灌注可诱导心肌细胞凋亡而使细胞死亡[16]。近年来,研究证实Pin1在调节细胞凋亡中发挥重要作用。Wang等[9]研究发现Pin1可调节高剂量酒精诱导的小鼠心肌细胞凋亡。另据文献报道Pin1沉默可抑制高氧诱导的A549细胞凋亡[17]。然而,Pin1是否参与缺氧/复氧诱导的心肌细胞凋亡仍不明确,有待于进一步研究证实。本研究发现Pin1沉默能降低缺氧/复氧H9c2细胞凋亡率。Bax、Bcl-2和Caspase-3是线粒体凋亡信号通路中的下游分子[18]。Bcl-2家族是一种凋亡相关基因,通过调节线粒体膜的通透性在细胞凋亡中发挥重要作用[19],其表达和调控是影响细胞凋亡的关键因素[20]。Bcl-2调节开启线粒体通透性转换孔发挥抗凋亡作用,而Bax发挥促凋亡作用。Bcl-2/Bax的平衡影响凋亡的发生[21]。Caspase-3是Caspase依赖途径中最终被主要激活的凋亡效应酶,其活化在细胞凋亡的启动过程中起着核心作用[22],能够水解多种重要的蛋白而导致细胞凋亡[23]。本试验发现Pin1 siRNA能够显著上调Bcl-2表达,下调Bax,增加Bcl-2/Bax比值,降低Caspase-3活性,抑制缺氧/复氧诱导的心肌细胞凋亡。
综上,本研究在细胞水平证实,Pin1 siRNA可通过上调Bcl-2、下调Bax,降低Caspase-3活性,抑制了缺氧/复氧造成的心肌细胞凋亡,为基因治疗缺血性心脏病提供了新的思路。
[1] Ibanez B,Heusch G,Ovize M,etal.Evolving therapies for myocardial ischemia/reperfusion injury[J].J Am Coll Cardiol,2015,65(14):1454-1471.
[2] Wang J,Yang L,Rezaie AR,etal.Activated protein C protects against myocardial ischemic/reperfusion injury through AMP-activated protein kinase signaling[J].J Thromb Haemost,2011,9(7):1308-1317.
[3] Konstantinidis K,Whelan RS,Kitsis RN.Mechanisms of cell death in heart disease[J].Arterioscler Thromb Vasc Biol,2012,32(7):1552-1562.
[4] Sun J,Ling Z,Wang F,etal.Clostridium butyricum pretreatment attenuates cerebral ischemia/reperfusion injury in mice via anti-oxidation and anti-apoptosis[J].Neurosci Lett,2016,613:30-35.
[5] Wang JZ,Liu GJ,Li ZY,etal.Pin1 in cardiovascular dysfunction:A potential double-edge role[J].Int J Cardiol,2016,212:280-283.
[6] Sakai S,Shimojo N,Kimura T,etal.Involvement of peptidyl-prolyl isomerase Pin1 in the inhibitory effect of fluvastatin on endothelin-1-induced cardiomyocyte hypertrophy[J].Life Sci,2014,102(2):98-104.
[7] Toko H,Konstandin MH,Doroudgar S,etal.Regulation of cardiac hypertrophic signaling by prolyl isomerase Pin1[J].Circ Res,2013,112(9):1244-1252.
[8] Toko H,Hariharan N,Konstandin MH,etal.Differential regulation of cellular senescence and differentiation by prolyl isomerase Pin1 in cardiac progenitor cells[J].J Biol Chem,2014,289(9):5348-5356.
[9] Wang Y,Li Z,Zhang Y,etal.Targeting Pin1 protects mouse cardiomyocytes from high-dose alcohol-induced apoptosis[J].Oxid Med Cell Longev,2016,2016:4528906.
[10] Follis AV,Llambi F,Merritt P,etal.Pin1-Induced proline isomerization in cytosolic p53 mediates BAX activation and apoptosis[J].Mol Cell,2015,59(4):677-684.
[11] 张 巍,金 瑛,朱文赫,等.肽基脯氨酰顺反异构酶抑制剂胡桃醌对宫颈鳞癌SiHa细胞凋亡的作用[J].中国病理生理杂志,2015,31(3):543-546.
Zhang W,Jin Y,Zhu WH,etal.Pin1 inhibitor juglone induces apoptosis in human cervical cancer SiHa cells[J].Chin J Pathophysiology,2015,31(3):543-546.
[12] Zeng X,Tan X.Epigallocatechin-3-gallate and zinc provide anti-apoptotic protection against hypoxia/reoxygenation injury in H9c2 rat cardiac myoblast cells[J].Mol Med Rep,2015,12(2):1850-1856.
[13] Lee TH,Pastorino L,Lu KP.Peptidyl-prolyl cis-trans isomerase Pin1 in ageing,cancer and Alzheimer disease[J].Expert Rev Mol Med,2011,13:e21.
[14] Hariharan N,Sussman MA.Pin1:a molecular orchestrator in the heart[J].Trends Cardiovasc Med,2014,24(6):256-262.
[15] Liu X,Liang E,Song X,etal.Inhibition of Pin1 alleviates myocardial fibrosis and dysfunction in STZ-induced diabetic mice[J].Biochem Biophys Res Commun,2016,479(1):109-115.
[16] Ho FY,Tsang WP,Kong SK,etal.The critical role of caspases activation in hypoxia/reoxygenation induced apoptosis[J].Biochem Biophys Res Commun,2006,345(3):1131-1137.
[17] 赵 帅,董文斌,张 婵,等.沉默Pin1表达抑制高氧诱导人肺泡上皮细胞凋亡[J].中国当代儿科杂志,2015,17(5):496-501.
Zhao S,Dong WB,Zhang C,etal.Silencing of Pin1 suppresses hyperoxia-induced apoptosis of A549 cells[J].Chin J Contemp Pediatr,2015,17(5):496-501.
[18] Jiang X,Guo CX,Zeng XJ,etal.A soluble receptor for advanced glycation end-products inhibits myocardial apoptosis induced by ischemia/reperfusion via the JAK2/STAT3 pathway[J].Apoptosis,2015,20(8):1033-1047.
[19] Shamas-Din A,Kale J,Leber B,etal.Mechanisms of action of Bcl-2 family proteins[J].Cold Spring Harb Perspect Biol,2013,5(4):a008714.
[20] Zhang T,Saghatelian A.Emerging roles of lipids in BCL-2 family-regulated apoptosis[J].Biochim Biophys Acta,2013,1831(10):1542-1554.
[21] Lee Y,Gustafsson AB.Role of apoptosis in cardiovascular disease[J].Apoptosis,2009,14(4):536-548.
[22] Zhang Q,Shang M,Zhang M,etal.Microvesicles derived from hypoxia/reoxygenation-treated human umbilical vein endothelial cells promote apoptosis and oxidative stress in H9c2 cardiomyocytes[J].BMC Cell Biol,2016,17(1):25.
[23] Zhao HX,Li XY,Yao H,etal.The up-regulation of hypoxia inducible factor-1alpha by hypoxic postconditioning reduces hypoxia/reoxygenation-induced injury in heart-derived H9c2 cells[J].Sheng Li Xue Bao,2013,65(3):293-300.
