HUVEC疫苗联合化疗抗EMT-6乳腺癌转移实验研究①
2018-03-23鲁美钰仲维兰董万法姚庆收司春枫徐茂磊
鲁美钰 仲维兰 董万法 姚庆收 司春枫 周 玲 徐茂磊
(滨州医学院药学院 “方剂效应与临床评价”国家中医药管理局重点实验室,烟台 264003)
乳腺癌高居女性恶性肿瘤发病率的榜首,是影响女性生命健康的一大杀手[1]。伴随着乳腺癌早期诊断率的提高及乳腺癌综合治疗技术的不断进步,乳腺癌患者的生存率有了明显的提高,但仍有大约10%~15%的乳腺癌患者容易发生转移及复发,其中最常见的转移部位为肺[2-4]。乳腺癌的远处转移和复发是导致乳腺癌治疗失败的最主要原因,因此寻找有效的治疗策略,预防乳腺癌的转移和复发是乳腺癌治疗研究的热点。
研究证实,在肿瘤形成及发展过程中会伴随着大量新生血管的生成,这些新生血管为肿瘤的生长提供营养物质和氧气,并向远处输送肿瘤细胞。肿瘤新生血管与肿瘤生长、侵袭和转移等特性密切相关,抗血管生成疗法成为肿瘤生物治疗的一个研究热点[5-7]。在我们前期关于人脐静脉内皮细胞(Human umbilical vein endothelial cell,HUVEC)疫苗的研究中发现,以HUVEC作为抗原制备疫苗,经主动免疫的方式可以诱导小鼠产生持续的靶向肿瘤新生血管的免疫反应,达到了较好地控制肿瘤生长及转移的作用,可以有效克服传统抗血管生成药物用药昂贵、停药后容易反跳及不良反应严重的缺点[8,9]。
近年来多项临床及临床前研究证实抗血管生成药物与小剂量化疗联合应用能产生协同抗肿瘤作用[10]。多西紫杉醇(Docetaxel,DOC)作为治疗乳腺癌的一线药物,在临床上已广泛应用,低剂量的DOC可以有助于打破机体对肿瘤的免疫耐受作用,增强疫苗诱导机体抗肿瘤免疫应答。故而在本实验中,我们将低剂量的DOC与HUVEC疫苗联用,在小鼠EMT-6人工肺转移模型中考察两者联合能否产生协同抗肿瘤转移作用,并探讨协同抗肿瘤作用的机制。
1 材料与方法
1.1材料
1.1.1动物与试剂 BALB/c小鼠,雌性,4~6周龄,购自济南朋悦实验动物繁育中心[许可证号:SCXK(鲁)20130020];多西紫杉醇(纯度99%)购自上海萨恩化学技术有限公司(批号:EE060142);Cyto Tox 96®试剂盒购自美国Promega公司;IFN-γ检测试剂盒购自美国Cloud-Clone公司;内皮细胞专用培养基ECM购自美国ScienCell公司;RPMI1640培养基购自美国Hyclone公司;胎牛血清。购自杭州四季青生物工程材料研究所;细胞培养用青霉素链霉素混合液、ConA、蓖麻油聚氧乙烯醚(纯度98%,级别GR)购自北京索莱宝科技有限公司;其他试剂均为市售(GR)。
1.1.2细胞株 HUVEC细胞购自美国ATCC细胞库,于ECM内皮细胞专用培养基,5%CO2条件下培养。EMT-6小鼠乳腺癌细胞购自中国上海弘顺生物科技有限公司,5%CO2条件下培养于含10%胎牛血清的RPMI1640培养液中。
1.2方法
1.2.1DOC及HUVEC疫苗的制备 蓖麻油聚氧乙烯醚与无水乙醇1∶1配成混合溶液,每毫升混合液中含有8 mg的DOC,用混合液将配好的溶液稀释至2 mg/ml。收集3~5代HUVEC细胞,调整浓度至1×107ml-1。细胞离心后,取1 ml PBS溶解重悬细胞制成HUVEC疫苗。
1.2.2小鼠乳腺癌模型的建立 将BALB/c小鼠随机分为:阴性对照组(PBS组)、疫苗组(HUVEC组)、多西紫杉醇组(DOC组)、联合治疗组(HUVEC-DOC组)4组,每组6只小鼠。将对数生长期的EMT-6细胞调整浓度至5×106ml-1,每只小鼠尾静脉注射0.1 ml的肿瘤细胞悬液,建立EMT-6小鼠乳腺癌肺转移模型。分别于荷瘤后的第1、6和12天,每只小鼠左肋部皮下注射相应药物,其中HUVEC组皮下注射HUVEC 疫苗100 μl,DOC组腹腔注射100 μl DOC、联合治疗组皮下注射100 μl的HUVEC疫苗并于腹腔注射100 μl DOC,阴性对照组通过皮下和腹腔各注射100 μl的PBS。建立模型后第21天处死所有小鼠,取肺,将肺组织于Bouin固定液(饱和苦味酸∶甲醛∶冰醋酸=75∶25∶5)中固定24 h,无水乙醇浸泡脱色,拍照,观察肺转移结节数量,并对肺组织切片进行HE染色,观察乳腺癌转移情况。
1.2.3脾淋巴细胞增殖实验 荷瘤后第21天处死小鼠,无菌取脾,将脾剪碎置于200目的筛网上,研磨过筛,制备脾细胞悬液,加红细胞裂解液,洗涤3次,重悬细胞,将上述脾淋巴细胞悬液过70 μm尼龙网,富集T淋巴细胞,1640培养基培养,调整细胞浓度为2×106ml-1,加入到96孔板中,每孔加入100 μl,同时各组加入空白培养基(PBS)为阴性对照组,5 mg/L的ConA(阳性对照组),100 μg/ml的HUVEC裂解液(实验组)。培养箱培养72 h,每孔加入20 μl的MTT,继续避光孵育3~4 h,最后每孔加入100 μl的二甲基亚砜,570 nm处测OD值。
1.2.4CTL实验 荷瘤后第21天处死小鼠无菌取脾,研磨通过200目细胞筛,红细胞裂解液裂解后,离心洗涤3遍,制备脾淋巴细胞悬液,1640培养基培养,作为效应细胞。收集HUVEC细胞,作为靶细胞,调整细胞浓度为2×105ml-1。调整两种细胞的浓度,按效靶比为200∶1、100∶1、50∶1、25∶1置于96孔尖板中,37℃、5%CO2培养4 h,按试剂盒进行操作,吸50 μl培养上清到96孔平板中,加入50 μl CytoTox 96试剂,避光室温孵育30 min,最后每孔加入50 μl的终止液终止反应,用酶标仪检测490 nm处的OD值。释放率(%)=(实验组OD-效应细胞自发OD-靶细胞自发OD)/(靶细胞最大OD-靶细胞自发OD)×100% 。
1.2.5IFN-γ检测 荷瘤后第21天处死小鼠无菌取脾,研磨通过200目细胞筛,红细胞裂解液裂解后,离心洗涤3遍,制备脾淋巴细胞悬液,1640培养基培养,培养24 h后取上清备用。实验中使用IFN-γ 试剂盒进行检测,实验试剂按说明书配制,设置空白孔,标准品孔及样品孔,每孔100 μl,均设置3个复孔。37℃孵育2 h。加检测试剂A:孵育结束后弃去液体,不要洗板,每孔加入100 μl检测试剂A,37℃孵育1 h,洗涤3次。每孔加入100 μl的检测试剂B,再次洗涤,加显色液(TMB),37℃避光孵育15~25 min。加50 μl的终止液,酶标仪测定450 nm 处的OD值。
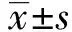
2 结果
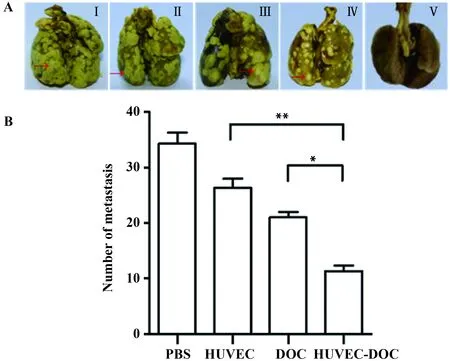
图1 HUVEC疫苗联合DOC协同抗EMT-6乳腺癌转移作用小鼠肺脏转移灶 B单位面积内肿瘤转移灶数目Fig.1 Synergistic anti-metastasis effects of HUVEC vaccine combined with DOC in EMT-6 breast cancerNote:A.Lung metastasis in mice (Ⅰ.PBS;Ⅱ.HUVEC;Ⅲ.DOC;Ⅳ.HUVEC-DOC;Ⅴ.Healthy mouse);B.The unit area numbers of metastasis.*.P<0.05,vs HUVEC group;**.P<0.01,vs DOC group.
2.1HUVEC疫苗联合DOC协同抗乳腺癌转移作用 为考察HUVEC-DOC联合治疗在治疗性免疫中对肿瘤转移的抑制作用,建立了小鼠EMT-6乳腺癌人工肺转移模型。实验结果如图1所示,与PBS组相比,各给药组肿瘤转移灶的数目均有所减少,其中HUVEC-DOC联合治疗组肺脏肿瘤转移灶数目最少,与HUVEC及DOC单药组间差异显著,有统计学意义(P<0.01 vs HUVEC,P<0.05 vs DOC)。
2.2肺脏组织HE染色结果 为进一步确定HUVEC-DOC联合治疗抑制肿瘤转移的作用,对各组小鼠的肺脏进行了病理组织学观察。结果如图2所示,PBS组、HUVEC疫苗组以及DOC化疗药物组均出现了不同程度的肿瘤细胞浸润,而联合治疗组的肺组织结构相对完整,肿瘤转移灶数目最少,这进一步说明HUVEC-DOC联合治疗显示了良好的抗肿瘤转移的作用。
2.3淋巴细胞增殖反应 为考察HUVEC-DOC联合治疗引起的细胞免疫应答水平,取不同处理组小鼠的脾脏进行了脾淋巴细胞增殖实验。实验结果如图3所示,与PBS组相比,HUVEC疫苗组和HUVEC-DOC联合治疗组小鼠的脾淋巴细胞对HUVEC抗原均能产生不同程度的增殖反应,其中HUVEC-DOC组脾淋巴细胞增殖反应更加明显,与HUVEC组具有显著性差异(P<0.05),其刺激程度接近于ConA阳性对照组。
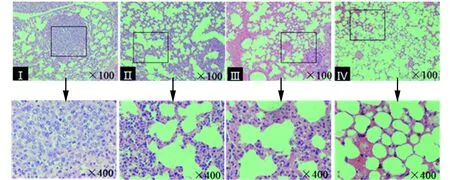
图2 肺脏组织HE染色结果Fig.2 Histopathology study of lung tissuesNote:Ⅰ.PBS;Ⅱ.HUVEC;Ⅲ.DOC;Ⅳ.HUVEC-DOC.

图3 脾淋巴细胞增殖实验结果Fig.3 Effect of different administration on T lymphocytes proliferationNote:*.P<0.05,vs HUVEC group;**.P<0.01,vs DOC group.
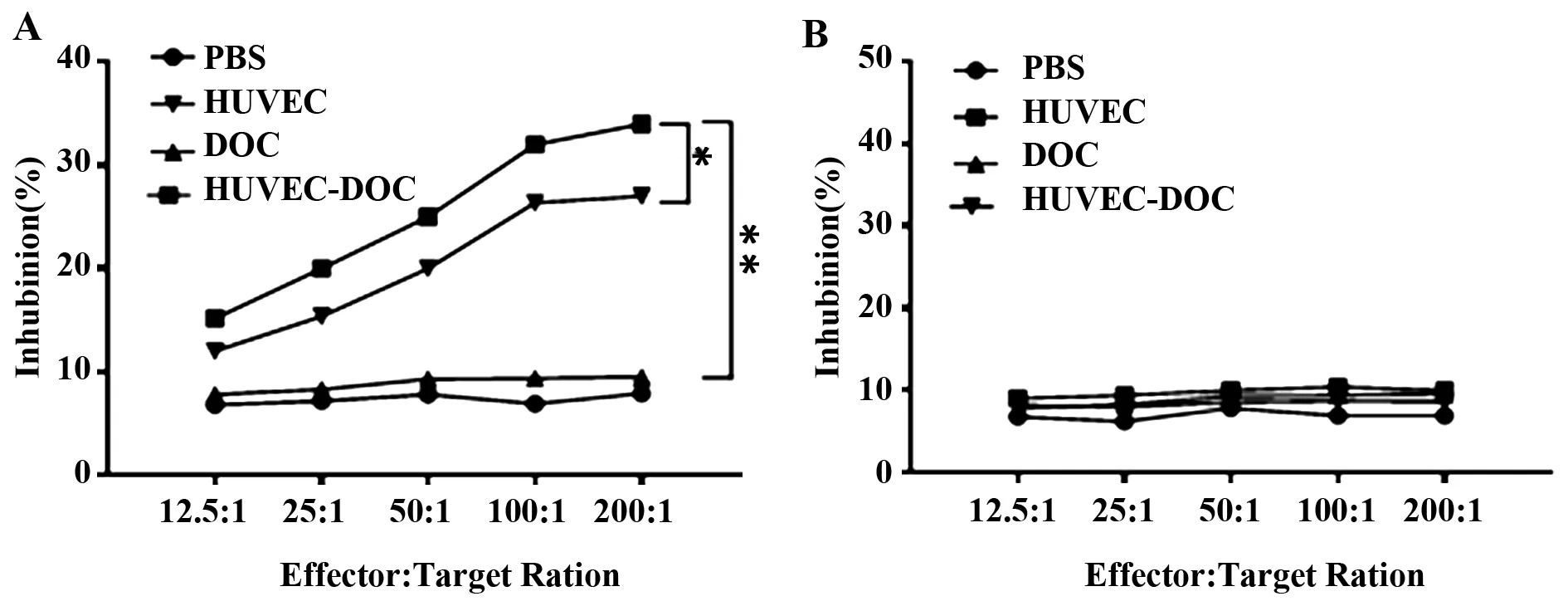
图4 细胞毒性T淋巴细胞杀伤检测Fig.4 Level of CTLs induced by different administrationNote:*.P<0.05,vs HUVEC group;**.P<0.01,vs model group.
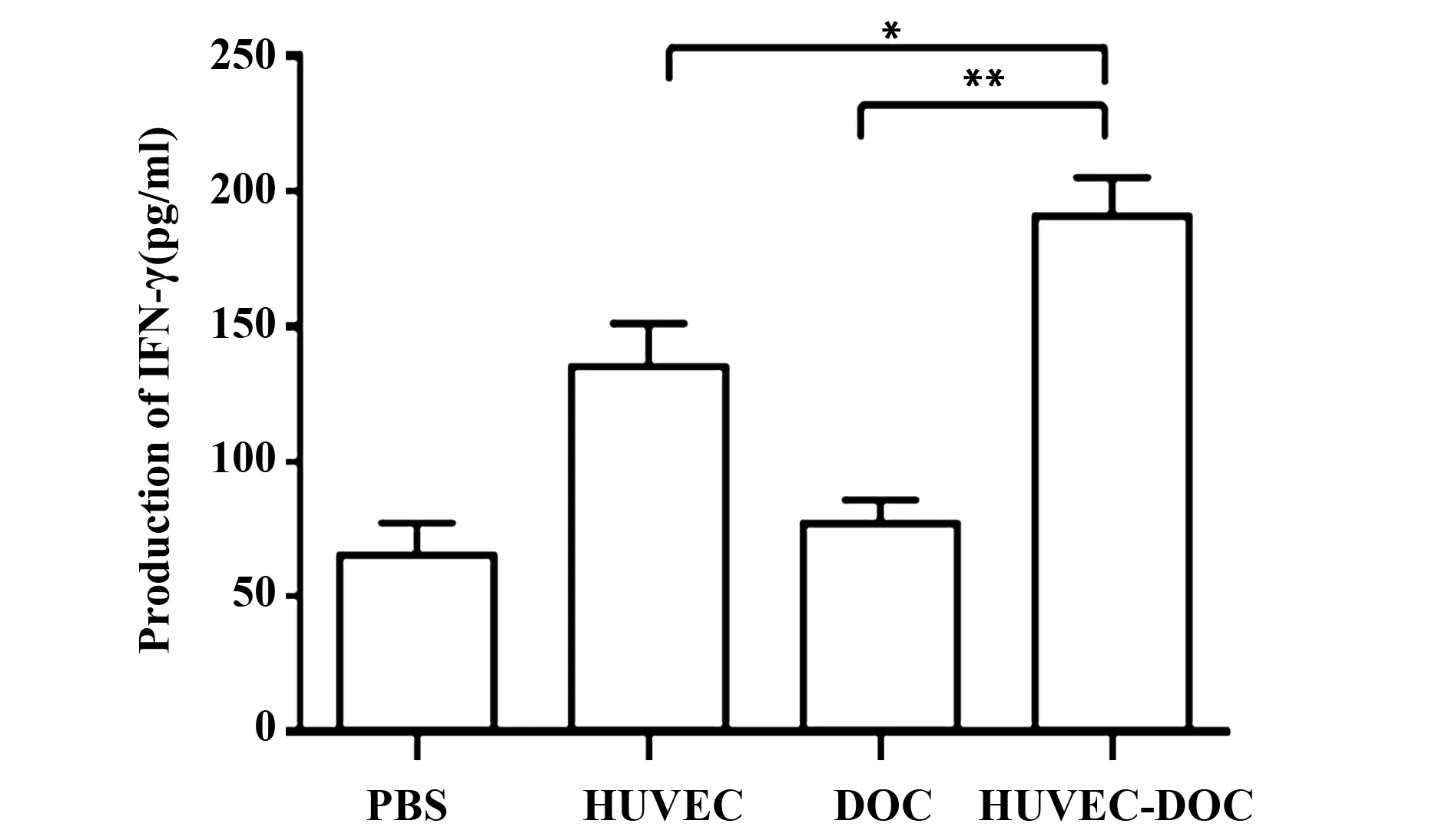
图5 IFN-γ的含量Fig.5 Content of IFN-γ Note:*.P<0.05,vs the HUVEC group;**.P<0.01,vs DOC group.
2.4CTL杀伤活性检测 如图4A所示,当靶细胞为HUVEC细胞时,与PBS组相比,HUVEC和HUVEC-DOC组T淋巴细胞杀伤活性随效靶比的上升而逐渐提高,其中HUVEC-DOC组最为显著。当效应细胞为EMT-6小鼠乳腺癌细胞时,各组小鼠的T淋巴细胞均对EMT-6细胞没有杀伤活性(图4B),这说明HUVEC-DOC联合免疫诱导的细胞免疫应答是HUVEC特异性的。
2.5IFN-γ含量 我们用ELISA法检测了不同处理组小鼠脾淋巴细胞培养上清中IFN-γ的含量,进一步确证HUVEC-DOC联合治疗引起的细胞免疫应答强度。如图5所示,与PBS组相比,HUVEC和HUVEC-DOC组INF-γ含量都有不同程度的提高,其中HUVEC-DOC组INF-γ含量提高尤为明显,较HUVEC组有显著性差异(P<0.05)。
3 讨论
侵袭及转移是乳腺癌细胞重要的病理学特性,也是乳腺癌致死的重要原因,抑制乳腺癌细胞的侵袭和转移是治疗乳腺癌的关键。传统的治疗方法,如手术治疗、放射治疗、化学治疗针对恶性肿瘤转移的药效都很局限。研究已证实肿瘤的生长及转移是血管依赖的,抑制肿瘤新生血管可以有效地抑制肿瘤生长和转移。目前临床应用的抗血管生成药物主要为单克隆抗体和小分子受体抑制剂,半衰期短、价格昂贵、毒副作用比较大等缺点,一定程度上限制了其在临床上的应用。随着免疫学技术的不断发展,采用疫苗以主动免疫的方式免疫机体获得持续的靶向肿瘤新生血管的免疫应答,可以有效控制肿瘤的生长和转移,是对传统抗血管生成治疗方案的有益补充。
研究显示持续小剂量的化疗可以增强机体的免疫应答水平,主动治疗联合小剂量化疗能较彻底地杀伤肿瘤细胞,有效防止肿瘤的复发和转移[11,12]。近年来研究中发现小剂量的DOC在肿瘤联合治疗方案中有较好的协同抗肿瘤作用[13,14],在本实验中,我们将低剂量DOC与前期研究的HUVEC疫苗联用,期望可以进一步提升HUVEC疫苗的抗肿瘤作用,并利用小鼠EMT-6人工肺转移模型考察HUVEC-DOC联合治疗方案抗肿瘤转移的作用。实验结果显示:与HUVEC及DOC单药组相比,HUVEC-DOC联合治疗组小鼠肺部肿瘤转移灶明显减少,这说明HUVEC疫苗与DOC联用可起到协同抗肿瘤转移的作用。小鼠脾淋巴细胞增殖实验、CTL杀伤实验的结果显示及IFN-γ含量测定实验结果证实HUVEC-DOC联合治疗组的脾淋巴细胞增殖能力和CTL杀伤能力均显著增强,IFN-γ含量也有一定程度的升高。以上结果说明低剂量的DOC与HUVEC疫苗联用可以增强HUVEC疫苗引起的特异性细胞免疫应答,这也是HUVEC-DOC联合治疗方案可以产生协同抗乳腺癌转移的可能原因。
综上所述,本研究证实低剂量的化疗药DOC与HUVEC疫苗联用可以产生协同抗乳腺癌转移的作用,DOC引入后可以增强HUVEC疫苗特异性的细胞免疫应答,是该联合治疗方案可以产生协同抗肿瘤转移作用的原因,该实验结果可以为临床上抗乳腺癌转移治疗方案提供新思路。
[1] Xu X,Lv YG,Yan CY,etal.Enforced expression of hsa-miR-125a-3p in breast cancer cells potentiates docetaxel sensitivity via modulation of BRCA1 signaling[J].Biochem Biophys Res Commun,2016,479(4):893-900.
[2] Morrison JM,Williams MM,Hicks DJ,etal.Two distinct mTORC2-dependent pathways converge on Rac1 to drive breast cancer metastasis[J].Breast Cancer Res,2017,19(1):74.
[3] Parra K,Valenzuela P,Lerma N,etal.Impact of CTLA-4 blockade in conjunction with metronomic chemotherapy on preclinical breast cancer growth[J].Br J Cancer,2017,116(3):324-334.
[4] Zhao W,Cheng R,Lim SH,etal.Biocompatible and label-free separation of cancer cells from cell culture lines from white blood cells in ferrofluids[J].Lab Chip,2017,17(13):2243-2255.
[5] Mu X,Fang C,Zhou J,etal.Fusion with human lung cancer cells elongates the life span of human umbilical endothelial cells and enhances the anti-tumor immunity[J].J Cancer Res Clin Oncol,2016,142(1):111-123.
[6] Lee I,Lieberman BP,Li S,etal.Comparative evaluation of 4 and 6-carbon spacer conformationally flexible tetrahydroisoquinolinyl benzamide analogues for imaging the sigma-2 receptor status of solid tumors[J].Nucl Li XQ,Han YZ,Zeng LR,etal.Expression and significance of Notch1 and JAG1 proteins in different subtypes of breast cancer[J].Chin J Cancer Prevention Treatment,2017,24(5): 297-301.Med Biol,2016,43(11):721-731.
[7] Xu ML,Zhang YL,Zhou L,etal.Anti-metastasis effect in mouse hepatocellular carcinoma modelOf vaccination with endothelial cells plus picibanilOK432 as adjuvant[J].Chin J Pharmacol Toxicol,2015,29(1):14-21.
[8] Xu M,Zhou L,Zhang P,etal.Enhanced antitumor efficacy by combination treatment with a human umbilical vein endothelial cell vaccine and a tumor cell lysate-based vaccine[J].Tumour Biol,2013,34(5):3173-3182.
[9] Sierro SR,Donda A,Perret R,etal.Combination of lentivector immunization and low-dose chemotherapy or PD-1/PD-L1 blocking primes self-reactive T cells and induces anti-tumor immunity[J].Eur J Immunol,2011,41(8):2217-2228.
[10] Klement G,Baruchel S,Rak J,etal.Continuous low-dose therapy with vinblastine and VEGF receptor-2 antibody induces sustained tumor regression without overt toxicity[J].J Clin Invest,2000,105(8):15-24.
[11] Berndsen RH,Abdul UK,Weiss A,etal.Epigenetic approach for angiostatic therapy:promising combinations for cancer treatment[J].Angiogenesis,2017,20(2):245-267.
[12] Zhao C,He J,Cheng H,etal.Enhanced therapeutic effect of an antiangiogenesis peptide on lung cancer in vivo combined with salmonella VNP20009 carrying a Sox2 shRNA construct[J].J Exp Clin Cancer Res,2016,35(1):107.
[13] Diaz Y,Tundidor Y,Lopez A.Concomitant combination of active immunotherapy and carboplatin-or paclitaxel-based chemotherapy improves anti-tumor response[J].Cancer Immunol Immunother,2013,62(3):455-469.
[14] Zhang C,Li HZ,Qian BJ,etal.MTDH/AEG-1-based DNA vaccine suppresses metastasis and enhances chemosensitivity to paclitaxel in pelvic lymph node metastasis[J].Biomed Pharmacother,2015,70:217-226.