抗B7-H4-scFv/PE38KDEL重组免疫毒素的表达和功能性检测①
2018-03-23纪洪帅郭锦瑞毛伟平
纪洪帅 郭锦瑞 杨 颖 毛伟平
(江苏省分子医学重点实验室,南京师范大学生命科学学院,南京 210046)
B7家族是尤为重要的共刺激分子,其中B7-H4分子是B7家族近年来发现的一个负性共刺激分子[1],它可以抑制T 细胞的应答,在免疫抑制微环境中有着很大的作用。B7-H4的mRNA 普遍存在于人的各种组织和器官中,如肾脏、卵巢、肺、脾脏、胰腺等。但B7-H4蛋白在非淋巴正常组织中呈现出低表达或不表达,而在某些肿瘤组织中高表达[2]。Choi等[3]用免疫组化实验来检测各种组织中B7-H4蛋白的表达情况,结果表明,B7-H4蛋白在肺癌和卵巢癌中高表达,正常组织中则未检测出 B7-H4 蛋白的表达。在其他肿瘤组织中也都检测出了B7-H4 分子的异常高表达,这揭示了肿瘤细胞逃避宿主免疫系统的监视可能与B7-H4分子有一定的关联[4,5]。因此,可以将B7-H4分子作为肿瘤诊断及治疗中一个潜在的靶标分子。
靶向治疗(Targeted therapy)是在细胞分子水平上,针对明确的致癌位点,来设计相应的治疗药物,该药物在体内能特异性结合致癌点并发生作用,使肿瘤细胞死亡,而不波及周围的正常组织细胞。重组免疫毒素(Recombinant immunotoxins)就是肿瘤靶向治疗的一种新方法,一般是将动植物或细菌来源的生物毒蛋白与抗体组合一起,定向攻击肿瘤细胞,而对正常组织杀伤较小,被形象地称为“生物导弹”[6]。抗体端负责与细胞表面或细胞因子受体结合,而毒素端负责引发细胞死亡[7]。由于靶向治疗的特异性强,在杀伤肿瘤细胞时基本不损伤正常组织,所以抗肿瘤药物的研发重点正在从传统的抗肿瘤药物转向靶向抗肿瘤药物。如有研究者运用抗 HER2(人类表皮生长因子受体2)受体单链抗体与假单胞菌属外毒素 ETA(Pseudomonas aeruginosa exotoxin)连接构造了免疫毒素,且在体外实验表明该免疫毒素可以有效地抑制肿瘤细胞的增长[8]。本研究旨在建立以抗B7-H4单链抗体(Single chain antibody,scFv)为靶标的重组免疫毒素anti-B7-H4-scFv/PE38KDEL,利用单链抗体的靶向性和毒素分子的致毒性联合起到杀伤肿瘤细胞的作用。
1 材料与方法
1.1实验材料、试剂 pET28a(+)载体质粒、克隆菌株大肠杆菌(Escherichia coli )DH5α、表达菌株大肠杆菌(Escherichia coli )BL21(DE3)、含有重组质粒anti-B7-H4-scFv/pET43.1a 的DH5α、293a/T人肾上皮细胞、MCF-7 人乳腺癌细胞、A549 人肺癌细胞、HepG2 人肝癌细胞,均由南京师范大学生命科学学院的江苏省分子医学重点实验室保存;T4 DNA 连接酶、DNA Marker、Phanta Max Super-Fidelity DNA polymeras、Taq DNA polymerase、pMD19-T Vector 购自南京诺唯赞生物公司;EcoRⅠ限制性内切酶和NotⅠ限制性内切酶,购自日本TaKaRa公司;紫杉醇、抗 His 标签抗体、HRP标记的羊抗鼠 IgG、Alexa Fluor 488-conjugated标记的IgG,购自中国上海生工生物工程技术服务公司;PE38KDEL基因片段的合成、PCR 引物,合成于南京金凯瑞生物公司;SPF 级雌性BALB/c裸鼠,购自于南京大学模式动物中心;细胞培养6孔板和96孔板、HyClone、胎牛血清四季青、1 ml注射器、Biomiga 质粒提取试剂盒、DNA纯化试剂盒,购自中国南京丁贝生物科技有限公司,其他常规生化试剂均为国产分析纯。
1.2实验方法
1.2.1引物的合成 PE38KDEL基因是由南京金凯瑞公司合成,基因序列来自GenBank(version) K012397.1 GI:151215,进行大肠杆菌优化后合成并亚克隆到pUC-57simple质粒中,最后进行测序鉴定。引物P1为5′-AGATGCAGCCGGTGGCTCAGGC-GGTGGTAGCC-3′,下划线是连接肽Linker(Gly3Ser)3,引物P2为5′-ATAAGAATGCGGCCGCCAGTTCA-TCTTTAGGC-3′,下划线是NotⅠ的酶切位点;根据本实验之前已获得的抗B7-H4单链抗体的基因序列,合成的引物序列P3和P4,引物P3是5′-CGCGAATTCAAAGTGCAGCTGG-3′,下划线是EcoRⅠ的酶切位点,P4是5′-GGCTACCACCGCCTGAGCCACCGGCTGCATCT-3′,下划线是连接肽Linker。
1.2.2目的基因的扩增和连接 利用PCR技术,分别以实验室含有anti-B7-H4-scFv/pET43.1a 重组质粒的DH5α 菌液为模板和含有PE38KDEL基因的pUC-57质粒的穿刺菌液为模板,扩增出anti-B7-H4-scFv基因和毒素PE38KDEL基因。PCR 扩增这两段基因使用的体系和条件是一样的,扩增anti-B7-H4-scFv基因所用的引物是P3和P4,扩增PE38KDEL基因所用的引物是P1和P2。50 μl PCR反应体系:10×pfu Buffer with MgSO45 μl、dNTP Mix 2 mmol/L及引物P1、P2和模板各2 μl,双蒸水补足至50 μl。反应条件:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃退火30 s,共30个循环;72℃延伸5 min。反应结束后,将 PCR 产物在1%琼脂糖凝胶电泳跑胶,进行割胶回收。利用SOE-PCR技术将PE38KDEL基因与anti-B7-H4-scFv这两段基因连接。由于在引物设计时已考虑到后面SOE-PCR的特点,所以根据PE38KDEL基因与anti-B7-H4-scFv 这两段基因所设计的的引物 P1和 P4 中各包含有一段重叠基因 Linker,首先让PE38KDEL 与 anti-B7-H4-scFv 这两段基因互为模板进行10次循环使两段基因自连;然后向反应体系中加入引物P2 和 P3,进行再次PCR 反应,反应条件设置30次循环,反应其他条件则不变。PCR 反应结束后,对目的条带进行割胶回收。将回收的目的基因anti-B7-H4-scFv-PE38KDEL与pUM19-T vector按照试剂盒进行T-A 克隆。之后进行菌落PCR鉴定,并根据菌落 PCR 的结果挑取阳性克隆的菌种样品送至公司进行测序鉴定,测序结果正确的菌株保存备用。
1.2.3重组表达载体的构建 取含有空载质粒pET28a(+)的DH5α菌株50 μl涂于含有氨苄抗性(Amp+)的平板上,次日,挑取平板上长出的阳性克隆,于37℃、220 r/min的培养箱中过夜培养,第二天根据Biomiga试剂盒提取pET28a(+)质粒,测试质粒浓度后,用 EcoRⅠ和 NotⅠ限制性内切酶对 pET28a(+)质粒和anti-B7-H4-scFv-PE38KDEL 基因进行双酶切。50 μl双酶切体系:10 × Buffer H、BSA、Triton各5 μl,EcoRⅠ和NotⅠ各1 μl,1~2 μg pET28a(+)质粒和anti-B7-H4-scFv-PE38KDEL 基因分别10 μl,剩下双蒸水补足。双酶切条件:37℃ 水浴3 h。双酶切后,将目的条带割胶回收进行酶连反应。酶连体系:10×T4 Buffer 2.5 μl,T4 DNA Ligase 1 μl,pET28a(+)质粒和anti-B7-H4-scFv-PE38KDEL 基因各4 μl。酶连条件:16℃ 水浴过夜。将上述连接产物转化到E.coli DH5α感受态细胞中,步骤同TA克隆。经测序正确后获取一目的菌株。提取测序正确的重组菌株的质粒pET28a-anti-B7-H4-scFv-PE38KDEL,并将质粒转化至E.coli BL21(DE3)感受态细胞中。
1.2.4重组毒素的表达、纯化和检测 将含有正确pET28a-anti-B7-H4-scFv-PE38KDEL重组载体质粒的BL21(DE3)大肠杆菌在37℃,220 r/min的条件下过夜培养。次日早上取40 μl 菌液转接到4 ml含有卡纳抗性(Kan+)的新鲜 LB 培养基中,在37℃,220 r/min震荡培养3 h,使 OD 值约为0.6时,加入诱导剂异丙基-β-D-硫代半乳糖苷(IPTG),在IPTG不同的终浓度(0.2、0.4、0.6、0.8、1 mmol/L)及不同的诱导时间(2、4、6、8、10、12 h)下进行蛋白的诱导表达。收集表达菌液,离心弃上清,PBS重悬。将重悬的菌液进行超声处理,跑 SDS-PAGE胶分析蛋白的表达情况,并找出最优表达条件。在最佳诱导表达条件下扩大培养并收集上清和沉淀,将包涵体沉淀物进行变复性处理以获得更多可溶性的上清,先用2 mol/L尿素变性液(2 mol/L Urea、0.5 mol/L NaCl、20 mmol/L Tris-HCl、5 mmol/L imidazole)轻轻吹起包涵体,使溶液由浑浊至澄清,在高速冷冻离心机离心20 min,分别收集上清和沉淀。再分别用4 mol/L(4 mol/L Urea、0.5 mol/L NaCl、20 mmol/L Tris-HCl、5 mmol/L imidazole)、6 mol/L(6 mol/L Urea、0.5 mol/L NaCl、20 mmol/L Tris-HCl、5 mmol/L imidazole)尿素变性液轻轻吹起上步的包涵体剩余物,分别收集上清和沉淀。实验所得的目的蛋白是将目的基因亚克隆到 pET28a(+)载体质粒中,保留其带His标签的区域,所以其表达的产物带有此标签,而带有His标签的蛋白可与镍柱结合,以此纯化上清中的可融蛋白,然后用不同浓度的咪唑(20、50、100、200和300 mmol/L)洗脱蛋白并收集洗脱液,收集所有的洗脱液。把洗脱的蛋白液装入煮过的透析袋中,并用含有8 mol/L尿素的复性液(20 mmol/L Tris-HCl、0.5 mol/L argnine、1 mol/L EDTA、1 mol/L GSH、1 mol/L MGSSG)做透析液,透析 36 h,每隔12 h更换一次透析液,最后用硝酸纤维素钠将透析过后的蛋白进行浓缩,收集,进行Western blot 鉴定。
1.2.5间接ELISA方法鉴定纯化后的毒素和抗原的亲和性 用抗原包被液将B7-H4抗原蛋白稀释到终浓度5 μg/ml,100 μl/孔包被于96孔板,设置5个复孔,4℃过夜敷育。次日早上取出,先用100 μl/孔预冷的PBST隔10 min洗一次,洗3次。再用10% BSA封闭液于37℃敷育2 h,100 μl/孔。取出板子100 μl/孔预冷的PBST洗3次。每孔加入不同浓度的免疫毒素(100、10、1、0.1、0.01、0.001 μg/ml),同时设空白PBS组和对照组BSA组,100 μl/孔,37℃敷育1 h。取出板子用100 μl/孔预冷的PBST洗3次。每孔加入anti-His抗体100 μl,37℃敷育1 h。取出板子PBST洗3次。加HPR 标记的羊抗鼠 IgG 抗体,100 μl/孔,37℃敷育1 h。取出板子PBST洗3次,加 3,3′,5,5′-四甲基联苯胺(TMB)底物显色液,100 μl/孔,37℃避光显色20 min。取出板子每孔直接加入50 μl 终止液(2 mol/L H2SO4),终止反应。终止反应静置5 min后,立即在酶标仪上测490 nm处的OD值。
1.2.6流式细胞术检测重组毒素与细胞的结合活性 采用间接荧光标记的方法,运用流式细胞术检测免疫毒素对靶细胞的结合活性。复苏实验室冻存的人源乳腺癌细胞MCF-7、人源肝癌细胞HepG2、正常人肾皮细胞293a,用加了双抗(链霉素和青霉素,终浓度都为100 U/ml)的10% 胎牛血清的 DMEM 新鲜培液培养,细胞培养至对数期,用胰酶消化下来,以1×105/孔的密度接种于6孔板,过夜培养;去培液,预冷的PBS轻轻洗涤4次;用5% BSA 4℃封闭1 h,PBS洗涤4次;加入复性的免疫毒素,轻轻吹打均匀,4℃孵育1 h,PBS洗涤4次;加入适当稀释(1∶5 000)的兔抗鼠抗His一抗,混吹均匀,4℃敷育1 h,PBS洗涤4次;加入适当稀释的Alexa Fluor 488-conjugated标记的荧光IgG,混匀,4℃避光敷育1 h ,PBS洗3次后重新用PBS重悬,流式细胞仪检测。
1.2.7MTT检测细胞增殖 将MCF-7、HepG2、293T这3种细胞,在 37℃、5%CO2培养箱中过夜培养。培养细胞至对数期,稀释计数后于1×104ml-1种于96孔板,每孔100 μl,培养过夜使细胞贴壁。用无菌PBS稀释重组毒素,设5个浓度梯度(100、10、1、0.1、0.01 μg/ml),5个复孔,各加150 μl,阴性对照加同等量的无菌PBS,分别培养12、24、36、48 h,显微镜下观察。每孔加20 μl的3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)溶液,继续培养4 h。终止培养,去培液,各孔分别加150 μl DMSO,避光震荡10 min,待晶体完全溶解后,于酶标仪读数OD570 nm,计算细胞存活率。细胞存活率(%)=实验组OD570 nm/对照组OD570 nm×100%。
1.2.8肿瘤移植模型 培养人源肺癌细胞A549,待细胞生长状态良好且长到实验所要求数量时,处理细胞,最后用无血清的培养基重悬细胞并将细胞浓度调整为 1×107个/ml。选取的动物是20只SPF级雌性裸鼠,体重为16~18 g,周龄为4~6周。注射前轻轻弹动细胞悬液以防细胞贴壁,选择裸鼠后腿根外侧进针,用针头轻挑起后腿根部皮肤,轻轻左右晃动看针头是否刺入皮下,易摆动表示已进入皮下,缓慢注入细胞悬液,抽针时要快速并用棉球压住针头以防液体渗出。之后每天观察小鼠生活状态以及肿瘤生长状况,待肿瘤体积生长至80~100 mm3左右时挑选生长状态良好且肿瘤大小均一性较好的荷瘤鼠18只,随机分成3组即空白对照组、阳性对照组和实验组,开始隔天给药。空白组皮下注射 100 μl无菌生理盐水,阳性对照组注射100 μl 5 mg/kg 紫杉醇,受试药组皮下注射无菌过滤后的5 mg/kg重组毒素 anti-B7H4-scFv-PE38KDEL 100 μl。从给药开始隔天用游标卡尺测量小鼠皮下肿瘤瘤径并对小鼠体重作记录。实验结束,处死荷瘤鼠,手术剥去瘤块并称重。
1.2.9肿瘤组织HE染色及病理学形态观察 从剥离下来的瘤块中,各组随机挑选3个进行 HE 染色分析。称完瘤重后立即切取瘤块,浸于4%多聚甲醛中固定 24 h。用自来水冲洗固定好的瘤块。按照50%乙醇、75%乙醇、85%乙醇、95%乙醇 Ⅰ、95%乙醇 Ⅱ、100%乙醇 Ⅰ、100%乙醇 Ⅱ 的顺序进行脱水,各浸泡2 h。脱水后的瘤块于二甲苯中进行透明处理。将透明处理后的瘤块浸于蜡中,随后进行石蜡包埋。使用切片机切片,厚度为 5 μm,于 45℃ 温水中烫平,贴于干净载玻片上,45℃ 恒温箱烘干。二甲苯进行脱蜡两次,每次 5 min。按照无水乙醇、95%乙醇、90%乙醇、80%乙醇、70%乙醇、蒸馏水的顺序进行复水,各浸泡5 min。苏木素染色 5 min、清水清洗、1% 盐酸酒精分化 5 min、1% 氨水浸泡1 min、清水冲洗、1%伊红染色 2 min。按照75%乙醇、85%乙醇、95%乙醇Ⅰ、95%乙醇 Ⅱ、100%乙醇 Ⅰ、100%乙醇 Ⅱ 的顺序进行脱水,各浸泡2 min。二甲苯Ⅰ浸泡5 min,二甲苯Ⅱ浸泡 5 min。用中性树胶进行封片,然后在显微镜下进行观察。
1.2.10免疫组化分析 石蜡切片脱蜡至水。PBS清洗3次,每次5 min。加入配好的0.3%的过氧化氢甲醇溶液(甲醇80 ml+0.01 mol/L PBS 100 ml+30%H2O2)30 min,以消除内源性过氧化物酶的影响,PBS清洗3次,每次5 min。加入配好的0.3% Triton×100孵育30 min,以增加细胞的通透性,PBS清洗3次,每次5 min。加入稀释的一抗(1∶1 000),4℃孵育过夜,次日吸去抗体,PBS清洗3次,每次5min。加入稀释的二抗,室温孵育2 h,PBS清洗3次,每次5 min。加入ABC复合物之类的抗体,室温孵育2 h,PBS清洗3次,每次5 min,自来水迅速冲3次。加入显色液,进行免疫组织化学显色,时间一般不超过30 min,可随时在显微镜下进行观察,待细胞着色而背底颜色较淡时马上吸去显色液,用水迅速冲3次后加入PBS终止反应。梯度酒精脱水之后,封片,拍照。
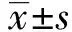
2 结果
2.1重组基因的扩增及鉴定 通过PCR技术分别扩增出的anti-B7-H4-scFv与 PE38KDEL两段基因片段和SOE-PCR得到的重组基因anti-B7-H4-scFv-PE38KDEL,一起经1%的琼脂糖凝胶电泳进行鉴定分析,分别在750 bp与1 000 bp之间及在2 000 bp左右有清晰条带(图1),这与之前实验中所得的研究结果和我们从NCBI中获得的结果以及两段相加所得是符合的。
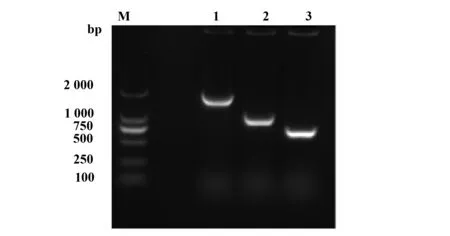
图1 Anti-B7-H4-scFv基因、PE38KDEL基因和anti-B7-H4-scFv/PE38KDEL重组毒素基因Fig.1 Anti-B7-H4-scFv gene,PE38KDEL gene and recombinant toxin gene anti- B7-H4- scFv/PE-38KDELNote:Lane M.DL2000 DNA marker; Lane 1-3.PCR reaction products of gene anti-B7-H4-scFv-PE38KDEL,PE38KDEL and anti-B7-H4-scFv.
2.2重组表达载体的构建、表达、纯化及检测 将构建好的pET28a-anti-B7-H4-scFv/PE38KDEL重组质粒进行双酶切鉴定(图2A),质粒pET28a (+)大小为5 369 bp和目的基因anti-B7-H4-scFv/PE38 KDEL为1 788 bp,在Marker 5 000 bp和2 000 bp左右分别有一清晰亮带。测序结果正确后,把含有正确pET28a-anti-B7-H4-scFv/PE38KDEL重组载体质粒的BL21(DE3)大肠杆菌经IPTG诱导表达后,得到了相对分子质量(Mr)约70 kD左右的蛋白,并带有His标签。经 SDS-PAGE 分析,得出最优表达条件时间是8 h、IPTG终浓度是0.6 mmol/L,且产物主要是以包涵体的形式存在,需要对包涵体沉淀进行变、复性处理以得到更多的可溶性蛋白。用一定浓度的尿素变性液洗涤、重悬沉淀包涵体后,收集变性后的上清液,将上清经过镍柱纯化,并用不同浓度咪唑洗脱下来收集各洗脱液,进行跑胶鉴定(图2B),50、100、150、250 mmol/L的洗脱结果没有单一条带,300 mmol/L的咪唑洗脱出单一蛋白条带,并用Western blot鉴定纯化产物。
2.3间接ELISA鉴定重组毒素蛋白和抗原的亲和性 实验中以PBS作空白对照和BSA作阴性对照,两者十分接近。B7-H4抗原蛋白作为实验组,其结合程度随着抗体蛋白浓度的递减,吸光值变小,与空白PBS组相比差异显著,P<0.05,见图3。
图2 重组载体鉴定及目的蛋白洗脱纯化情况Fig.2 Identification of recombinant vector and purific-ation of the target proteinNote:A.Lane M.DL15000 DNA marker;Lane 1-2.The results of recombinant plasmid after digestion.B.Lane M.Protein with a molecular weight of 100 kD marker;Lane 1.Escherichia coli BL21 (DE3) containing pET-28a (+) plasmid;Lane 2.pET28a-anti-B7-H4-scFv-PE38KDEL Escherichia coli BL21 (DE3) containing recombinant plasmid,supernatant inclusion body with IPTG final concentration of 0 mmol/L;Lane 3.pET28a-anti-B7-H4-scFv-PE38KDEL Escherichia coli BL21 (DE3) containing recombinant plasmid,supernatant of inclusion body with IPTG final concentration of 0.7 mmol/L;Lane 4-8.Eluent with 50,100,150,250 and 300 mmol/L imidazole;Lane 9.Results of purified immunotoxin by WB.
2.4流式细胞术检测重组毒素与细胞的结合活性 通过Western blot鉴定说明,重组毒素蛋白可以和三种细胞中的B7-H4蛋白结合,由于三种细胞中B7-H4蛋白的表达差异,所以结合有差异。分析结果如下(图4),免疫毒素与293a、HepG2、MCF-7三种细胞的结合活性有差异,MCF-7细胞的结合活性比另外两株细胞的结合活性高,说明毒素蛋白与靶细胞的结合是有特异性的。
2.5MTT法检测细胞增殖 为探究重组毒素蛋白对不同细胞株增殖的影响,选取B7-H4蛋白高表达、低表达和不表达的MCF-7、HepG2、293T三种细胞,以PBS作对照组,实验组给予不同浓度(0.01、1.00、100 μg/ml)的除菌过滤的毒素蛋白,结果如图5A所示,毒素蛋白对MCF-7、HepG2这两种细胞的影响较大,且随着浓度的增加,细胞的轮廓变模糊、形态变圆、细胞之间的黏附力变低,呈现出浓度依赖性。此外,MTT实验在5个浓度梯度(0.01、0.1、1.00、10、100 μg/ml)对这3种细胞分别在12、24、36和48 h的条件下进行培养,结果如图5B所示,毒素蛋白对293T细胞的影响是蛋白浓度达到100 μg/ml,时间超过24 h时,细胞细胞存活率有所下降,但高于50%;对MCF-7、HepG2这两种细胞的影响随着浓度梯度的增加细胞存活率下降,并且作用时间持越长,细胞存活率越低,对MCF-7细胞的作用效果尤为明显。
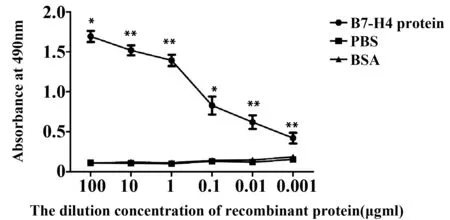
图3 间接ELISA亲和分析Fig.3 Indirect ELISA affinity analysisNote: The data are mean+SEM(n= 5),compared with PBS group,*.P<0.05,**.P<0.01.
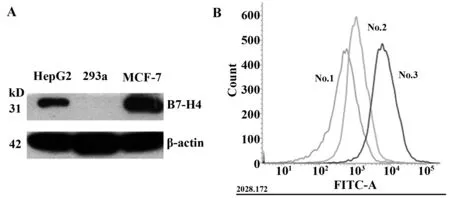
图4 流式结果分析Fig.4 Results of flow analysisNote:A.The blank control group 293a cells, the negative control group HepG2 cells and the experimental group MCF-7 cells B7-H4 protein and the internal reference protein were detected by WB;B.Blank control group 293a cells (No.1 line),negative control group HepG2 cells (No.2 line),experimental group MCF-7 cells (No.3 line) .
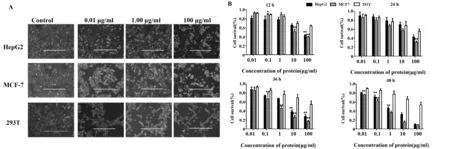
图5 重组毒素蛋白对MCF-7、HepG2、293T细胞增殖的影响Fig.5 Effect of recombinant toxin protein on MCF-7,HepG2,293T cells proliferation(±s,n=5)Note:A.Observations of cell morphology after MCF-7,HepG2 and 293 T cells were treated with PBS and 0.01,1.00,100 μg/ml,respectively;B.Cell survival was detected by MTT assay. 0.01,0.1,1.00,10 and 100 μg/ml toxin protein on MCF-7,HepG2 and 293T cells for 12,24,36 and 48 h,respectively.Compared with the control group,*.P<0.05,**.P<0.01.
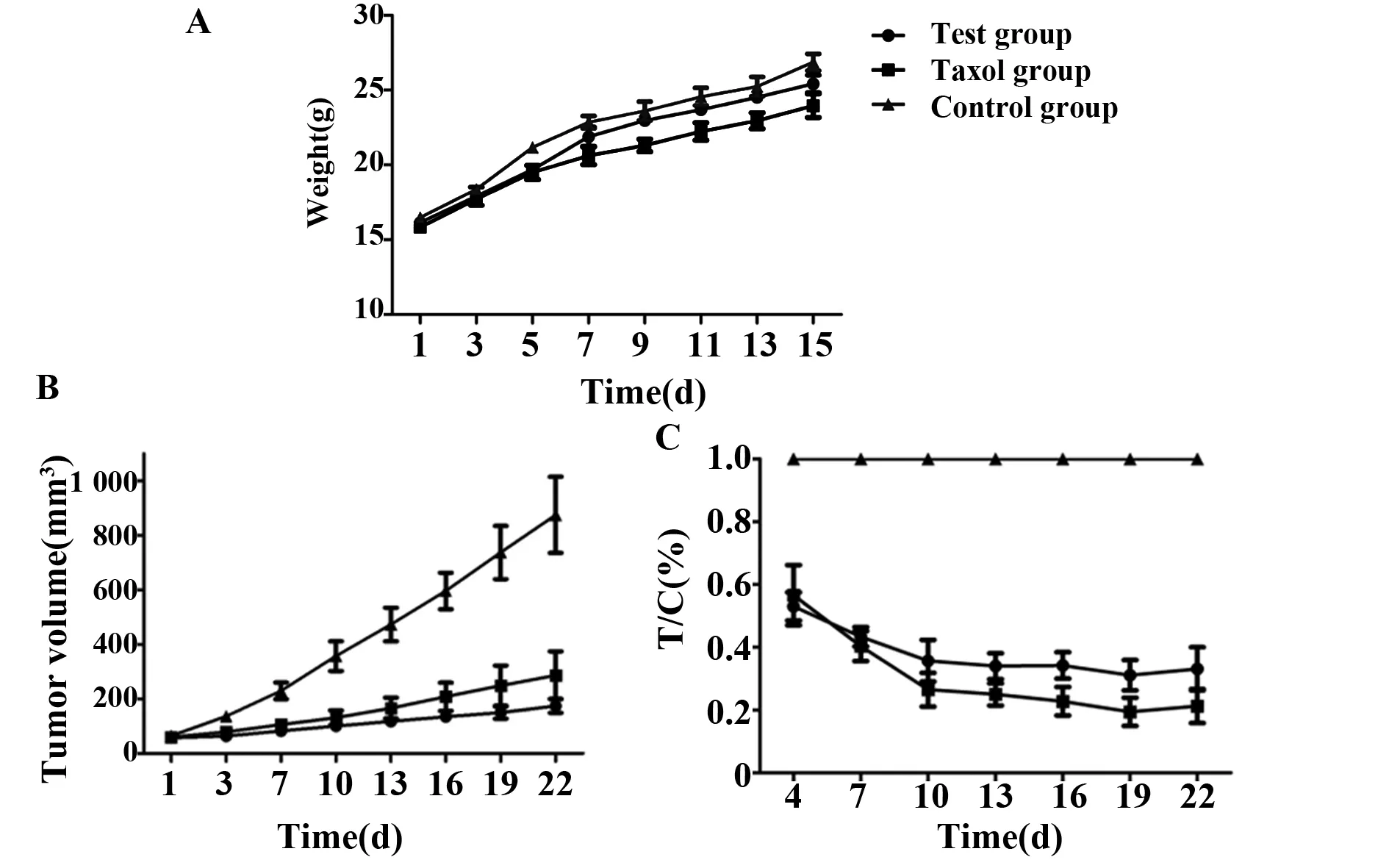
图6 荷瘤鼠体重和瘤体积变化及相对肿瘤增殖率Fig.6 Changes of body weight,tumor volume and relative tumor proliferation rateNote:A.Weight change of tumor-bearing mice after treatment with recombinant toxin protein,paclitaxel and saline for 15 days;B.The tumor volume growth changes after treatment;C.T/C(%) size of the positive drug group,the test group and the blank group.
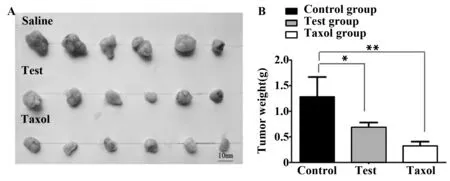
图7 瘤块大小比较及瘤重Fig.7 Comparison of tumor size and tumor weightNote:A.Morphology of three groups of tumor tissues in control group,test group and positive drug group;B.Comparison of tumor weight in the control group,the test group and positive drug group.Compared with the control group,*.P<0.05,**.P<0.01.
2.6荷瘤鼠体重和瘤体积变化 分组给药后每天记录荷瘤鼠的体重及肿瘤瘤径。根据测量的结果计算出肿瘤体积(Tumor volume ,TV),计算公式为:TV=1/2×a×b2,其中a和b分别表示长和宽;并计算出相对瘤体积(Relative tumor volume,RTV),计算公式为:RTV=Vt/V0(其中V0为分笼给药时测量所得瘤体积,Vt为每一次测量时的瘤体积)。根据计算出的相对瘤体积来计算出抗瘤活性的评价指标—相对肿瘤增殖率T/C(%),计算公式如下:
TRTV:实验组RTV ;CRTV:对照组RTV。
生理盐水、紫杉醇和重组毒素蛋白各治疗15 d后,对荷瘤鼠体重和肺癌移植瘤生长体积的影响(图6),阳性药组即紫杉醇组荷瘤鼠体积变小最明显,实验组处于阳性药组和空白组之间,说明重组毒素蛋白能抑制荷瘤鼠体内肿瘤的生长,且实验组的T/C(%)为38.2%(图6)。
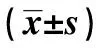
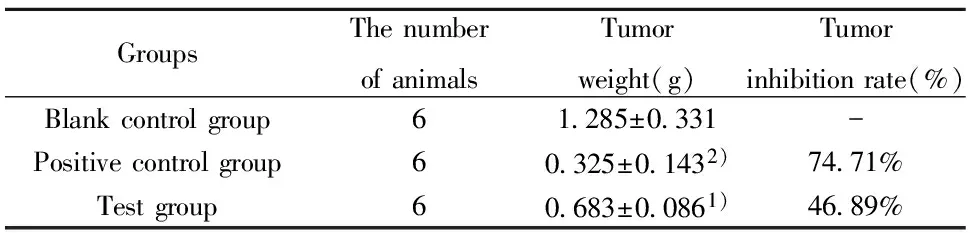
GroupsThenumberofanimalsTumorweight(g)Tumorinhibitionrate(%)Blankcontrolgroup61 285±0 331-Positivecontrolgroup60 325±0 1432)74 71%Testgroup60 683±0 0861)46 89%
Note:Compared with the control group,1)P<0.05,2)P<0.01.
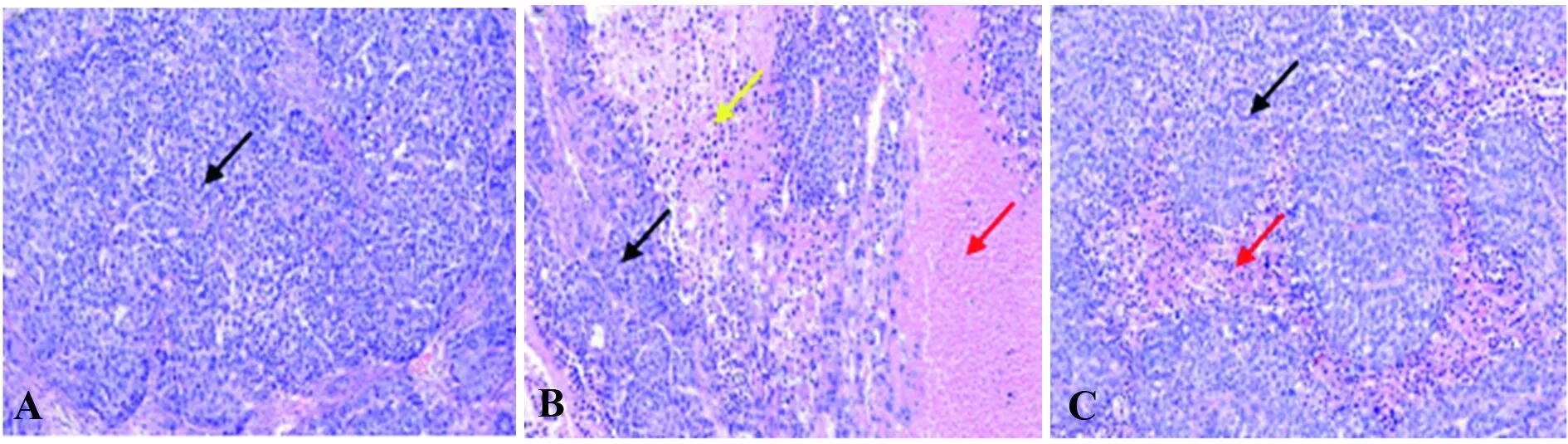
图8 瘤组织HE染色结果(×200)Fig.8 HE staining results of tumor tissue(×200)Note:A.Blank control group tumor;B.Positive drug group tumor;C.Experimental group of tumors.
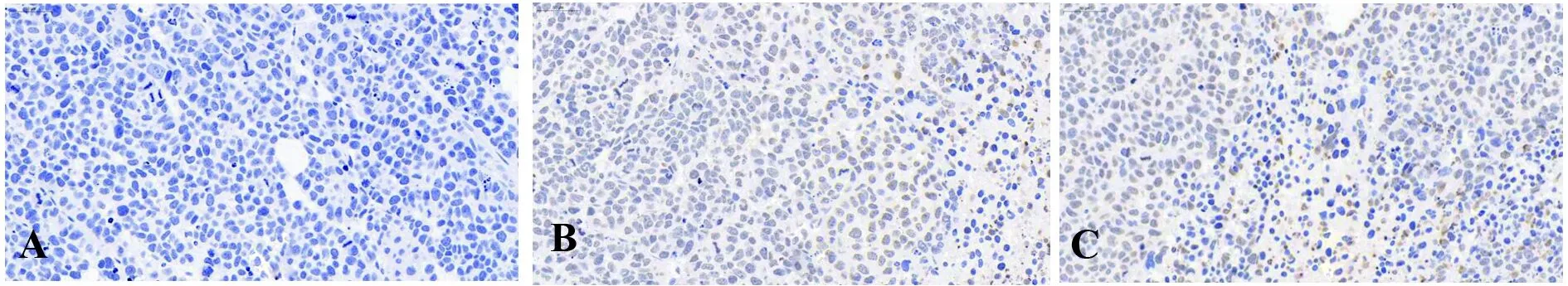
图9 免疫组化结果(×400)Fig.9 Immunohistochemical results(×400)Note:A.Blank control group tumor;B.Positive drug group tumor;C.Experimental group of tumors.
表2免疫组化结果
Tab.2Immunohistochemicalresults
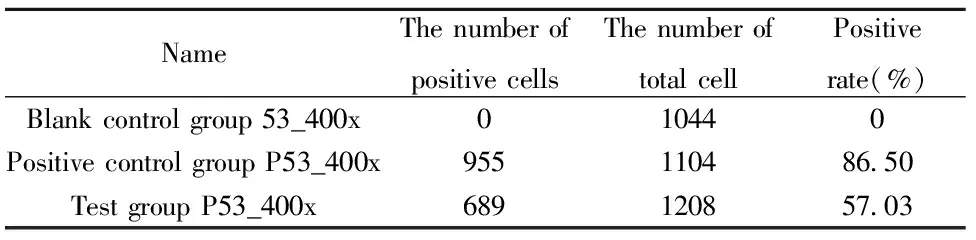
NameThenumberofpositivecellsThenumberoftotalcellPositiverate(%)Blankcontrolgroup53_400x010440PositivecontrolgroupP53_400x955110486 50TestgroupP53_400x689120857 03
2.7瘤重 实验结束时,处死荷瘤鼠,剥离出瘤组织,立即对瘤组织进行称重,并根据公式计算肿瘤抑制率,公式:肿瘤抑制率(%)=(对照组平均瘤重-治疗组平均瘤重)/对照组平均瘤重×100%(图7和表1)。
2.8瘤组织HE染色结果 瘤组织在多聚甲醇固定24 h后,进行包埋、切片和染色分析。对照组:肿瘤细胞生长活跃,间质血管丰富,瘤细胞多呈圆形或椭圆形,大小不一,可见较多病理性核分裂象,如黑色箭头所示(图8A)。阳性药组:肿瘤细胞形态结构同对照组,病理性核分裂象易见,如黑色箭头所示;肿瘤组织中可见大面积坏死,坏死的肿瘤细胞核溶解,如红色箭头所示,或固缩深染,如黄色箭头所示(图8B)。实验组:肿瘤细胞形态结构同对照组,病理性核分裂象易见,如黑色箭头所示;肿瘤组织中可见局灶性坏死,坏死的肿瘤细胞核溶解或固缩深染,如红色箭头所示(图8C)。
2.9免疫组化分析 瘤组织进行免疫组化结果分析,见图9和表2。
3 讨论
免疫毒素是将具有细胞毒性的分子和导向能力的分子偶联而成的具有特异性细胞杀伤力的杂合分子[9]。毒素之所以成为新的研究热点是因为它和传统的化疗药物的作用机制不同,肿瘤细胞对化疗试剂产生自然耐药或获得性耐药,而以毒素为基础的治疗方法却不会产生交叉耐药。因此,毒素对那些传统化疗耐受的细胞具有潜在的细胞毒性,这种特质使其在癌症治疗中具有很大的吸引力[10]。如绿脓杆菌外毒素、白喉毒素和蓖麻肽类毒素等多肽类毒素通过化学或基因工程等方法已被连接到单克隆抗体上[11,12],用以构建特异性的抗癌药物。
本研究中选择的细菌来源的绿脓杆菌外毒素是参与构建免疫毒素常用的毒素分子。PE是含613个氨基酸的单链蛋白,分子量为6.6×104,该蛋白有3个主要的结构域,即DomainⅠa(1~252 aa),是细胞结合区;Domain Ⅱ(253~364 aa),是膜转位区;DomainⅢ,ADP 核糖基化活性区,抑制蛋白质的合成。PE 的细胞毒作用机是:DomainⅠ区与细胞表面的受体结合,经胞吞作用进入细胞,然后通过高尔基体运送到内质网,再易位至胞浆。在那里,PE Domain Ⅲ能使肽链延长因子2(EF2)的ADP 核糖基化,不能与核蛋白体相互作用,肽链不能延长,从而阻碍蛋白质的合成,导致真核细胞的死亡[13]。目前用于构建重组免疫毒素的都是去除了细胞结合部位的PE 衍生物,如PE40、PE38 等。因为去除了细胞结合区,它们丧失了非特异性细胞结合能力,但保留了转位能力及细胞毒活性。另外,有研究表明,PE 羧基端的5个氨基酸残基REDLK 经缺失和突变改造成KDEL后PE的细胞毒性增强[14]。以PE类毒素为弹头的免疫毒素种类很多,当今以美国NIH肿瘤研究所构建的HA22和SS1P最为经典[15,16]。SS1P是PE毒素融合抗间皮素的抗体基因构建的免疫毒素,I期临床数据表明,SS1P已在多种间皮瘤有明显的抗肿瘤作用[16]。
选择基于单克隆抗体为载体的免疫毒素居多,但单克隆抗体分子量大,致使最终的免疫毒素的分子量很大,组织渗透性差[6],而单链抗体是利用一段柔性连接肽将抗体的重链可变区(VH)及轻链可变区(VL)连接形成的重组抗体蛋白[17]。现如今,较为常用的连接肽是一段反复出现的包含有4个甘氨酸(Gly)和1个丝氨酸(Ser),即(Gly4Ser)3形成的15肽序列[14,18]。由于单链抗体只有V区,所以其免疫原性比较低;且分子质量小,穿透力强,再连接上药物或毒素,利用抗原和抗体的特异性结合对靶细胞进行特异性杀伤[19-21]。Xin等[22]用相关W7HY 片段修饰的脂质体纳米颗粒靶向给药来治疗胃癌。Saeed等[23]将免疫脂质体与抗黑素瘤抗A1( medanoma antigen A1,MAGE A1) scFv结合在一起,靶向作用于黑素瘤细胞。陈昌友等[24]成功构建了表达抗CD80-ScFv的细胞株,其分泌的抗体具有良好的生物学活性,为CD80及相关分子的基础和临床研究中提供重要的应用价值。
本研究成功构建和表达了基于抗B7-H4的单链抗体的重组免疫毒素抗B7-H4-scFv/PE38KDEL,抗B7-H4单链抗体是从本实验室已构建好的抗B7-H4的单链抗体库中筛选出的特异性较高的单链抗体[25],在此基础上,连接上经过改造修饰后的绿脓杆菌外毒素PE38KDEL。经过表达条件优化后,蛋白主要以包涵体的形式存在,之后经过变复性纯化,以得到更多的可溶性蛋白,但是复性效率的提高还需要进一步探索和研究。经过变复性后的毒素蛋白分别对肿瘤细胞和荷瘤鼠模型进行活性验证实验。流式细胞分析技术说明毒素可以发挥其靶向性功能,与抗原高表达的癌细胞结合活性更高;MTT实验表明了毒素蛋白可以抑制癌细胞的增殖活性;而肿瘤移植模型实验与空白对照相比较而言,无论从荷瘤鼠体重变化、肿瘤体积变化和相对肿瘤增殖率,还是从肿瘤组织切片和免疫组化分析的这些指标,实验组的毒素蛋白都可以展现出一定抑制肿瘤增殖的作用。但对毒素蛋白的给药剂量上还需要继续深入实验研究,以找出最适的给药量。总的结果来看,重组免疫毒素能够一定程度抑制荷瘤鼠体内肿瘤的生长。综上所述,抗B7-H4-scFv/PE38KDEL重组免疫毒素既能很好地结合阳性肿瘤细胞,发挥单抗的靶向作用,也能抑制肿瘤细胞的增殖,起到毒素的杀伤作用,这也为以后肿瘤靶向的研究探索和治疗中提供了新的治疗策略和新的思路。
[1] Lieping C.Co-inhibitory molecules of the B7-CD28 family in the control of T-cell immunity[J].Nat Rev Immunol,2004,4(5):336-347.
[2] Zheng Y,Katsaros D,Shan SJ,etal.A multiparametric panel for ovarian cancer diagnosis,prognosis,and response to chemotherapy[J].Clin Cancer Res,2007,13(23):6984-6992.
[3] Choi IH,Zhu G,Sica GL,etal.Genomic organization and expression analysis of B7-H4,an immune inhibitory molecule of the B7 family[J].J Immunol,2003,171(9):4650-4654.
[4] Zou W,Chen L.Inhibitory B7-family molecules in the tumour micro-environment[J].Nat Rev Immunol ,2008,8(6):467-477.
[5] Flies DB,Chen L.The new B7s:playing a pivotal role in tumor immunity[J].J Immunotherapy,2007,30(3):251-260.
[6] 毛春燕,安钢力,王祥岭,等.靶向EGFR免疫毒素BI7D12-PE38KDEL的制备及其体外活性测定[J].中国免疫学杂志,2017,33(4):558-573.
Mao CY,An GL,Wang XL,etal.Preparatioon of immunotoxin BITD12-PE38KDEL directed to EGFR and determination of its activity in ritro[J].Chin J Immunol,2017,33(4):558-573.
[7] Carter PJ,Senter PD.Antibody-drug conjugates for cancer therapy[J].Cancer J,2008,14(3):154-169.
[8] Azemar M,Djahansouzi S,Jäger E,etal.Regression of cutaneous tumor lesions in patients intratumorally injected with a recombinant single-chain antibody-toxin targeted to ErbB2/HER2[J]. Breast Cancer Res Tr,2003,82(3):155-164.
[9] 祁志荣.PE类重组免疫毒素的研究进展[J].微生物学免疫学进展,2006,34(1):51-53.
QI ZR. Research progress on PE recombinant immunotoxins[J].Microbiolo Immunol,2006,34 (1): 51-53.
[10] 朱小影,陶 崑,李身锋,等.抗CML单链免疫毒素载体的构建、表达及活性鉴定[J].中国免疫学杂志,2013,29(12):1306-1311.
Zhu XY,Tao K,Li SF,etal.Construction,expression and identification of anti-CML single-chain immunotoxin vector[J].Chin J Immunol,2013,29(12):1306-1311.
[11] Luther N,Cheung NK,Souliopoulos EP,etal.Interstitial infusion of glioma-targeted recombinant immunotoxin 8H9scFv-PE38[J].Mol Cancer Ther,2010,9(4):1039-1046.
[12] Zhou XX,Ji F,Zhao JL,etal.Anti-cancer activity of anti-p185HER-2 ricin A chain immunotoxin on gastric cancer cells[J].J Gastroenterol Hepatol,2010 ,25(7):1266-1275.
[13] Pastan I,Chaudhary V,Fitzgerald DJ.Recombinant toxins as novel therapeutic agents[J]. Annu Rev Biochem,1992,61(61):331-354.
[14] Takkinen K,Laukkanen ML,Sizmann D,etal.An active single-chain antibody containing a cellulase linker domain is secreted by Escherichia coli[J].Protein Eng,1991,4(7):837-841.
[15] Wayne AS,Kreitman RJ,Findley HW,etal.Anti-CD22 immunotoxin RFB4( dsFv)-PE38 (BL22) for CD22-positive hematologic malignancies of childhood:preclinical studies and phase I clinical trial[J].Clin Cancer Res,2010,16(6):1894-1903.
[16] Kreitman RJ,Hassan R,Fitzgerald DJ,etal.Phase I trial of continuous infusion anti-mesothelin recombinant immunotoxin SS1P[J].Clin Cancer Res,2009,15(16):5274-5279.
[17] Blazek D,Celer V.The production and application of single-chain antibody fragments[J].Folia Microbiol,2003,48(5):687-698.
[18] Krebber A,Bornhauser S,Burmester J,etal.Reliable cloning of functional antibody variable domains from hybridomas and spleen cell repertoires employing a reengineered phage display system[J].J Immun Methods,1997,201(1):35-55.
[19] Kotlan B,Simsa P,Gruel N,etal.A scFv phage display mini library generated from the immunoglobulin repertoire of breast medullary carcinoma infiltrating B lymphocytes[J].Dis Markers,2000,16(1-2):25-27.
[20] 武国军,郝晓柯.单链抗体的研究进展及在肿瘤诊断、治疗中的应用[J].国外医学·临床生物化学与检验学分册,1999,20(1):33-34.
Wu GJ,Xiao KH. Research progress of single chain antibodies and its application in the diagnosis and treatment of cancer[J].Foreign Medical Clin Lab Biochem Testing,1999,20 (1): 33-34.
[21] Marty C,Langer Z.Isolation and characterization of a scFv antibody specific for tumor endothelial marker1 (TEM1),a new reagent for targeted tumor therapy[J].Cancer Lett,2006,235(2):298-308.
[22] Xin L,Cao JQ ,Liu C,etal.Evaluation of rMETase-loaded stealth PLGA/liposo-mes modified with anti-CAGE scFv for treatment of gastric carcinoma[J].J Biomed Nanotechol,2015,11(7):1153-1161.
[23] Saeed M,van Brakel M,Zalba S,etal.Targeting melanoma with immunolipos-omes coupled to anti-MAGE A1 TCR-like single-chain antibody[J].Int J Nanomed,2016,11:955-975.
[24] 陈昌友,郭静雅,陈永井,等.抗人CD80单链抗体的构建、表达及与抗原结合的特性分析[J].中国免疫学杂志,2011,27(2):153-157.
Chen CY,Guo JY,Chen YJ,etal.Construction and expression of anti-human CD80 single-chain antibody and analysis of their binding characteristics with antigen[J].Chin J Immunol,2011,27(2):153-157.
[25] 邵峦峦,徐超超,纪洪帅,等.抗B7-H4单链抗体库的构建和筛选及抗体特异性鉴定[J].细胞与分子免疫学杂志,2016,32(9):1260-1266.
Shao LL,Xu CC,Ji HS,etal.Construction and screening of anti-B7-H4 single chain antibody library and antibody specificity identification[J].J Cell Mol Immunol,2016,32(9):1260-1266.
