沙眼衣原体pORF5蛋白通过激活PI3K/Akt信号通路抑制细胞凋亡①
2018-03-23卜继常雷文波陆春雪陈超群李忠玉
卜继常 邹 燕 聂 倩 雷文波 周 洲 陆春雪 陈超群 李忠玉
(南华大学医学院病原生物学研究所/特殊病原体防控湖南省重点实验室,衡阳 421001)
沙眼衣原体(Chlamydia trachomatis,Ct)感染具有较广泛的致病谱,能引起沙眼,泌尿生殖道感染和性病淋巴肉芽肿等疾病,是导致失明及性传播疾病的最常见病因[1]。由于Ct感染病程隐匿,常不易被发现而延缓治疗转变为慢性感染而诱发一系列严重并发症,因此阐明Ct致病机制以寻找合适的诊断和治疗方法成为迫在眉睫的任务。
衣原体严格细胞内寄生,抑制细胞凋亡、逃避宿主细胞免疫清除以维持自身的细胞内生长发育是衣原体重要的致病机制之一[2,3]。细胞凋亡机制主要有线粒体介导的内部途径及死亡受体介导的外部途径。Bcl-2家族在调控线粒体途径中发挥重要作用,该家族成员包括了抗凋亡蛋白Bcl-2、Mcl-1和Bcl-xL和促凋亡蛋白Bad、Bax和Bak等[4]。Bax和Bak等蛋白能增加线粒体膜通透性释放细胞色素c,激活下游一系列激酶,最终活化关键效应激酶Caspase 3诱导细胞凋亡,而Bcl-2蛋白能拮抗Bax/Bak的激活抑制宿主细胞凋亡[5]。有研究表明衣原体可通过多种分子机制抑制Bax的表达、增加Bcl-2的表达来抑制宿主细胞凋亡[2]。但其具体机制还需要进一步研究。
除了含有高度保守的基因组外,Ct还含有一个大小为7.5 kb的隐蔽性质粒,质粒基因编码8个质粒蛋白,其中pORF5是唯一一种表达之后分布于宿主细胞胞浆的分泌性蛋白[6]。前期研究已经证实,pORF5蛋白能介导Ct炎症反应,并参与Ct免疫病理过程[7-10],提示pORF5蛋白在Ct致病过程中发挥重要作用。为进一步探讨pORF5质粒蛋白对细胞凋亡的影响及其分子机制,本研究用不同浓度的pORF5质粒蛋白以不同时间刺激HeLa细胞,并应用信号通路抑制剂特异性阻断PI3K/Akt通路,通过对细胞凋亡率以及凋亡相关蛋白Bax及Bcl-2的表达水平的检测,综合分析pORF5质粒蛋白抗细胞凋亡效应及机制。本研究为深入探讨pORF5质粒蛋白在Ct的致病机制中的作用提供重要依据。
1 材料与方法
1.1主要材料 DMEM培养基、胎牛血清为Gibco公司产品;兔抗Bax、Bcl-2、p-Akt、t-Akt抗体等为CST公司产品;鼠GAPDH抗体为Proteintech公司产品;HRP标记的羊抗兔、羊抗鼠抗体为SantaCruz公司产品;蛋白分子量标准为Invitrogen公司产品;谷胱甘肽琼脂糖凝胶4B、PreScission蛋白酶为Pharmacia 公司产品;HeLa细胞、XL1-Blue大肠杆菌、pGEX-6p和pGEX-6p/pORF5原核表达载体为本研究所保存。
1.2方法
1.2.1pORF5融合蛋白的表达与纯化 将已构建好的pGEX-6p/pORF5重组质粒转化XL1-Blue大肠杆菌,IPTG 37℃诱导4 h后,低速离心收菌,加入细菌裂解液并超声破菌,高速离心收集上清并加入谷胱甘肽琼脂糖凝胶4B纯化GST-pORF5融合蛋白,融合蛋白经Prescission 蛋白酶切除GST标签得到pORF5蛋白。pORF5蛋白经多粘菌素B去内毒素处理后,-80℃保存备用。
1.2.2细胞培养和蛋白刺激 将HeLa细胞接种于含10%胎牛血清的DMEM培养基中,置于37℃,5%CO2培养箱中培养24 h,用不同浓度(0、5、10、15、25 μg/ml)的pORF5蛋白与20 ng/ml的TNF-α共刺激HeLa细胞0、8、12、24 h,部分实验根据需要用PI3K/Akt抑制剂LY294002预处理HeLa细胞30 min,再用15 μg/ml的pORF5质粒蛋白以不同的时间刺激HeLa细胞。
1.2.3细胞凋亡率的检测 HeLa细胞经上述方法处理后,分成2组,第一组分别用4%的多聚甲醛固定10 min、0.1%TritonX-100处理5 min后,PBS洗涤后再加入Hoechst 33258染色30 min,最后用PBS洗涤、封片,干燥,荧光显微镜下观察。第二组用预冷的PBS缓冲液洗涤后,1× Binding Buffer缓冲液调整细胞数为1×106个/ml,加入AnnexinV/PE和7-AAD,单染细胞组分别加入AnnexinV/PE或7-AAD,空白对照组不加入任何染料,轻轻混匀并避光孵育15 min。2 h内流式细胞仪分析细胞凋亡率。
1.2.4Western blot分析凋亡相关蛋白和PI3K/Akt磷酸化水平 收集处理后的细胞标本,PBS洗涤后加入含蛋白酶抑制剂的细胞裂解液充分裂解细胞,离心后去上清并加入2×SDS上样缓冲液,加热煮沸10 min后,取适量进行12%SDS-PAGE凝胶电泳,然后转移至PVDF膜上,5%脱脂牛奶封闭2 h后,分别加入兔抗Bax、Bcl-2、磷酸化的Akt、总Akt和鼠抗GAPDH抗体,4℃孵育过夜后,0.05%的TBST洗3次,加入HRP标记的羊抗兔或抗鼠抗体,最后加ECL底物显色,曝光显影观察结果。
1.3统计学分析 采用SPSS13.0统计分析软件分析各组实验数据,两组间均数比较采用独立样本t检验,多组间均数比较采用单因素方差分析,当P<0.05认为差异有统计学意义。
2 结果
2.1GST-pORF5融合蛋白的酶切与鉴定 pGEX-6p-1/pORF5重组质粒转化菌经IPTG诱导表达GST-pORF5融合蛋白,融合蛋白经谷胱甘肽琼脂糖凝胶4B纯化后,再用PreScission蛋白酶切割GST标签后可见约28 kD的pORF5蛋白(图1A)。进一步用Western blot鉴定切割GST标签后的pORF5质粒蛋白,结果可见分别在54和28 kD处有清晰的条带,与预期分子相符(图1B)。
2.2pORF5蛋白对HeLa细胞凋亡的抑制作用 HeLa细胞血清饥饿24 h后,再分别用pORF5蛋白、TNF-α处理24 h,Hoechst 33342染色结果发现,TNF-α处理组和空白对照组中HeLa细胞核出现核固缩、核碎裂,高亮蓝色凋亡小体;pORF5处理组大部分HeLa细胞核呈现均匀淡蓝色,核固缩现象明显减少(图2A)。AnnexinV/PE和7-AAD染色后,流式细胞技术检测HeLa细胞的凋亡情况,图2B中Q2区表示晚期凋亡的细胞;Q3区表示早期凋亡的细胞;Q1区表示坏死的细胞,故取Q2+Q3计算凋亡率。结果显示三组细胞的凋亡率分别是(31.2±4.2)%、 (12.3±1.8)%和(3.9±1.1)%, pORF5处理组细胞凋亡率较TNF-α处理组约降低27.3%(P<0.01),相比于空白对照组约降低8.4%(图2C,P<0.05)。
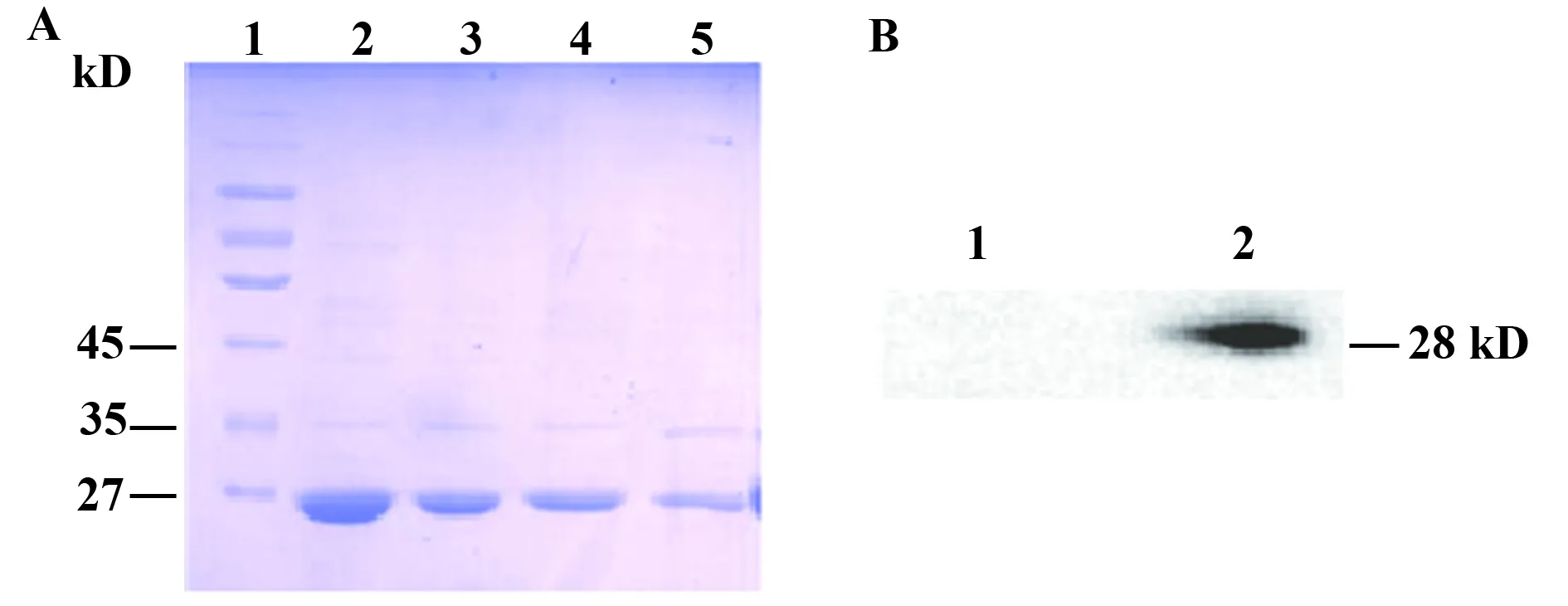
图1 GST-pORF5融合蛋白酶切后产物SDS-PAGE分析及Western blot鉴定Fig.1 Analysis of digested products of GST-pORF5 fusion protein by SDS-PAGE and Western blotNote:A.SDS-PAGE analysis of digested products of GST-pORF5 fusion protein;1.Protein marker;2.Supernatant after the first wash from beads;3.Supernatant after the second wash from beads;4.Supernatant after the third wash from beads;5.Supernatant after the fourth wash from beads.B.Western blot analysis of digested products of GST-pORF5 fusion protein;1.E.coli;2.Supernatant after digestion of GST-pORF5 fusion protein.
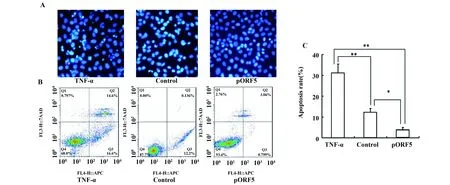
图2 pORF5蛋白对HeLa细胞凋亡的影响Fig.2 Effect of pORF5 protein on apoptosis of HeLa cellsNote:A.Morphological observation of apoptotic cells by Hoechst staining;B.Effect of pORF5 protein on apoptosis of HeLa cells by flow cytometry.
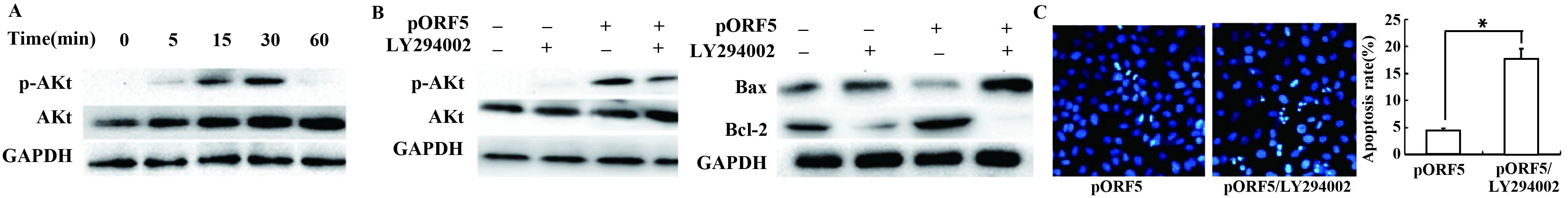
图4 PI3K/AKT信号通路对pORF5介导细胞抗凋亡的影响Fig.4 Effects of PI3K/AKT signal pathway on anti-apoptosis mediated by pORF5 proteinNote:A.Effect of pORF5 protein on PI3K/Akt signal pathway;B.Effects of PI3K/Akt signal pathway on the expression of Bax and Bcl-2 mediated by pORF5 protein;C.Effects of PI3K/Akt signal pathway on apoptosis mediated by pORF5 protein.*.P<0.01.
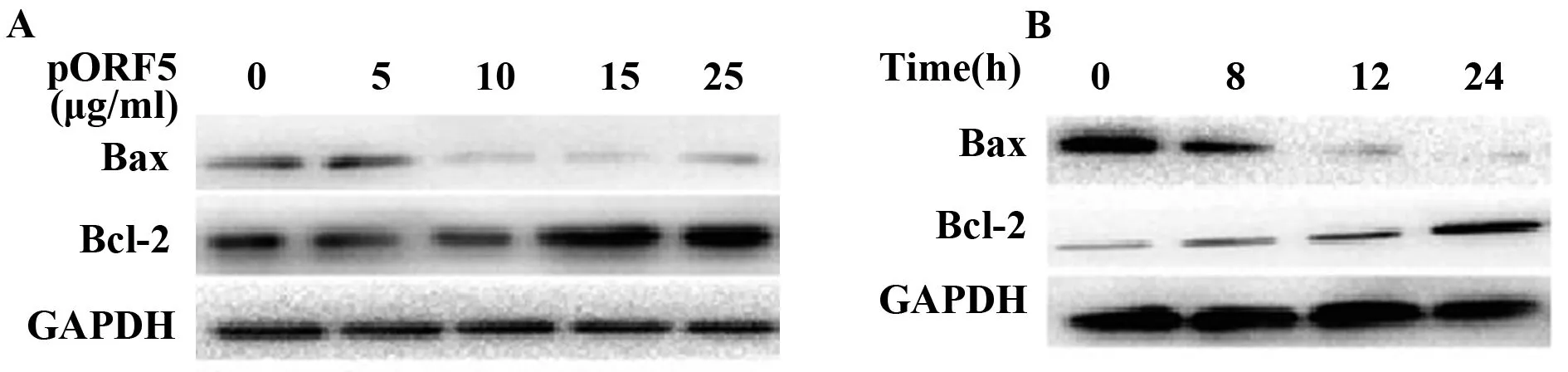
图3 pORF5蛋白对Bcl-2和Bax表达水平的影响Fig.3 Effect of pORF5 protein on expression of Bcl-2 and BaxNote:A.Effect on expression of Bcl-2 and Bax at different concentration of pORF5 protein;B.Effect of pORF5 protein on expression of Bcl-2 and Bax at different time.
2.3pORF5蛋白对Bcl-2和Bax表达水平的影响 用不同浓度的pORF5蛋白刺激HeLa细胞24 h,Western blot分析Bax和Bcl-2的表达水平,结果发现pORF5蛋白刺激浓度为5~15 μg/ml时,Bax的表达随pORF5蛋白浓度的升高而逐渐减少,而Bcl-2蛋白的表达水平随pORF5蛋白浓度的升高而逐渐增加,当pORF5浓度达15 μg/ml时,Bax和Bcl-2蛋白表达变化最明显(图3A)。用最佳pORF5蛋白刺激浓度(15 μg/ml)以不同时间处理Hela细胞,发现Hela细胞在刺激8 h后Bax和Bcl-2蛋白的表达水平发生变化;当刺激时间达24 h时,Bax和Bcl-2的蛋白表达变化最明显(图3B)。
2.4PI3K/Akt信号通路参与pORF5介导的抗细胞凋亡作用 pORF5蛋白以不同时间(0、5、15、30、60 min)刺激HeLa细胞后,Western blot分析Akt的磷酸化水平。结果由图4A可见,Akt在15 min发生磷酸化,30 min磷酸化水平最高。当HeLa细胞用20 μmol/L的PI3K/Akt通路特异性抑制剂LY294002预处理1 h后,再以pORF5蛋白刺激,结果发现LY294002能明显抑制Akt磷酸化水平,并显著提高Bax的表达水平,降低Bcl-2的表达水平(图4B);LY294002预处理组凋亡细胞数明显增加,细胞凋亡率较对照组增加了13.0%(P<0.01)。
3 讨论
抑制宿主细胞凋亡从而完成自身的生长发育是Ct重要的免疫逃逸机制之一[2,3]。Ct抗凋亡机制与抑制凋亡前体蛋白Bax表达,降解促凋亡BH3-only蛋白,上调凋亡抑制因子,阻止细胞色素c从线粒体释放等机制有关[11]。在凋亡信号分子刺激下,Bax/Bak与线粒体上的电压依赖性离子通道发生相互作用促进线粒体细胞色素c的释放,最终导致细胞凋亡,而Bcl-2蛋白能拮抗Bax/Bak的激活从而抑制宿主细胞凋亡[5]。为研究Ct质粒蛋白pORF5与细胞凋亡的关系,本研究用pORF5蛋白刺激HeLa细胞后发现,pORF5蛋白刺激组多数细胞的细胞核正常,呈现均匀的蓝色荧光,而凋亡诱导剂TNF-α处理组和空白对照组较多细胞出现核固缩、核碎裂,致密的亮蓝色凋亡小体;pORF5刺激组凋亡率相比于TNF-α阳性对照组降低27.3%,相比于未刺激组降低8.5%。进一步分析pORF5蛋白对凋亡相关蛋白Bax及Bcl-2的表达水平影响,结果发现当pORF5浓度达10 μg/ml时,Bax表达下调,Bcl-2表达上调,并在浓度达到15 μg/ml时变化最明显,15 μg/ml的pORF5蛋白刺激HeLa细胞24 h,Bax和Bcl-2的表达变化最明显,说明pORF5通过降低Bax,增加Bcl-2的表达水平抑制宿主细胞凋亡。
PI3K(磷脂酰肌醇3-激酶)是一种具有丝氨酸/苏氨酸激酶活性的胞内磷脂酰肌醇激酶,可催化膜表面的二磷酸磷脂肌醇(PIP2)磷酸化形成三磷酸磷脂肌醇(PIP3),后者与磷酸肌醇依赖性激酶(PDK1)结合,使Akt磷酸化后激活。Akt激活后能调节下游多种信号途径,是参与细胞增殖、分化、凋亡调节的重要转导途径,并与癌细胞的迁移、黏附、肿瘤血管生成相关[12-14]。有研究表明,在Ct可通过PI3K/Akt信号通路稳定抗凋亡蛋白Mcl-1,使Bad磷酸化并与14-3-3β 和IncG结合,阻止细胞色素c的释放抑制宿主细胞凋亡[15]。为分析PI3K/Akt信号通路是否介导了pORF5质粒蛋白的抗凋亡过程,并进一步研究其效应机制,本实验测定了pORF5刺激HeLa细胞后Akt的磷酸化水平,结果发现Akt在pORF5刺激HeLa细胞30 min后发生明显的磷酸化;使用PI3K特异性抑制剂阻断PI3K/Akt信号通路后,发现Akt磷酸化水平降低,Bax表达水平上调,而Bcl-2的表达水平下调;Hoechst 及流式细胞仪检测结果均发现PI3K抑制剂处理后细胞凋亡率增加,证实了PI3K/Akt信号通路介导pORF5蛋白的抗凋亡活性。
综上,本研究应用原核表达系统表达并纯化pORF5质粒蛋白,pORF5质粒蛋白体外刺激HeLa
细胞,发现pORF5能通过上调抗凋亡蛋白Bcl-2,下调促凋亡蛋白Bax抑制细胞凋亡;进一步应用特异性抑制剂抑制PI3K/Akt信号通路,发现抑制PI3K/Akt信号通路后,细胞凋亡率较对照组显著增加,并可增加Bax蛋白的表达、降低Bcl-2的表达,初步证实了pORF5蛋白通过激活PI3K/Akt信号通路抑制细胞凋亡。本研究为阐明pORF5在Ct致病机制中的作用提供了实验依据。
[1] Mackern-Oberti JP,Motrich RD,Breser ML,etal.Chlamydia trachomatis infection of the male genital tract:an update[J].J Reprod Immunol,2013,100(1):37-53.
[2] Al-Zeer MA,Xavier A,Abu Lubad M,etal.Chlamydia trachomatis prevents apoptosis via activation of PDPK1-MYC and enhanced mitochondrial binding of hexokinase II[J].Ebio Med,2017,23:100-110.
[3] Messinger JE,Nelton E,Feeney C,etal.Chlamydia infection across host species boundaries promotes distinct sets of transcribed anti-apoptotic factors[J].Front Cell Infect Microbiol,2015,5:96.
[4] Hardwick JM,Soane L.Multiple functions of BCL-2 family proteins[J].Cold Spring Harb Perspect Biol,2013,5(2):1-22.
[5] Ruiz-Vela A,Opferman JT,Cheng EH,etal.Proapoptotic BAX and BAK control multiple initiator caspases[J].EMBO Rep,2005,6(4):379-385.
[6] Li Z,Chen D,Zhong Y,etal.The chlamydial plasmid-encoded protein pgp3 is secreted into the cytosol of Chlamydia-infected cells[J].Infect Immun,2008,76(8):3415-3428.
[7] Cao W,Zou Y,Su S,etal.Chlamydial plasmid-encoded protein pORF5 induces production of IL-1beta and IL-18 via NALP3 inflammasome activation and p38 MAPK pathway[J].Int J Clin Exp Med,2015,8(11):20368-20379.
[8] Zhou H,Huang Q,Li Z,etal.pORF5 plasmid protein of Chlamydia trachomatis induces MAPK-mediated pro-inflammatory cytokines via TLR2 activation in THP-1 cells[J].Sci China Life Sci,2013,56(5):460-466.
[9] Liu Y,Huang Y,Yang Z,etal.Plasmid-encoded Pgp3 is a major virulence factor for Chlamydia muridarum to induce hydrosalpinx in mice[J].Infect Immun,2014,82(12):5327-5335.
[10] 邓红玉,李忠玉,吴移谋,等.沙眼衣原体pORF5质粒蛋白诱发小鼠生殖道免疫损伤初步研究[J].中华微生物学和免疫学杂志,2013,33(2):107-111.
Deng HY,Li ZY,Wu YM,etal.Preliminary study on genital tract immune injury in mice induced by pORF5 plasmid protein of chalmydia trachomatis[J].Chin J Microbiol Immunol,2013,33(2):107-111.
[11] Dong F,Pirbhai M,Xiao Y,etal.Degradation of the proapoptotic proteins Bik,Puma,and Bim with Bcl-2 domain 3 homology in Chlamydia trachomatis-infected cells[J].Infect Immun,2005,73(3):1861-1864.
[12] Yang SX,Polley E,Lipkowitz S.New insights on PI3K/AKT pathway alterations and clinical outcomes in breast cancer[J].Cancer Treat Rev,2016,45:87-96.
[13] Osaki M,Oshimura M,Ito H.PI3K-Akt pathway:its functions and alterations in human cancer[J].Apoptosis,2004,9(6):667-676.
[14] Qu Y,Hao C,Xu J,etal.ILK promotes cell proliferation in breast cancer cells by activating the PI3K/Akt pathway[J].Mol Med Rep,2017,16(4):5036-5042.
[15] Rajalingam K,Sharma M,Lohmann C,etal.Mcl-1 is a key regulator of apoptosis resistance in Chlamydia trachomatis-infected cells[J].PLoS One,2008,3(9):e3102.
