马蹄肾合并微小病变和急性肾小管坏死1例
2018-03-22,2,2
,2 ,2
(1复旦大学附属中山医院肾内科 上海 200032; 2上海市肾病与透析研究所 上海 200032)
马蹄肾是一种双侧肾脏上极或下极融合的先天性解剖异常的疾病,以下极融合更为常见,发病率约1/600~1/400,男女比例约2∶1[1],通过B超、CT等影像学即可确诊,常合并尿路感染、肾盂积水、尿路结石、肿瘤等多种并发症[2]。由于马蹄肾肾脏结构、血供的异常及其与周围大血管关系复杂,使肾穿刺难度及术后并发症明显增加,故较少对马蹄肾患者进行肾穿刺,导致不能通过明确病理进而指导马蹄肾患者的诊断和治疗[3]。本例是首次报道经肾穿刺确诊为马蹄肾合并微小病变(minimal change diease,MCD)和急性肾小管坏死的病例。
病例资料患者女性,64岁,农民,因“颜面及双下肢水肿1月余,血肌酐升高1月”于2016年8月收治于复旦大学附属中山医院肾内科。患者2016年7月无明显诱因下出现双眼发红,就诊于当地医院,予左氧氟沙星滴眼液、鱼腥草滴眼液治疗,症状无明显好转,后出现颜面部及双下肢水肿,再次至该院就诊,血压:150/88 mmHg (1 mmHg=0.133 kPa,下同);查肾功能:血肌酐(serum creatinine,Scr) 73 μmol/L,尿素氮(urea nitrogen,BUN) 9.4 mmol/L,尿酸(uric acid,UA) 549 μmol/L;尿常规:蛋白质(3+),红细胞3~4/HP,白细胞2~3/HP,予苯溴马隆片、托拉塞米片、黄芪颗粒口服,水肿无好转,并出现腹痛、腹泻,每天解5~6次黄色糊状便,伴尿量减少,水肿加重。2016年8月8日至本市某二甲医院就诊,尿常规:蛋白质(3+),红细胞3~4/HP;24 h尿蛋白定量1.09 g;肝肾功能:白蛋白(albumin,Alb)14.9 g/L;BUN 20.8 mmol/L,Scr 235 μmol/L,UA 601 μmol/L;血常规、电解质、出凝血功能、心脏标志物、肿瘤标志物、甲状腺功能等均未见明显异常。腹部B超示:脂肪肝,马蹄肾(双肾形态狭长,左肾上下径123 mm,横径53 mm;右肾上下径102 mm,横径45 mm;肾内结构清晰,集合系统未见扩张,双肾下极于腹主动脉前方相连,呈马蹄形);胸部CT平扫示:右肺上叶、中叶及左肺下叶小结节样影,少量腹水;心电图、心超无殊。予抗氧化(还原型谷胱甘肽)、护肾(肾康注射液)、利尿(托拉塞米、速尿、螺内酯)、碱化尿液(碳酸氢钠)、改善微循环(前列地尔)、降蛋白尿(百令胶囊)、抗感染(头孢呋辛)、抗凝(低分子肝素)、护胃(奥美拉唑)、降压(苯磺酸氨氯地平片)等治疗。3天后复查肾功能:BUN 22.4 mmol/L,Scr 230 μmol/L,UA 605 μmol/L,即予甲泼尼龙(甲强龙) 40 mg 每日1次静滴治疗,尿量仍少,水肿加重。2016年8月16日复查肾功能BUN 37.3 mmol/L,Scr 478 μmol/L,UA 632 μmol/L,症状无明显好转,尿量约500 mL/d,遂转我院进一步诊治。否认高血压、糖尿病史,特殊药物应用史见上。入院查体:血压160/98 mmHg,颜面水肿明显,双肺呼吸音清,未及干、湿啰音,心律齐,各瓣膜区未及病理性杂音,腹平软,无明显压痛、反跳痛,移动性浊音(-),双下肢重度凹陷性水肿。实验室检查:血常规无殊,生化指标:总蛋白41 g/L,Alb 19 g/L;空腹血糖6.2 mmol/L,糖化血红蛋白6.7%;BUN 36.4 mmol/L,Scr 211 μmol/L,UA 575 μmol/L;24 h尿蛋白定量16.4 g;自身抗体、肝炎标志物、HIV、RPR及肿瘤标志物均阴性;辅助检查:肾脏B超:双肾形态狭长,左肾上下径144 mm,横径58 mm;右肾上下径126 mm,横径45 mm;肾内结构欠清晰,集合系统未见扩张,双肾下极于脐水平腹主动脉前相连。肾脏CT平扫(图1A):两肾下极融合,肾轴向外侧旋转,肾周包膜增厚;腹腔积液。胸片、心电图无异常。
综合评估病情,临床诊断为“肾病综合征、急性肾损伤、马蹄肾”。排除绝对禁忌后,于入院后3天行肾穿刺活检,取右肾下极为活检部位。病理结果:光镜(图1B):2条皮质组织,全片可见13个肾小球,其中1个球性硬化,部分球袢皱缩,包曼氏囊腔显著扩大,余肾小球毛细血管袢开放尚可;肾固有细胞70±个/球,系膜基质增多不明显,系膜细胞增生不明显,脏层上皮肿胀,部分袢与球囊壁有粘连。毛细血管袢走形略僵硬。肾小管间质病变重度,少量小管萎缩,较多小管扩张,可见蛋白管型,大量肾小管上皮刷状缘脱落,上皮细胞扁平,部分小管上皮细胞脱落,基底膜裸露,部分小管上皮细胞浊肿空泡变。间质纤维化(-),灶性炎细胞浸润,间质水肿。血管病变(-)。免疫荧光(图1C):IgM呈颗粒状、团块状在血管袢局灶节段分布。电镜(图1D):镜下可见1个肾小球,系膜区基质增多不明显,可见系膜细胞增生不明显,系膜区未见电子致密物沉积;毛细血管袢管壁未见增厚,未见电子致密物沉积;上皮足突弥漫融合伴大量微绒毛形成;小管萎缩不明显,炎细胞浸润不明显。病理诊断:(1)微小病变;(2)急性肾小管坏死。根据肾穿刺病理诊断结果,予甲强龙120 mg每日1次静滴,共3天,复查肾功能:BUN 17.5 mmol/L,Scr 124 μmol/L,UA 411 μmol/L。后改为足量醋酸泼尼松口服治疗,并根据随访相关指标逐步调整醋酸泼尼松的剂量,同时辅以降压、利尿、护胃、补钙、控制血糖等支持治疗。随访5个月,患者血清Alb 39 g/L,BUN 6.0 mmol/L,Scr 52 μmol/L,UA311 μmol/L,24 h尿蛋白定量0.68 g。
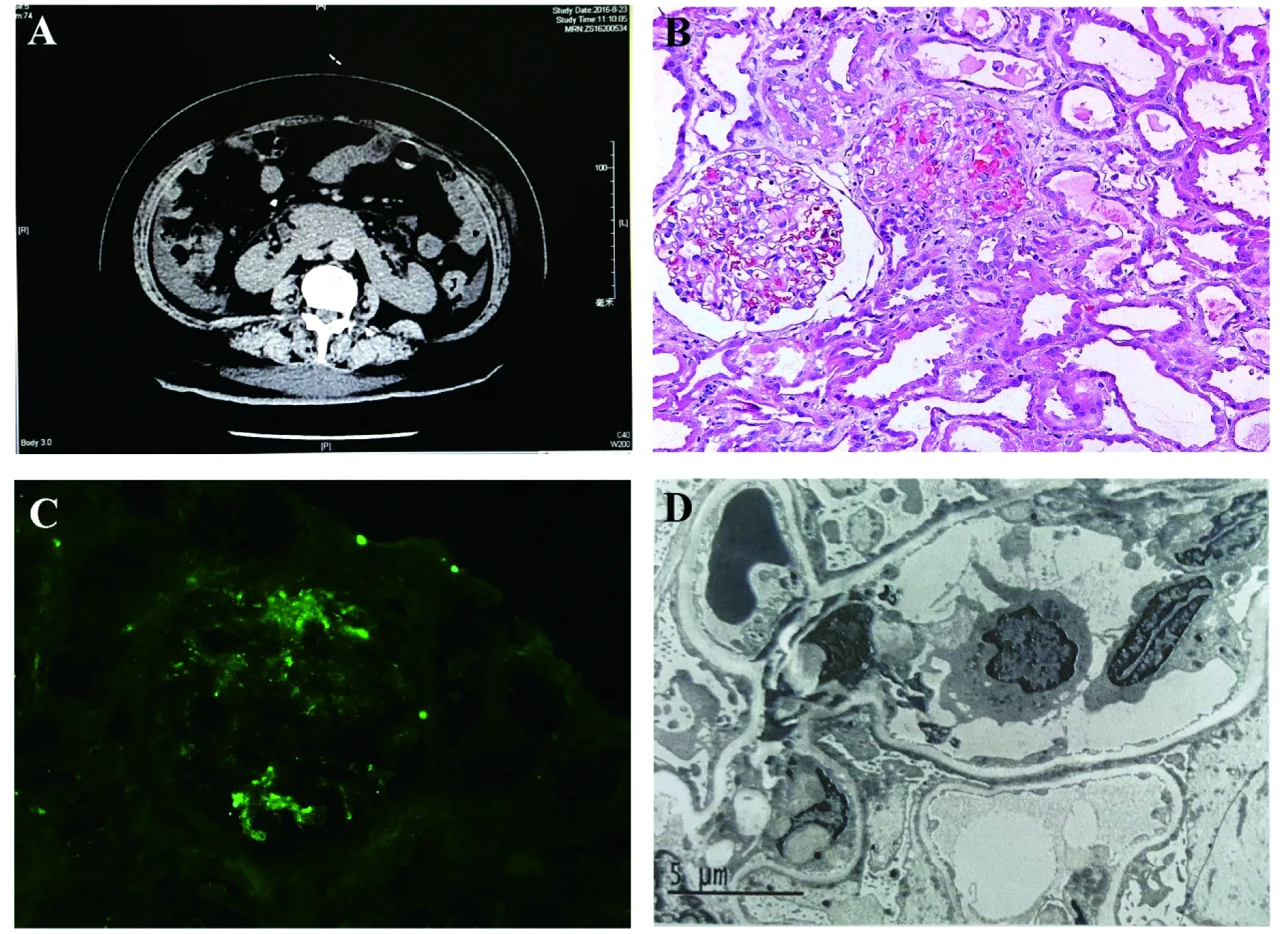
A:CT scan of the kidneys shows the fusion of the bilateral renal lower poles in front of abdominal aorta.B:HE staining of the renal biopsy specimen (×200).C:IgM immunofluorescence of the renal biopsy specimen (×200).D:Electron microscopy of the renal biopsy specimen (×4 000).
图1患者肾脏影像学及病理学表现
Fig1Kidneyimagingandpathologicalfeaturesofthepatient
讨论马蹄肾是肾脏最常见的先天性、融合性畸形,最早是1521年由Decarpi在尸检中发现,主要包括了解剖位置、旋转不良及血供多变3方面异常,90%以上的融合发生在肾脏下极,且肾脏的血供变异较大,峡部与血管的位置关系复杂多变[2,4]。马蹄肾的这些解剖、血管异常都使肾穿刺活检难度及术后并发症风险增高,故而较少对马蹄肾行肾穿刺活检。有学者提出马蹄肾更容易出现免疫复合物沉积,使马蹄肾合并肾小球疾病易感性增加[5-6]。已报道的马蹄肾合并肾小球疾病的病理类型有:膜性肾病、局灶节段性肾小球硬化、膜增生性肾小球肾炎、系膜增生性肾小球肾炎、IgA肾病以及肾淀粉样变性等[5-8]。本例是首次报道经肾穿刺确诊为马蹄肾合并微小病变、急性肾小管坏死的病例,根据穿刺结果制定治疗方案,获得显著疗效,目前患者各项相关临床指标已基本恢复至正常水平。
本例患者急性起病,病情发展较快,根据其大量蛋白尿(>3.5 g/24 h)、低蛋白血症(<30 g/L)和双下肢明显水肿,肾病综合征诊断明确。患者起病前血肌酐水平基本正常,病程中迅速上升至478 μmol/L,经有效治疗目前恢复至52 μmol/L,根据改善全球肾脏病预后组织(KDIGO)指南[9],急性肾损伤(acute kiolney injury,AKI)诊断明确;依据外院腹部B超及我院肾脏CT平扫,马蹄肾诊断明确。术前完善相关检查,权衡利弊,排除绝对禁忌并联合多种影像学资料寻找最佳穿刺点,行肾穿刺活检,根据光镜、电镜及免疫荧光表现,病理诊断为:微小病变,急性肾小管坏死。结合患者病史,考虑肾小管坏死系严重肾病综合征有效循环血容量不足,导致肾脏灌注不足,同时合并腹泻等容量不足的因素,进一步恶化了肾脏的灌注,此外又合并使用头孢呋辛、奥美拉唑等可疑肾毒性药物,最终导致明显的肾小管坏死。考虑到患者肾病综合征的病因为微小病变,故予甲强龙120 mg每日1次静滴3天后,改为规律口服糖皮质激素治疗,同时停用可疑肾毒性药物,并适当扩容改善肾脏微循环增加肾脏血供,定期随访相关指标提示血肌酐、血清Alb恢复至正常水平,24 h尿蛋白定量降至0.68 g (基础值16.4 g),评估治疗有效[10]。
文献报道MCD患者更易伴发AKI (34%~37.3%),年龄越大、低蛋白血症越重、系膜区IgM的沉积等更易发生AKI,且AKI的发生是延长MCD诱导缓解时间的独立危险因子[11-12]。本病例中患者年龄较大,起病时伴严重低蛋白血症、不合理利尿、腹泻、可疑肾毒性药物使用和病理荧光改变等均与文献报道类似。经过及时的肾穿刺明确诊断,并予以针对性治疗,预后良好。
我们认为,虽然相比正常肾脏,马蹄肾具有异常的解剖结构,多变的血液供应,使肾穿刺活检术难度及术后并发症风险均较高,但有学者指出马蹄肾可能更易合并肾小球疾病[4-5],故对于病程较短、无明显肾穿刺禁忌的患者,术前充分评估患者肾脏情况、合并症、肾周血管情况,有效控制血压<140/90 mmHg,由经验丰富的医师在超声引导下进行肾活检明确病理类型,对指导治疗具有非常重要的意义,尤其对于本例报道中该人群的少见病理类型,明确病理显得尤为重要。同时也要重视对合并症的预防与处理,以期更好地改善患者的预后。
马蹄肾; 肾穿刺活检术; 微小病变; 急性肾小管坏死
*ThisworkwassupportedbyShanghaiYoungPhysicianTrainingProgram(20141089)andOutstandingYouthFundofZhongshanHospital,FudanUniversity(2015ZSYXQN23).
[1] WEIZER AZ,SILVERSTEIN AD,AUGE BK,etal.Determining the incidence of horseshoe kidney from radiographic data at a single institution[J].JUrol,2003,170(5):1722-1726.
[2] NATSIS K,PIAGKOU M,SKOTSIMAMA A,etal.Horseshoe kidney:a review of anatomy and pathology[J].SurgRadiolAnat,2014,36(6):517-526.
[3] GLODNY B,PETERSEN J,HOFMANN KJ,etal.Kidney fusion anomalies revisited:clinical and radiological analysis of 209 cases of crossed fused ectopia and horseshoe kidney[J].BJUInt,2009,103(2):224-235.
[4] TAGHAVI K,KIRKPATRICK J,MIRJALILI SA.The horseshoe kidney:Surgical anatomy and embryology[J].JPediatrUrol,2016,12(5):275-280.
[5] ALAGOZLU H,CANDAN F,GULTEKIN F,etal. Horseshoe kidney and nephrotic syndrome due to idiopathic membranous nephropathy[J].InternMed,2001,40(12):1259-1260.
[6] KAYATAS M,URUN Y.Two cases with horseshoe kidney in association with nephrotic syndrome:is there a causal relationship between two conditions[J].RenFail,2007,29(4):517-518.
[7] HU PP,JIN ML,XIE YS,etal.Immunoglobulin A nephropathy in horseshoe kidney:Case reports and literature review[J].Nephrology,2014,19(10):605-609.
[8] 胡盼盼,谢院生,金美玲,等.马蹄肾合并肾小球病的临床病理分析[J].中国中西医结合肾病杂志,2014,5(15):401-403.
[9] THOMAS ME,BLAINE C,DAWNAY A,etal.The definition of acute kidney injury and its use in practice[J].KidneyInt,2015,87(1):62-73.
[10] 中国成人肾病综合症免疫抑制治疗专家组.2014年中国成人肾病综合征免疫抑制治疗专家共识[J].中华肾脏病杂志,2014,6(30):467-474.
[11] KOMUKAI D,HASEGAWA T,KANESHIMA N,etal.Influence of acute kidney injury on the time to complete remission in adult minimal change nephrotic syndrome:a single-centre study [J].Nephrology(Carlton),2016,21(10):887-892.
[12] HUANG MJ,WEI RB,SU TY.Impact of acute kidney injury on coagulation in adult minimal change nephropathy [J].Medicine(Baltimore),2016,95(46):e5366.
