结直肠癌患者血清miRNA-767-3p水平及其诊断意义
2018-03-22
(复旦大学附属中山医院消化科 上海 200032)
结直肠癌(colorectal cancer,CRC)是胃肠道最常见的恶性肿瘤之一。根据中国国家癌症登记中心数据估计,CRC已成为我国第5大高发癌症及癌症相关死亡原因[1]。CRC及结直肠腺瘤(colorectal adenoma,CA)等癌前病变的早诊断、早治疗,能够显著提高CRC的检出率并改善预后[2]。目前,结直肠肿瘤的诊断“金标准”为电子结肠镜检查,其具有侵入性、成本高、技术要求较高及出血、穿孔并发症等缺点,不宜在人群中进行大范围筛查。而常用的非侵入性CRC筛查指标,如粪便隐血、粪便脱落细胞学检查、癌胚抗原(carcinoembryonic antigen,CEA)等,早期诊断敏感性较差,因此有必要进一步探索敏感、可靠、非侵入性的CRC早期筛查和诊断指标以提高早期CRC的诊断率。
miRNA是一类由19~25个核苷酸组成的内源性非编码RNA,可与mRNA互补片段结合,降低相关mRNA稳定性和翻译水平,从而发挥调节细胞增殖分化及凋亡、影响干细胞自我更新、诱导上皮细胞间质转化等作用[3-4]。研究表明,多种miRNA在恶性肿瘤患者的血液循环及肿瘤组织的表达水平显著升高或降低,并可作为恶性肿瘤的诊断标志物[5-6]。
研究表明,miRNA-767在肿瘤细胞内的过表达可以改变抑癌基因的5-羟甲基胞嘧啶含量,并调节其甲基化水平[7]。CRC患者肿瘤组织DNA中存在甲基化异常,因此推测miRNA-767水平在组织及血液循环中可能升高。刘寒梢等[8]通过miRNA表达谱芯片检测7例CRC患者血清和10例健康志愿者血清中差异表达的miRNA,发现miRNA-767-3p在CRC患者血清中存在特异性升高。本研究应用实时荧光定量PCR (real-time quantitative PCR,qRT-PCR)方法,检测CRC、CA患者及健康人血清中miRNA-767-3p水平,并与血清CEA浓度相比较,以期分析血清miRNA-767-3p表达水平与CRC及相关癌前病变临床病理参数间的关系,并初步评价其对CRC的诊断价值。
资 料 和 方 法
临床资料选择2015年7至9月在复旦大学附属中山医院就诊的85例经手术后病理诊断为CRC的患者及53例经肠镜病理诊断为CA患者为研究对象,同时选择84例正常健康人为对照(normal control,NC)组,采集术前血清用于检测。其中,CRC组患者男51例,女34例,年龄30~84岁,均无术前放化疗史,按照美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC) CRC TNM分期系统(2010年第7版)进行分期。CA组患者男39例,女14例,年龄28~86岁;NC组男50例,女34例,年龄22~59岁,排除肿瘤性疾病。所有患者及健康志愿者均填写《知情同意书》。CRC组、CA组及NC组的不同临床病理参数,如平均年龄、性别、肿瘤直径、TNM分期、病变位置、淋巴结转移、病理分级等,详见表1。

表1 结直肠癌组、结直肠腺瘤组及健康对照组的临床病理参数Tab 1 Clinicopathological features of CRC group,CA group and NC group
CRC:Colorectal cancer;CA:Colorectal adenomatosis;NC:Normal control.
试剂和仪器SST血清分离管为美国BD公司产品;miRcuteTMmiRNA提取分离试剂盒(DP501)、miRcuteTMmiRNA cDNA第一链合成试剂盒(KR201)、miRcuteTM增强型miRNA荧光定量检测试剂盒(FP411)、miRNA-767-3p引物(5’-UCUGCUCAUACCCCAUGGUUUCU-3’)及外参引物秀丽隐杆线虫miR-39 (cel-miR-39)购自北京天根生化科技有限公司;紫外分光光度仪(NanoDrop 2000c)为美国Thermo-Fisher Scientific公司产品;ABI-7500型实时定量PCR仪为美国Applied Biosystems公司产品;全自动化学发光免疫分析仪(BioPlexTM2200)为美国Bio-Rad公司产品。
血清总RNA提取清晨空腹抽取患者及健康志愿者外周静脉血3~5 mL,析出血清后1 000×g离心,取上层血清保存于-80 ℃冰箱。取100 μL血清,按照miRcuteTMmiRNA提取分离试剂盒说明书步骤提取总RNA。提取RNA方法为吸附柱法。使用紫外分光光度仪测定RNA纯度,其D260/D280比值为1.8~2.2,计算RNA浓度用于进一步实验。
RNA逆转录应用miRcuteTMmiRNA cDNA第一链合成试剂盒,在miRNA 3’末端加多聚A尾Poly(A),再使用oligo(dT)-universal tag通用逆转录引物进行逆转录反应,最终生成miRNA对应的cDNA第一链。取2 μg模板RNA加入0.4 μL大肠埃希菌Ploy(A)聚合酶、2 μL 10×大肠埃希菌Ploy(A)聚合酶缓冲液及4 μL 5×rATP溶液,用无RNase去离子水将总体系补至20 μL,置于37 ℃反应60 min,完成miRNA 3’末端加Poly (A)处理。取2 μL前述Poly(A) 反应液,加入2 μL 10×逆转录引物、2 μL 10×逆转录缓冲液、1 μL超纯dNTPs、1 μL RNase及0.5 μL定量逆转录酶,用无RNase去离子水将总体系补至20 μL,构建逆转录反应体系,于37 ℃反应60 min。
miRNA检测以逆转录得到的cDNA为模板,miR-39为外参,应用miRcuteTM增强型miRNA荧光定量检测试剂盒(SYBR Green)进行实时荧光定量PCR检测。取2 μL miRNA第一链cDNA,加入10 μL 2×miRcute miRNA SYBR-ROX预混液,0.4 μL正向引物,0.4 μL反向引物,用无RNase去离子水将总体积补至20 μL,构成实时定量PCR扩增反应体系。在ABI-7500型实时定量PCR仪上完成PCR扩增。所有样品均设3个副孔,取平均Ct值。反应条件:94 ℃预热2 min,94 ℃ 20 s、60 ℃ 34 s共40个循环。
Ct值处理采用log10(2-ΔCt)法进行表达水平分析。反应体系中荧光信号达到阈值的循环数为Ct,ΔCt=(Ct目的基因-Ct外参基因)。log10(2-ΔCt)为最终该样本miRNA-767-3p的相对表达值。
血清CEA检测使用全自动化学发光免疫分析仪BioPlexTM2200,通过化学发光免疫分析(chemiluminescent immunoassay,CLIA)法测定以上血清标本的CEA浓度(ng/mL)。
统计学分析使用Stata 12.0软件进行数据统计分析。CRC组、CA组与NC组的年龄差异采用多样本Kruskal-Wallis检验,性别差异采用Pearsonχ2检验。CRC组、CA组与NC组的血清miRNA-767-3p表达值和CEA浓度采用多样本Kruskal-Wallis检验。CRC患者miRNA-767-3p表达值与性别、肿瘤病变部位和淋巴结转移的关系使用成组t检验,与肿瘤TNM分期、病理分级的关系使用多样本Kruskal-Wallis检验,与年龄、肿瘤直径的关系使用Pearson线性相关分析。用构建受试者工作特征(receiver operating characteristic,ROC)曲线及曲线下面积(area under the curve,AUC)评估miRNA-767-3p、CEA及miRNA-767-3p联合CEA的诊断效能。所有检验均为双侧检验。P<0.05为差异有统计学意义。
结 果
CRC组、CA组与NC组血清miRNA-767-3p水平和CEA浓度的比较CRC组患者血清miRNA-767-3p水平log10(2-ΔCt)的中位数为3.52,CA组为2.89,NC组为1.78。3组血清miRNA-767-3p水平呈依次递减趋势(图1),3组血清miRNA-767-3p水平间差异具有显著统计学意义(P<0.001)。3组进行两两成组t检验及Bonferroni校正,仍具有显著差异。CRC组血清CEA浓度log10中位数为0.46,CA组为0.32,NC组为0.15,呈依次递减趋势(图2)。
miRNA-767-3p水平与CRC患者临床病理参数的关系血清miRNA-767-3p水平在CRC组、CA组及NC组间的年龄存在显著性差异(P<0.001),但miRNA-767-3p表达水平在CRC患者性别、病变位置、TNM分期、有否淋巴结转移、病理分级等5个病理参数组内比较差异无统计学意义(表2)。此外,CRC患者血清miRNA-767-3p水平与患者年龄相关系数为-0.040,F值为0.13,P值为0.716;与肿瘤直径相关系数为0.021,F值为0.03,P值为0.854,表明CRC患者血清miRNA-767-3p表达水平与患者年龄和肿瘤直径均无相关性。

图1 CRC组、CA组及NC组的miRNA-767-3p水平Fig 1 miRNA-767-3p levels in CRC group,CA group and NC group

NS:Non significant.
图2CRC组、CA组及NC组的CEA浓度
Fig2ConcentrationofCEAinCRCgroup,CAgroupandNCgroup
血清miRNA-767-3p和CEA检测对CRC的诊断价值ROC分析结果显示,CRC组miRNA-767-3p的AUC为0.770 (95%CI:0.698~0.842)。当临界阈值为0.49时,约登指数最高,此时灵敏度为80%,特异度为68%。以≤5 ng/mL作为CEA的正常参考值,则CEA的灵敏度为29%,特异度为100%。若联合测定miRNA-767-3p与CEA,AUC可达0.862 (95%CI:0.806~0.918),诊断灵敏度为73%,特异度为84%。联合应用诊断的计算公式为:0.788×miRNA-767-3p+3.289×CEA。miRNA-767-3p、CEA及miRNA-767-3p与CEA联合应用诊断CRC的ROC曲线见图3。

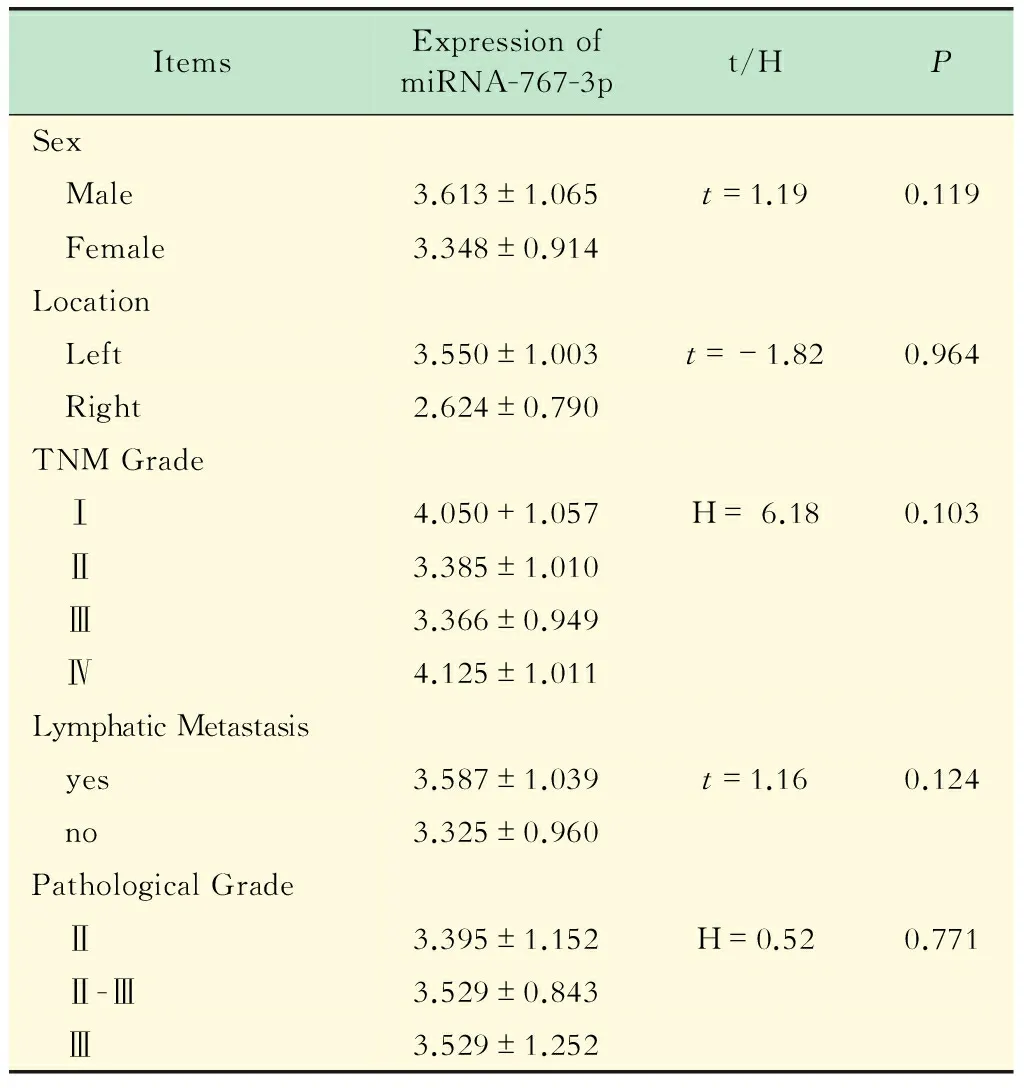
ItemsExpressionofmiRNA-767-3pt/HPSex Male3.613±1.065t=1.190.119 Female3.348±0.914Location Left3.550±1.003t=-1.820.964 Right2.624±0.790TNMGrade Ⅰ4.050+1.057H=6.180.103 Ⅱ3.385±1.010 Ⅲ3.366±0.949 Ⅳ4.125±1.011LymphaticMetastasis yes3.587±1.039t=1.160.124 no3.325±0.960PathologicalGrade Ⅱ3.395±1.152H=0.520.771 Ⅱ-Ⅲ3.529±0.843 Ⅲ3.529±1.252
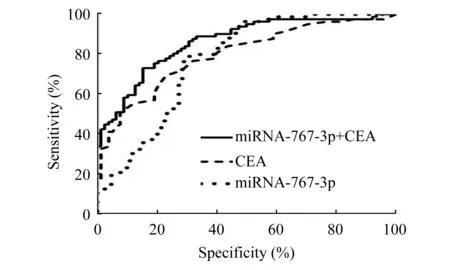
图3miRNA-767-3p及CEA诊断CRC的ROC曲线
Fig3ROCcurvesofmiRNA-767-3pandCEAindiagnosisofCRC
讨 论
miRNA-767有miRNA-767-3p和miRNA-767-5p两种类型,已发现不同种属生物中存在9种核苷酸序列形式,其中hsa-miRNA-767-3p通常被认为是miRNA-767的代表。与其他miRNA不同,除了在脑组织和睾丸组织中表达遗传表型调控作用之外,miRNA-767几乎在所有成体正常组织中都呈完全沉默状态[5]。黑色素瘤细胞系MEL和非小细胞肺癌细胞系GLCPI中,miRNA-767-3p表达均有所增多[9]。
本研究表明,在CRC、CA患者和健康人血清中miRNA-767-3p水平呈依次递减趋势,3组间两两比较差异有统计学意义。与NC组比较,CRC组miRNA-767-3p的AUC为0.770,灵敏度为80%,特异度为68%。一般认为,AUC为0.5~0.7诊断价值较低,0.7~0.9诊断价值中等,0.9以上诊断价值较高。因此,单独以miRNA-767-3p作为CRC的诊断标志物具有中等诊断价值。miRNA-767-3p表达水平与CRC患者性别、年龄、肿瘤直径、病变位置、TNM分期、是否淋巴结转移、病理分级、肿瘤直径等病理参数无关,表明其可作为独立的CRC诊断指标。
CEA是目前临床最常用的CRC肿瘤生物化学标志物,被广泛用于消化道肿瘤诊断,特别是肿瘤术后复发转移的预后评估,但存在灵敏度低,易受非特异性结肠炎、胶原性疾病、心血管疾病影响等缺点[10]。本研究以临床上常用的<5 ng/mL作为血清CEA正常参考值时,CEA灵敏度仅29%。相比于传统的诊断标志物以95%健康人群的取值范围作为患病与否的临床阈值,多种诊断标志物联合以及ROC曲线的应用则大大提高了检测的灵敏度和特异度。 miRNA-767-3p与CEA联合后AUC可达0.862,约登指数可提高到0.57,表明miRNA-767-3p与CEA联合可提升对CRC的诊断效能。
多项研究表明,联合检测血清中2种或2种以上高风险miRNA比检测单一的miRNA诊断价值更高[11-12]。因此,在未来工作中可以检测更多种类的miRNA,使miRNA-767-3p与其他miRNA联合应用,提高对CRC及其癌前病变的诊断效能,从而为CRC的早期诊断、早期治疗和预后判断提供新的研究方向和思路。
[1] CHEN W,ZHENG R,BAADE PD,etal.Cancer statistics in China,2015[J].CACancerJClin,2016,66(2):115-132.
[2] LIEBERMAN J.Micromanaging cancer[J].NEnglJMed,2009,361(15):1500-1501.
[3] KIM VN,HAN J,SIOMI MC.Biogenesis of small RNAs in animals[J].NatRevMolCellBiol,2009,10(2):126-139.
[4] SIOMI H,SIOMI MC.Posttranscriptional regulation of microRNA biogenesis in animals[J].MolCell,2010,38(3):323-332.
[5] SLABY O.Non-coding RNAs as biomarkers for colorectal cancer screening and early detection[J].AdvExpMedBiol,2016,937:153-170.
[6] 刘海宁,朱新宇,吴昊,等.胃癌患者血清miRNA-223的表达水平及其诊断价值[J].中国临床医学,2016,23(4):437-439.
[7] KOZOMARA A,GRIFFITHS-JONES S.miRBase:integrating microRNA annotation and deep-sequencing data[J].NucleicAcidsRes,2011,1(39):D152-D157.
[8] 刘寒梢,马越云,肖华胜.血清微小RNA (miR-129-3p、miR-767-3p和miR-877)在结直肠癌诊断中的价值[J].肿瘤,2012,32(1):42-48.
[9] LORIOT A,VAN TONGELEN A,BLANCO J,etal.A novel cancer-germline transcript carrying pro-metastatic miR-105 and TET-targeting miR-767 induced by DNA hypomethylation in tumors[J].Epigenetics,2014,9:1163-1171.
[10] SORENSEN CG,KARLSSON WK,POMMERGAARD HC,etal.The diagnostic accuracy of carcinoembryonic antigen to detect colorectal cancer recurrence-A systematic review[J].IntJSurg,2016,25:134-144.
[11] VYCHYTILOVA-FALTEJSKOVA P,RADOVA L,SACHLOVA M,etal. Serum-based microRNA signatures in early diagnosis and prognosis prediction of colon cancer[J].Carcinogenesis,2016,37(10):941-950.
[12] ROKKAS T,KOTHONAS F,ROKKA A,etal. The role of circulating microRNAs as novel biomarkers in diagnosing colorectal cancer:a meta-analysis[J].EurJGastroenterolHepatol,2015,27(7):819-825.
