滋膵饮对2型糖尿病大鼠胰岛病理结构的影响
2018-03-22许冬霞
许冬霞
(河南省洛阳市第一中医院药学部,河南 洛阳 471000)
糖尿病已成为影响我国居民健康的主要代谢性疾病,近年调查资料表明,单纯口服西药大多不能有效控制糖血糖[1]。滋膵饮方出《医学衷中参西录》,主要治疗消渴症。现代研究表明滋膵饮对2型糖尿病具有较好的治疗作用[2],但其基础研究文献报道较少。本研究通过建立2型糖尿病大鼠模型探讨滋膵饮对2型糖尿病的治疗作用机制。
1 材料与方法
实验材料。链脲佐菌素(STZ,Sigma公司);滋膵饮(主要成分黄芪、生地、山药、山茱萸、猪胰子由洛阳市第一中医院中药房提供);盐酸二甲双胍片(深圳市中联制药有限公司);葡萄糖检测试剂盒(北京普利莱基因技术有限责任公司);TC、TG、HDL-C测定试剂盒(均购自上海信裕生物科技有限公司),Ins ELISA试剂盒(江苏科特生物科技有限公司)。
药物制备。黄芪、生地、山药、山萸肉用5倍量水浸泡1h后,煎煮3次,每次0.5h,合并煎液,将猪胰子干燥磨成粉末加入煎液,浓缩为大鼠灌胃浓度,分别为0.52g/mL,1.04g/mL,2.08g/mL(以原生药计),二甲双胍配制为0.28g/mL。
动物分组及处理。180~220g雄性SD大鼠100只(购自河南省实验动物中心),随机分出10只大鼠喂养正常饲料做为正常对照组,剩余90只为造模组喂养高糖高脂饲料(由河南省动物实验中心提供,含猪油20%、蔗糖20%)。4周后,造模组大鼠禁食12h,一次性腹腔注射STZ 35mg/kg,正常对照组给予同等剂量的缓冲液注射[3]。注射STZ72h后,检测空腹血糖和葡萄糖耐量(OGTT),成模标准为空腹血糖大于等于7.8mmol/L且灌服2g/kg葡萄糖溶液2h后血糖大于等于11.1mmol/L。选取成模大鼠进行实验。将造模成功的大鼠按血糖均衡原则,分为5组,分别为模型组、二甲双胍组、滋膵饮低中高3个剂量组。正常对照组、模型组给予蒸馏水5mL/(kg·d),二甲双胍组给予二甲双胍200mg/(kg·d),滋膵饮低剂量组、滋膵饮中剂量组、滋膵饮高剂量组分别给予滋膵饮以原生药计10.3g/(kg·d)、20.6g/(kg·d)、41.2g/(kg·d),连续给药8周。
生化指标检测。采用葡萄糖氧化酶法检测大鼠OGTT值,Ins值用ELISA法检测,血清TC、TG、HDL-C采用全自动生化分析仪检测。均严格按说明书操作,LDL-C由计算得到。
胰腺的组织病理学观察。取胰腺组织进行常规的HE染色处理,采用光学显微镜观察胰岛细胞的病理变化。
用SPSS18.0软件进行单因素方差分析(One-Way ANOVA)处理。
2 实验结果
滋膵饮对糖尿病大鼠OGTT的影响见表1。给药8周后,滋膵饮低剂量组在120min时血糖值与模型组比较降低22.8%,两组比较差异有统计学意义(P<0.05);滋膵饮中剂量组在30min、120min时血糖值与模型组相比分别降低27.2%、26.9%,组间比较差异有统计学意义(P<0.05);滋膵饮高剂量组在0min、30min、60min、120min时血糖值与模型组相比分别降低29.1%、32.3%、32.5%、36.7%,组间比较差异有统计学意义(P<0.05)。
表1 滋膵饮对糖尿病大鼠OGTT的影响 (±s)
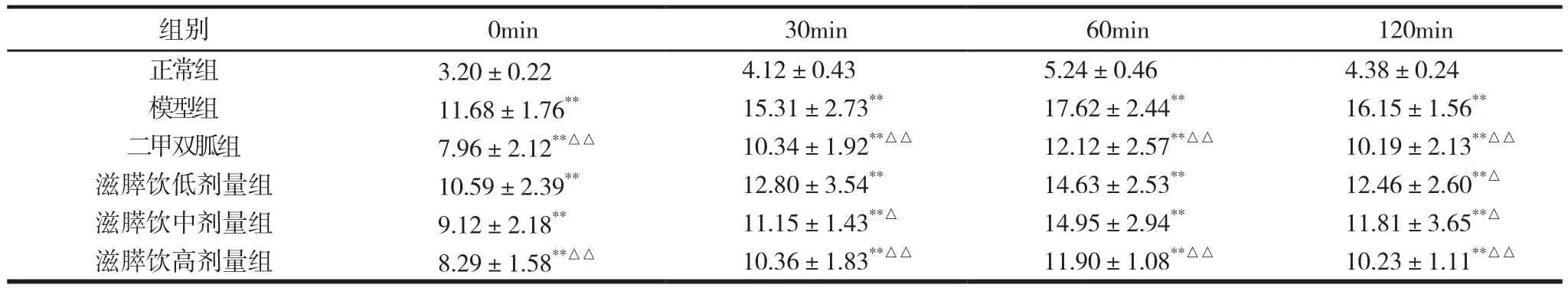
表1 滋膵饮对糖尿病大鼠OGTT的影响 (±s)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。
正常组 3.20±0.22 4.12±0.43 5.24±0.46 4.38±0.24模型组 11.68±1.76** 15.31±2.73** 17.62±2.44** 16.15±1.56**二甲双胍组 7.96±2.12**△△ 10.34±1.92**△△ 12.12±2.57**△△ 10.19±2.13**△△滋膵饮低剂量组 10.59±2.39** 12.80±3.54** 14.63±2.53** 12.46±2.60**△滋膵饮中剂量组 9.12±2.18** 11.15±1.43**△ 14.95±2.94** 11.81±3.65**△滋膵饮高剂量组 8.29±1.58**△△ 10.36±1.83**△△ 11.90±1.08**△△ 10.23±1.11**△△
滋膵饮对糖尿病大鼠血清胰岛素和血脂及脂蛋白的影响见表2。给药8周后,滋膵饮低、中、高剂量组大鼠TC与模型组比较分别降低25.4%、31.3%、25.4%,组间比较差异有统计学意义(P<0.05);滋膵饮各组大鼠TG、LDL-C与模型组相比分别降低37.5%、38.9%、40.6%,35.6%、45.8%、48.3%,组间比较差异有统计学意义(P<0.05);滋膵饮高剂量组Ins与模型组比升高31.3%,组间比较差异有统计学意义(P<0.01);滋膵饮中、高剂量组HDL-C与模型组比较,分别升高30.8%、32.7%,组间比较差异有统计学意义(P<0.05,P<0.01)。
表2 滋膵饮对糖尿病大鼠Ins、TC、TG、HDL-C、LDL-C的影响 (±s)
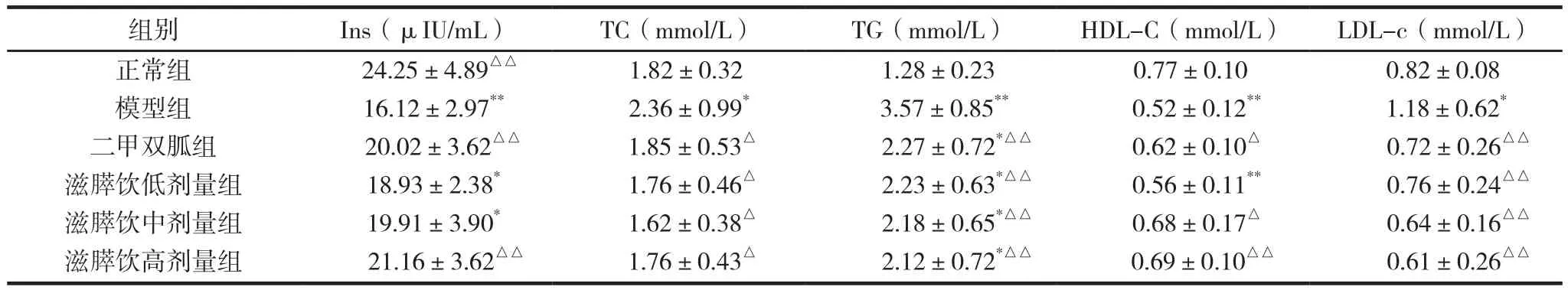
表2 滋膵饮对糖尿病大鼠Ins、TC、TG、HDL-C、LDL-C的影响 (±s)
注:与正常组比较,*P<0.05、**P<0.01;与模型组比较,△P<0.05、△△P<0.01。
组别 Ins(μIU/mL) TC(mmol/L) TG(mmol/L) HDL-C(mmol/L) LDL-c(mmol/L)正常组 24.25±4.89△△ 1.82±0.32 1.28±0.23 0.77±0.10 0.82±0.08模型组 16.12±2.97** 2.36±0.99* 3.57±0.85** 0.52±0.12** 1.18±0.62*二甲双胍组 20.02±3.62△△ 1.85±0.53△ 2.27±0.72*△△ 0.62±0.10△ 0.72±0.26△△滋膵饮低剂量组 18.93±2.38* 1.76±0.46△ 2.23±0.63*△△ 0.56±0.11** 0.76±0.24△△滋膵饮中剂量组 19.91±3.90* 1.62±0.38△ 2.18±0.65*△△ 0.68±0.17△ 0.64±0.16△△滋膵饮高剂量组 21.16±3.62△△ 1.76±0.43△ 2.12±0.72*△△ 0.69±0.10△△ 0.61±0.26△△
滋膵饮对糖尿病大鼠胰腺组织的影响见图1。如图所示正常组大鼠胰岛细胞形态正常,大小均匀,胰岛数量及岛内细胞数均较多,胞浆充实饱满;模型组大鼠胰岛明显萎缩,形状杂乱,边界模糊,细胞数相对减少,胞浆疏松,有的存在空泡;滋膵饮各剂量组大鼠胰岛尚小,个别细胞空泡化,但是形状已基本规则,胰岛与外分泌部界限比较清晰,胰岛细胞数目比模型组增多。

图1 滋膵饮对糖尿病大鼠胰腺组织病理学改变的影响(HE染色,×400)
3 讨 论
糖尿病属中医“消渴”范畴,由饮食不节、劳累过度所诱发,主要病机为气阴两亏、燥热内盛[4]。滋膵饮方中山药补脾肺肾之阴以治消渴,黄芪助脾气上升、散精达肺,生地助肾中之阴上潮以润肺,山茱萸封固肾关,猪胰子以脏补脏,且能润肺升水以止渴[5]。
本研究模拟人体糖尿病发展历程,建立2型糖尿病大鼠模型[6],再给予不同剂量的滋膵饮对其进行治疗,观察滋膵饮对2型糖尿病引起的糖耐量减低、脂代谢紊乱和胰岛病理结构的改善作用。本研究结果显示,滋膵饮高剂量组对糖耐量具有较好的控制作用。滋膵饮能显著升高Ins,降低TC、TG、LDL-C,升高HDL-C,说明滋膵饮确实发挥了中药传统方剂的独特优势既能调节糖脂代谢紊乱,又可促进胰岛素分泌。
胰岛素分泌不足往往是由胰岛β细胞受损引起[7],胰腺组织形态结果显示,模型组大鼠其胰岛明显萎缩,形态结构发生病理性改变。治疗后,滋膵饮组胰岛病理结构得到一定恢复,胰岛细胞形态更规则,边缘更清晰,且随着剂量升高,胰岛形态更规则,边缘更清晰,说明滋膵饮能发挥修复胰岛组织,增强胰岛β细胞功能的作用。
滋膵饮能促进胰岛素分泌,改善2型糖尿病大鼠糖耐量,调节脂质代谢,保护胰岛,其作用机制与促进胰岛素分泌、修复受损的胰岛细胞有关。
[1]纪立农,陆菊明,郭晓蕙,等.中国2型糖尿病药物治疗现状与血糖控制的调查研究[J].中华糖尿病杂志,2012,4(7):397-401.
[2]黄美珍.滋膵饮加味治疗Ⅱ型糖尿病46例疗效观察[J].四川中医,2002,20(7):51.
[3]丁云录,成光宇,朱光泽,等.消渴脂平胶囊治疗2型糖尿病高脂血症实验研究[J].长春中医药大学学报,2016,32(4):692-694.
[4]中华中医药学会糖尿病分会.糖尿病前期中医诊疗标准[J].世界中西医结合杂志,2011,6(5):446-449.
[5]王国庆,安金龙,俞仲贤,等.加减滋膵饮联合厄贝沙坦治疗Ⅲ期糖尿病肾病的临床观察[J].内蒙古中医药,2014,33(29):25-26.
[6]孙晓芳,赵长勇,陈晖,等.高糖高脂饮食加链尿佐菌素建立实验性大鼠2型糖尿病模型[J].南京医科大学学报(自然科学版),2009,29(6):797-800,806.
[7]冯觉平,陈继贵,袁响林,等.氟尿嘧啶对大鼠血糖代谢及胰腺病理结构的影响[J].中华胃肠外科杂志,2010,13(12):935-938.
