鹤立湖浮游植物群落结构及多样性特征
2018-03-22任伟亮柴方营鞠永富于婷于洪贤
任伟亮 ,柴方营 ,鞠永富 ,于婷 ,于洪贤
(1.东北林业大学,黑龙江 哈尔滨 150040;2.黑龙江省水利厅,黑龙江 哈尔滨 150040)
浮游植物作为水域生态系统中的初级生产者,对水体环境的变化很敏感,浮游植物种类、数量及组成的变化与环境因子的变化有着密不可分的联系,是反映水体富营养化状况最重要的生物指标之一[1]。浮游植物在水生态环境中的物质循环和能量流动过程中起着重要作用,而且浮游植物群落结构与其生存的水体环境有密切关系,所以通过调查研究浮游植物群落结构变化可以发现浮游植物生存的水体的真实状况[2,3]。因此,通过浮游植物多样性分析方法可在各种水域中对水环境进行评价。
鹤立湖位于黑龙江省鹤岗市,属温带大陆性季风气候,温差较大,四季变化明显,冬天时间较长,夏季短暂炎热,春秋天气变化剧烈。鹤立湖是以供水为主兼顾防洪、养殖、旅游等,具有很好地研究价值。本文通过对鹤立湖整体采样分析,对其中的浮游植物的丰度、生物量、优势种、生物多样性以及群落结构等进行研究,以期为鹤立湖水质环境保护等提供科学依据。
1 材料与方法
1.1 研究区概况
鹤立湖(47°20'N~47°24'N,130°10'E~130°11'E)位于鹤岗市东山区蔬园乡西3km处,松花江二级支流鹤立河的支流小鹤立河中上游。鹤立湖又兼具水库的作用,水库集雨面积183km2,占小鹤立河流域面积的63%,是一座以城市供水为主,兼顾防洪、养殖等综合利用的中型水库,海拔170m,水深2~16m。
1.2 浮游植物样品的采集与处理
根据鹤立湖周围环境以及水深等因素,分别在湖水平方向上游、中游、下游共设置4个断面(图1)。其中在上游设置1个断面,中游设置2个断面,下游设置1个断面,根据左中右的方向进行采样,共设14个采样点。并且根据不同水深纵向分层采样。在鹤立湖上游河道设一个对照采样点。由于鹤立湖在冬季会封冰,故采样时间选在2016年5—9月,分别在5月、7月、9月进行。
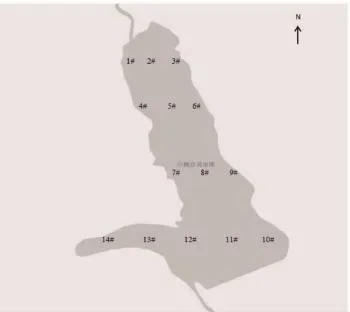
图1 鹤立湖采样点示意图Fig.1 Sampling sites in Heli Lake
采集样品时,每个采样点采集一个定性样品和两个定量样品。定性样品,采样所使用的工具主要有网孔直径为0.064 mm的25#浮游生物网以及5L、1L的采水器。定性采集:在每个样点采集定性样品1个,用25#浮游生物网在离水体表面0.5m处,按“∞”字形拖取3~5min,过滤后装瓶。定量采集:定量样品用5 L采水器采集。根据水深的不同,对采样点进行分层采集,即分上、中、下三层采集水样(一般上层距水体表面0.5m,下层则距离水底0.5m处)。采集后混合,取1L水样装瓶。所有的样品均用15%的鲁格试剂进行固定。将固定好的样品带回实验室沉淀48h后,对上层水进行虹吸,浓缩至30mL,用0.1mL的浮游植物计数框进行计数和分析[4~6],计算丰度和生物量[7]。
1.3 多样性分析
为了避免单一多样性指数造成结果出现偏差,本研究采用Shannon-Wiener多样性指数[8]、Margalef种类丰富度指数[9]、Pielou均匀度指数[10]和物种优势度[11]对鹤立湖浮游植物群落多样性进行评价。
2 结果与分析
2.1 浮游植物种类组成
经过对鹤立湖5月、7月、9月三个月的浮游植物调查,共鉴定出4门32种及变种,其中绿藻门Chlorophyta 13种,约占40.63%;硅藻门Bacillariophyceae 13种,约占40.63%;蓝藻门Cyanophyta 5种,约占15.63%;金藻门Chrysophyta 1种,约占3.11%。
2.1.1 浮游植物种类的季节变化
鹤立湖2016年5月(春季)、7月(夏季)、9月(秋季)为25种、21种、25种,分别占总种数的78.13%、65.63%、78.13%。在5月硅藻门种类的浮游植物种类数目最多,7月中绿藻门种类的浮游植物种类数目最多,在9月硅藻门种类和绿藻门的浮游植物种类数目相同。
如图2所示,浮游植物种类数目最高出现在春季和秋季,硅藻门种类数目在春季最多,绿藻门种类数目最多出现在夏季,蓝藻门种类数量在春季和秋季相同,金藻门在三个季节中的种类数量变化不大。
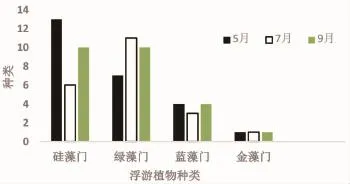
图2 鹤立湖浮游植物种类数量Fig.2 The numbers of phytoplankton species in Heli Lake
2.1.2 浮游植物种类空间分布
鹤立湖采样浮游植物种数中(表1),1#采样点的种类最多为27种,占总种数的84.375%;2#采样点种类数次之为25种,占总种数的78.125%;鹤立湖中,5#上层和10#中层浮游植物种类数最少,为15种,占46.875%。
2.2 浮游植物丰度和生物量的时空变化
由表2可知,鹤立湖的丰度和生物量各个采样点存在差异,各月份间也存在不同。水库中浮游植物的丰度在16.8×104ind/L~166.8×104ind/L之间,最高出现在5月8#中层,为166.8×104ind/L,最低出现在7月12#下层,为16.8×104ind/L;丰度的平均值中,5月的数值最高为89.1×104ind/L,其次是9月64.3×104ind/L,最低的是7月为55.6×104ind/L。
鹤立湖的生物量在0.33~2.73mg/L之间,最高出现在5月的4#下层,为2.73mg/L,最低出现在5月的11#上层,为0.33mg/L;生物量的平均值中,最高的是7月为1.41mg/L,5月次之为1.08mg/L,9月最低为1.01mg/L。

表1 2016年5月、7月、9月鹤立湖浮游植物种数空间分布Tab.1 The special distribution of the numbers of phytoplankton species in Heli Lake in May/July/September in 2016
鹤立湖5月的各采样点丰度变化有一定的波动,5月中8#中层的丰度最大。与5月相比,7月和9月的丰度变化比较平缓,7月最高出现在1#,9月最高出现在13#上层(图3)。
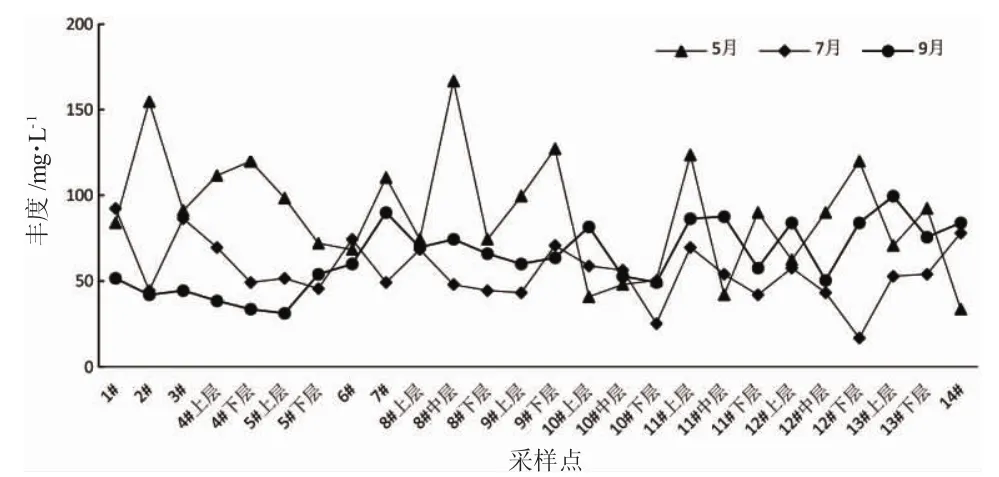
图3 2016年5月、7月、9月鹤立湖浮游植物丰度Fig.3 The phytoplankton abundance of Heli Lake in May/July/September in 2016
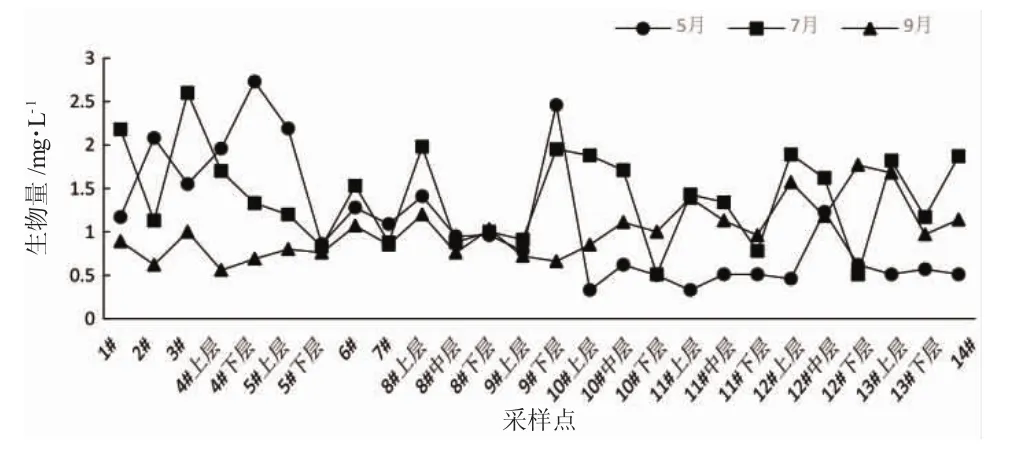
图4 2016年5月、7月、9月鹤立湖浮游植物生物量Fig.4 The phytoplankton biomass of Heli Lake in May/July/September in 2016
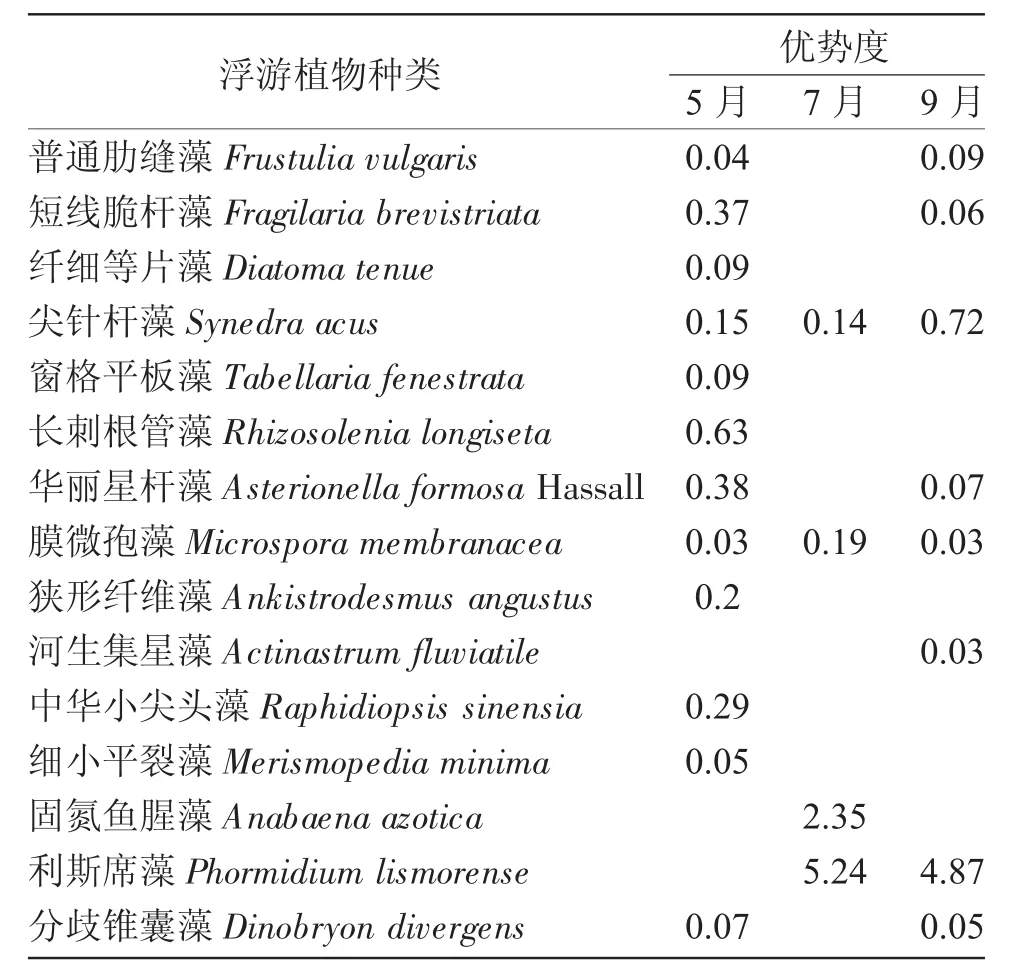
表3 2016年5月、7月、9月鹤立湖浮游植物优势种Tab.3 The phytoplankton dominant species of Heli Lake in May/July/September in 2016
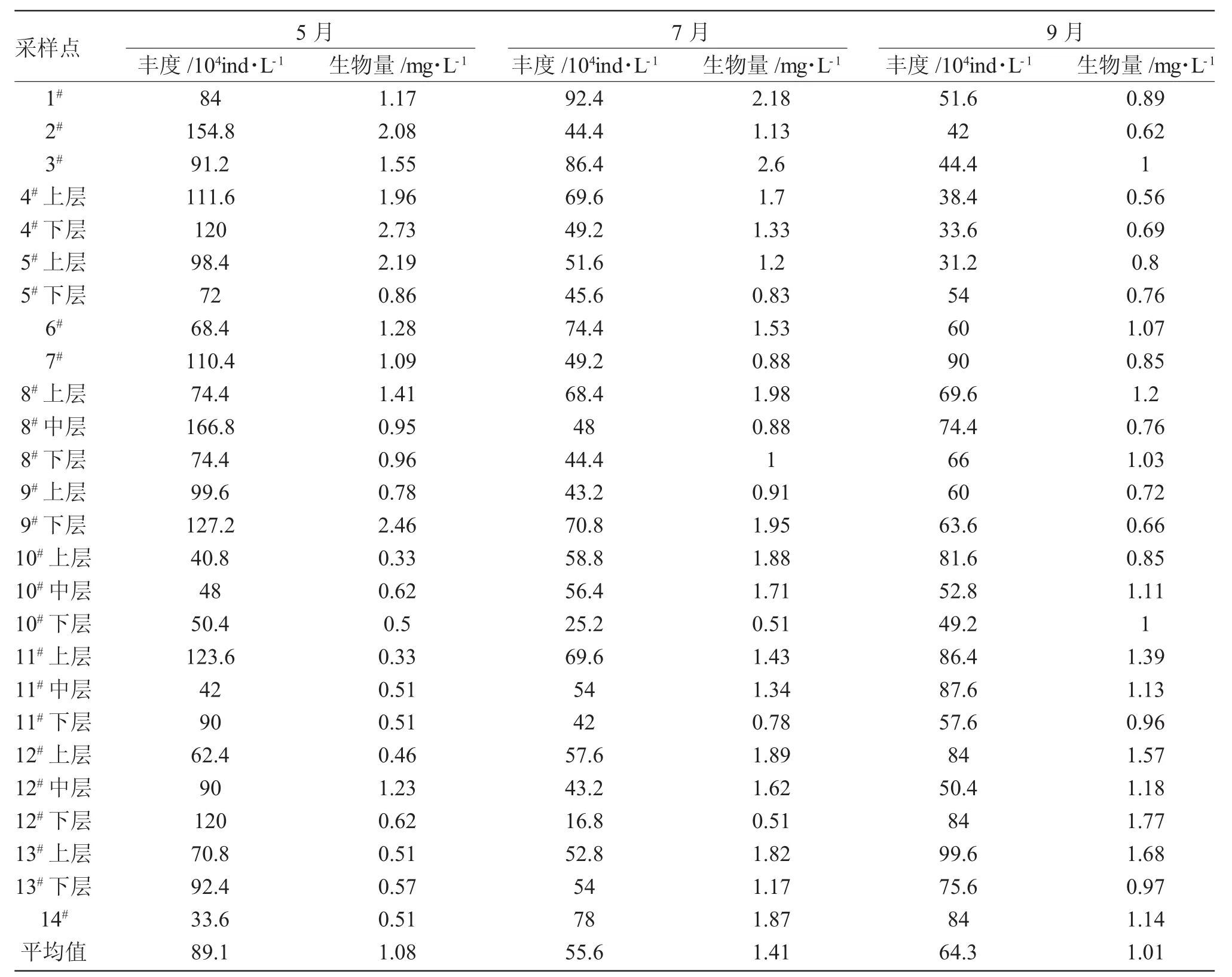
表2 2016年5月、7月、9月鹤立湖浮游植物丰度和生物量Tab.2 The abundance and biomass of phytoplankton species in Heli Lake in May/July/September in 2016
鹤立湖浮游生物生物量,5月和7月的生物量变化波动比较明显,与之相比,9月的浮游生物量变化比较平缓(图4)。
2.3 浮游植物优势种
由表3可知,5月的优势种有12种,其中硅藻7种,绿藻2种,蓝藻2种,金藻1种;优势度最大的是长刺根管藻,为0.63。7月的优势种只有四种,硅藻1种,绿藻1种,蓝藻2种,且这两种蓝藻优势度很大,优势度最大的是利斯席藻,为5.24。9月的优势种有8种,其中硅藻有4种,绿藻有2种,蓝藻和金藻各一种;其中利斯席藻优势度最大,为4.87。可见,利斯席藻在7月和9月优势度都是最大的。
2.4 浮游植物多样性
浮游植物多样性见表4,其中Shannon-Wiener指数从1.44~3.61之间,其中最高的出现在9月为3.61,最低也出现在9月为1.44;Margalef种类丰富度指数从0.55~2.61之间,最高的出现在5月为2.61,最低出现在7月为0.55;Pielou均匀度指数从0.42~0.95之间,最高出现在5月为0.95,最低出现在9月为0.42。
从各个采样点月平均值看,Shannon-Wiener指数最高出现在1#采样点为3.29,最低出现在12#上层采样点为2.08;Margalef种类丰富度指数最高出现在1#采样点为2.42,最低出现在10#中层采样点为1.00;Pielou均匀度指数最高出现在3#采样点为0.87,最低出现在12#上层采样点为0.67。
从3种多样性指数平均值来看,最高值都出现在5月,最低值都出现在7月。
3 讨论
本研究共鉴定出包括蓝藻,绿藻,硅藻,金藻4门32种及变种,其中硅藻门和绿藻门都是13种,蓝藻门5种,金藻门1种。在种类和数量上少于5年前宋俊霖等[3],略少于与裴国霞等[12]研究的金海水库种类和数量。其中,5月的浮游植物优势种种类最多,有12种,7月只有4种,且其中两种蓝藻优势度很大,9月有8种优势种。5月和9月的优势种以硅藻门为主,只有7月的优势种以蓝藻门为主,这可能与夏季鹤立湖中放养了大量的鱼类有关,浮游动物与鱼类对浮游植物组成有较大影响[13]。从整体上看,鹤立湖主要优势种以硅藻为主,这与其他寒冷地带的水体容易出现以硅藻为优势种的浮游植物特征相一致[14-16]。

表4 2016年5月、7月、9月鹤立湖浮游植物多样性Tab.4 The phytoplankton diversityof Heli Lake in May/July/September in 2016
鹤立湖5月的各采样点丰度变化有一定的波动;与5月相比,7月和9月的丰度变化比较平缓,7月和 9月的丰度中,8#~14#的采样点比 1#~7#的丰度大部分高一些;在水深较深的采样点中,一般上层的丰度大于中层的丰度大于下层的丰度。
浮游植物多样性中Shannon-Wiener指数在1.44~3.61之间,根据Shannon-Wiener指数,可以说明鹤立湖的水质为无污染或轻度污染或中污染。其中不同采样点指数不同,可能由于采样点周围环境的不同。Shannon-Wiener指数平均值1#采样点最高,可能由于其位于鹤立湖上游,远离下游岸边,所受人为干扰较少。最低出现在12#上层采样点,可能由于12#离鹤立湖岸边最近,岸边的人为干扰较多。Margalef种类丰富度指数在0.55~2.61之间,且三个月份的平均值分别为1.76、1.10、1.70,表示鹤立湖水质是中污染,其中在7月的指数中数值较低的多,说明可能由于夏天温度较高,使水质中藻类生长数量较5月、9月快,水质没有5月、9月好。但从3个月份平均值来看,各采样点的数值均在1~3之间,说明水质是中污染。由Pielou均匀度指数来看,三个月的指数为0.42~0.95,各采样点平均值在0.67~0.87之间,为轻或无污染。从时间上看,5月的平均数值均最大且都表明鹤立湖水质为无污染或轻污染,因为5月为春天,降雨量少,地表面污染较少进入湖里,人为活动较少,对鹤立湖水质影响较小,温度适宜浮游植物生长,使生物多样性增加[17]。而最低值均出现在7月,夏天温度较高,降雨量变大,周边有一个区域为农田区,灌溉退水等行为,人为活动较多,周边游客也增加,对湖内水质有所影响,使水库水质有所下降,且浮游植物多样性下降。9月,温度在春季和夏季之间,降雨量减少,温度也下降,使得植物多样性有所上升,且浮游植物群落结构稳定。为控制浮游植物群落结构的稳定,放养鲢是一种重要的方式,也是控制水体富营养化的重要手段[18-20]。研究中发现在养殖池塘中将鲢围在池塘一半的区域,可以抑制小型藻类的增长[21]。综合3种多样性分析法,其中Shannon-Wiener指数和Margalef种类丰富度指数均表明水库的水质为无污染或轻污染和中污染。Pielou均匀度指数表明水库水质轻或无污染。
2016年5月、7月和9月鹤立湖中经采样调查共鉴定出蓝藻、绿藻、硅藻、金藻4门32种及变种,其中硅藻门和绿藻门各13种,蓝藻门5种,金藻门1种。5月、9月较7月的浮游植物种类多。Shannon-Wiener指数、Margalef种类丰富度指数和Pielou均匀度指数平均值最大均出现在5月,最小都出现在7月。可见,人为扰动干扰较少,环境温度适宜的采样点水质较好,5月、9月水质状况均好于7月。
[1] Reynolds C S.The ecology of phytoplankton[M].Cambridge UniversityPress,2006:38-90.
[2] SANNA S,MARIA L and MAIJA H.Long-term changes in summer phytoplankton communities of the open northern Baltic Sea[J].Estua-rine,Coastal and ShelfScience,2006,71(3-4):580-592.
[3] 杨亮杰,余鹏飞,竺俊全,等.浙江横山水库浮游植物群落结构特征及其影响因子[J].应用生态学报,2014,25(2):569-576.
[4] 陈伟明,黄祥飞,周万平.湖泊生态系统观测方法[M].北京:中国环境科学出版社,2005.
[5] 胡鸿钧,魏印心.中国淡水藻类:系统、分类及生态[M].北京:科学出版社,2006.
[6] 周凤霞,陈剑虹.淡水微型生物与底栖动物[M].北京:化学工业出版社,2011.
[7] 章宗涉,黄祥飞.淡水浮游生物研究方法[M].北京:科学出版社,1991.
[8] Shannon E and Weaver W.The mathematical theory of communication[M].London:UniversityIllinoisPress,1949:296-297.
[9] MargalefR.Information theoryin ecology[J].General Systems,1958,3:36-71.
[10] Pielou C.An introduction to mathernatical ecology[M].NewYork:WileyInterscience,1969.
[11] Lampitt R S,Wishner K F,Turley C M,et al.Marine snow studies in the Northeast Atlantic Ocean:distribution,composition and roles as a food source for migrating plankton[J].Marine Biology,1993,116:680-702.
[12] 裴国霞,郭琦,魏乐,等.金海水库浮游植物调查及群落结构研究[J].水生态学杂志,2014,35(2):68-73.
[13] 阮景荣.三种鱼的磷排泄及其在微型生态系统磷再循环中的作用[J].水生生物学报,2005,29(1):55-60.
[14] 薛俊增,方伟,蔡桢,等.乌伦古河流域克孜赛水库浮游植物群落组成[J].生物学杂志,2011,28(1):62-65.
[15] 李喆,姜作发,马波,等.新疆乌伦古湖春、秋季浮游植物群落结构的聚类和多维分析[J].中国水产科学,2008,15(6):984-991.
[16] Ma Chengxue,Yu Hongxian,Chen Shuaijun.The community dynamics of phytoplankton with different degrees of human impact in cold water region,a case study in northeast China[J].Water Resource and Environmental Protection,2011(3):2311-2313.
[17] 袁宇翔,于洪贤,姜明.小兴凯湖浮游植物群落结构及多样性[J].湿地科学,2013,11(2):151-157.
[18] 王嵩,王启山,张丽彬,等.水库大型围隔放养鲢鱼、鳙鱼控藻的研究[J].中国环境科学,2009,29(11):1190-1195.
[19] 谢平.鲢鱼、鳙鱼与藻类水华控制[M].北京:科学出版社,2003.
[20] 李琪,李德尚,熊邦喜,等.放养鲢鱼(Hypophthalmichthys molitrix)对水库围隔浮游生物群落的影响[J].生态学报,1993,13(1):30-37.
[21] Laws E A and Weisburd R S J.Use of silver carp to control algal biomass in aquaculture ponds[J].The Progressive Fish Culturist,1990,52(1):1-8.
