硫酸铜对梭鲈幼鱼的急性毒性及其对车轮虫的灭杀作用
2018-03-22王秋实王乐裴月曹顶臣李崇文郑先虎吴学工王炳谦
王秋实 ,王乐 ,裴月 ,曹顶臣 ,李崇文 ,郑先虎 ,吴学工 ,王炳谦
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.天津天祥水产有限责任公司,天津 300000)
梭鲈Sander lucioperca属鲈形目Pericformes鲈科Percidae梭鲈属Stizostedion,主要分布于欧洲的咸海、黑海、里海和波罗的海水系的河流、湖泊,以及等盐线在0.7%~0.9%范围的海区[1],在我国分布于新疆的额尔齐斯河、伊犁河[2]和黑龙江水系。梭鲈肉质优良、无肌间刺,氨基酸含量高[3],是欧洲重要的养殖鱼类,近年我国梭鲈的人工养殖逐步发展起来[4-6],是一种适合池塘、湖泊、水库增殖的优良种类。
车轮虫有280余种,是常见的鱼类寄生虫,在我国发现5属近80种,属寄生性纤毛虫原生动物[7]。生产中常用硫酸铜防治车轮虫病。目前已有学者进行了硫酸铜对梭鲈的急性毒性研究[1,2,8],但用硫酸铜防治梭鲈的车轮虫病尚未见报道。本试验通过研究不同浓度硫酸铜对梭鲈的急性毒性及对车轮虫的灭杀作用,旨在探索用硫酸铜有效灭杀车轮虫的安全用量,为梭鲈车轮虫病的防治提供依据和参考。
1 材料与方法
1.1 材料
试验鱼平均体质量(3.59±0.19)g,平均体长(6.48±0.45)cm,为天津天祥水产有限责任公司提供的当年苗种,亲本来自宁夏地理群体。从确诊患有车轮虫病的养殖池中随机选取试验鱼,镜检患病率约30%,试验前停食1d,放入水族箱中暂养。
试验用五水硫酸铜为蓝色粉末或晶体,大连康宇特种化工有限公司生产,含量≥96%。
1.2 方法
1.2.1 病鱼流行病学特征观察
首先对病鱼的体表、鳃和摄食、游动行为等进行目测观察,随后取病鱼体表黏液和鳃丝在显微镜下观察车轮虫的寄生情况。
1.2.2 急性毒性试验
试验用水为呼兰试验场地下水,曝气72h,水温22.5~24℃,溶解氧 6.4~8.0 mg/L,pH7.8~8.2。试验容器为长方形聚乙烯塑料箱(54cm×36cm×40cm),试验水体50L。先配制成1 000mg/L的五水硫酸铜母液,再按比例稀释至各试验浓度。
在正式试验前,参考硫酸铜生产使用量和文献资料,先进行预试验,确定硫酸铜对梭鲈的24 h全致死浓度下限和96 h无致死浓度上限。根据该浓度范围,按照等对数间距设置五水硫酸铜质量浓度为0.40mg/L、0.70mg/L、1.22mg/L、2.14mg/L、3.75mg/L 和6.57mg/L共6个试验浓度梯度组,设1个空白对照组,每个浓度设2个平行,随机放入30尾鱼,采用静水生物法[9],进行急性毒性试验。为保证试验水体中的药物浓度和水质,每24h更换50%的试验液,试验全程不投喂,微充气。
试验开始后连续12h观察鱼的中毒症状、死亡状况,试验鱼停止呼吸、对外界刺激无反应为死亡,及时清除死鱼。统计各浓度组24h、48h和96h的死亡个体数。
1.2.3 硫酸铜对车轮虫的灭杀作用
按照急性毒性试验的浓度梯度组,设置1个对照组和6个车轮虫灭杀效果观察组,每组随机放入30尾试验鱼,每4h各组分别随机捞取3尾鱼,用显微镜观察鳃丝和体表黏液中车轮虫的灭杀情况。如间隔4h连续2次取样观察无车轮虫或虫体全部死亡,即认定试验鱼体上车轮虫病原灭杀成功。
1.2.4 硫酸铜治疗车轮虫病的生产性试验
选取梭鲈养殖车间中2个发病池(面积12m2,水深50cm的水泥池,每池1 700尾)进行硫酸铜治疗车轮虫病的生产性试验。参照生产经验用量和急性毒性试验的结果,将硫酸铜用水溶化后全池泼洒至池水浓度为0.7mg/L,静水充气消杀24h后,将鱼移至消过毒的新养殖池(新池条件同消毒池)。连续10 d观察车轮虫的灭杀效果和鱼死亡情况。
1.3 数据分析
采用寇氏法(Karder)[10]计算硫酸铜对梭鲈的24h、48h和 96h的半致死浓度(LC50),公式为:
lgLC50的标准误(S)的计算公式:
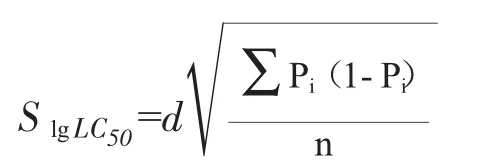
95%可信限(X)的计算公式:

式中:Xi与Xi+1为相邻两组的剂量对数;Pi与Pi+1为相邻两组动物死亡百分比;d为相邻两组浓度对数差。
硫酸铜对梭鲈的安全浓度(SC)计算公式为:

2 结果与分析
2.1 流行病学特征观察
本试验中发病的梭鲈幼鱼摄食减弱,个别个体现离群独游、反应迟缓。显微镜下观察统计,约有30%左右的个体鳃丝和体表黏液中发现车轮虫活体。在100倍视野下,平均5个视野可见2~3个车轮虫。感染车轮虫的个体,鳃丝和体表黏液增多,部分个体鳃丝充血、肿胀,为感染车轮虫病的初期症状。
2.2 硫酸铜对梭鲈的急性毒性
两组高浓度(3.75mg/L和6.57mg/L)试验鱼在试验开始3h后出现呼吸急促、体表黏液增多、反应迟钝的现象;5h后两组部分个体头斜向上悬停于水中,对外界刺激几乎失去反应;7h后6.57mg/L组中部分个体挣扎跳跃,开始出现死亡现象,死亡个体身体僵直,体色发白,口、鳃盖张开;9h后3.75mg/L组个体开始死亡。
低浓度组的试验鱼在试验初期活动正常,与对照组相似,对外界刺激时反应迅速。5h后1.22mg/L和2.14mg/L组的试验鱼开始出现轻微反应迟钝的中毒症状;22 h后两组个别鱼开始死亡。
对照组和0.40mg/L组、0.70mg/L组的试验鱼一直无死亡。各浓度组鱼死亡率见表1。

表1 硫酸铜对梭鲈毒性试验结果Tab.1 Effects of different copper sulfate concentrations on pikeperch Sander lucioperca
硫酸铜对梭鲈的半致死浓度和安全浓度见表2。由表2可知,硫酸铜对梭鲈的LC50随时间的延长而逐渐减小,表明硫酸铜对梭鲈的毒性随时间延长而逐渐增加。
2.3 硫酸铜对车轮虫的灭杀作用
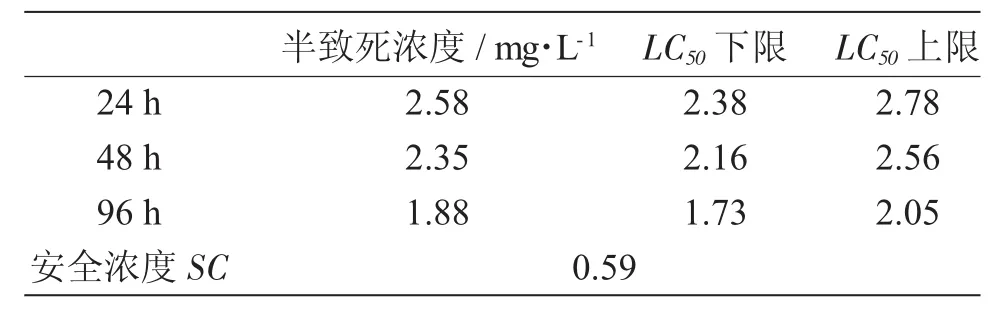
表2 硫酸铜对梭鲈的半致死浓度和安全浓度Tab.2 LC50and safe concentrations of copper sulfate in pikeperch Sander lucioperca
试验开始4h时,0.40mg/L和0.70mg/L两组鱼鳃丝和体表黏液中仍能观察到活体车轮虫,但与对照组相比,虫体活力减弱,数量平均减少到1个左右;8h后,仅0.40mg/L组仍能观察到少量车轮虫,约10个视野可见1~2个活体,多数虫体已死亡;20h后,0.40mg/L组车轮虫灭杀率达到100%。浓度高于0.70mg/L的4个浓度组在试验开始4 h后灭杀率即达100%。
2.4 硫酸铜治疗车轮虫病的生产性试验
两个试验池全池泼洒0.7mg/L硫酸铜24h后,10d内试验鱼仅死亡1尾,患病鱼摄食和日常行为恢复正常,取鳃丝和体表黏液在显微镜下观察,未发现寄生的车轮虫,表明0.7mg/L硫酸铜消毒24h,已成功治愈试验鱼的车轮虫病。
3 讨论
硫酸铜是渔业生产中常用的重金属盐类药物,游离的铜离子能够破坏氧化还原酶系统的活性,阻碍代谢蛋白质的合成[11],可以治疗原生动物引起的寄生虫病[12],还能杀灭一些低等藻类,控制藻类生长,对部分真菌和细菌也有一定的效果[13],尤其是对纤毛虫类寄生虫病有明显的治疗效果。本研究中,硫酸铜对梭鲈的48hLC50为2.35mg/L,高于银鲈Bidyanus bidyanus鱼种(0.76 mg/L)[14],低于加州鲈Micropterus salmoides鱼苗(8.00mg/L)[15]、澳洲宝石鲈 Scortum barcoo稚鱼(9.10mg/L)[16],根据农药对鱼类急性毒性等级评价标准,属中毒药物[17](1.0~10.0),表明梭鲈对硫酸铜的敏感性较弱。硫酸铜的安全浓度为0.59mg/L,接近渔业生产中的常用量0.4~0.7mg/L。本研究中,在浓度为0.7mg/L时,梭鲈96h的死亡率为0,因此认为可以全池泼洒0.4~0.7mg/L硫酸铜治疗梭鲈的寄生虫病,或可用于调节养殖池塘的藻相和菌相。由于硫酸铜会损伤鱼类鳃、内脏器官,富集在鱼体内[18],所以应尽量使用较低的泼洒浓度治疗车轮虫病。本研究中硫酸铜对梭鲈幼鱼的安全浓度为0.59mg/L,在实际使用量超过该浓度时,应密切观察施药池塘,出现异常情况及时采取补救措施。
硫酸铜浓度 0.4mg/L 20h、0.7mg/L 8h,高于0.7mg/L时4h,即可有效灭杀鱼体表寄生的车轮虫,杀虫率可达100%。硫酸铜灭杀车轮虫所需的时间随其浓度增加而缩短。急性毒性试验结果表明,硫酸铜浓度为1~2mg/L时,试验鱼初期活动正常,与对照组相似,5h后出现中毒症状,所以在养殖生产中也可以采用高浓度、短时间的药浴方式治疗车轮虫病。参考其他鱼类使用硫酸铜药浴的经验用量,可以使用1.5mg/L硫酸铜浸泡2h,间隔1d以同剂量再用一次的药浴方式。
药物的毒性效应与试验鱼的生长阶段、生理状态和所处水体水质理化指标等因素密切相关[19]。本研究中,硫酸铜对梭鲈的24hLC50和48hLC50均低于陈罗明等[1]、韩小丽等[2]的研究结果,其原因可能是本试验使用的试验鱼为患病鱼,水温高于前两者。本试验中,患病鱼已有行为异常(摄食减弱)和鱼体损伤(鳃丝肿胀充血、体表黏液增多),抗逆性必然减弱,导致对硫酸铜的敏感度增强。同时有研究表明,硫酸铜对鱼类的毒性随着温度的升高而上升[20,21]。本试验水温高于前两者研究中的水温,势必会造成硫酸铜毒性的增加,导致24hLC50和48hLC50降低。车轮虫病为鱼类养殖常见的寄生虫病,一年四季均可发生,发病高峰水温20~28℃,在养殖生产中,应根据水温、水质和养殖生物的生理状态,适当选择硫酸铜的使用时间和使用量。
综上所述,梭鲈幼鱼对硫酸铜的敏感性较弱,可以使用硫酸铜防治车轮虫病。流水养殖中,在静水充气的条件下,0.4mg/L消杀20h,或0.7mg/L消杀8h,即可达到治疗的效果,也可以采用1.5mg/L硫酸铜浸泡2h,间隔1d以同剂量再用一次的药浴方式;池塘养殖中,若具备增氧设施,可全池泼洒0.4~0.7mg/L浓度进行治疗,如未达到理想效果,可在7d后再施药一次。但在实际应用中,应根据患病鱼的发育阶段、鱼体状态和水质条件,先进行预试验,确定适宜的泼洒浓度,同时准备好补救措施,以达到安全生产和有效治疗的目的。
[1] 陈罗明,凌去非,魏宾,等.四种常用鱼药对梭鲈鱼种的急性毒性实验[J].农业环境科学学报,2006,25(A2):492-495.
[2] 韩小丽,高攀,胡建勇,等.七种常用水产药物对梭鲈幼鱼的急性毒性[J].水产学杂志,2015,28(3):26-29.
[3] 曹桂新,姜正炎,李胜忠,等.梭鲈含肉率及营养成分分析[J].水利渔业,2000,20(6):3-4.
[4] 林治宝,邢中贤,李福友,等.梭鲈繁殖习性及苗种培育技术总结[J].淡水渔业,2000,30(2):7-8.
[5] 柴方营,于洪贤,薛金凤,等.泥河水库梭鲈池塘养殖技术研究[J].水产科学,2000,19(4):8-9.
[6] 马合沙提汉·伊里亚斯,王建平,金艾斯,等.梭鲈大面积池塘繁育试验[J].水利渔业,2004,24(5):38-38.
[7] 刘金海,张正,王印庚,等.盐度对寄主暗纹东方鲀(Takifugu obscurus)存活影响及其对车轮虫的杀灭作用[J].渔业科学进展,2014,35(6):68-75.
[8] 陈罗明,凌去非.3种重金属离子和2种杀虫剂对梭鲈胚胎发育的影响[J].水生态学杂志,2008,29(1):109-111.
[9] 陈万光,刘飞,凡秀丽,等.4种渔药对高体鳑鮍幼鱼的急性毒性[J].江苏农业科学,2012,40(1):203-205.
[10] GB15193.3-2014食品安全国家标准急性经口毒性试验[S].中华人民共和国农业部,2014.
[11] 姜海峰,耿龙武,佟广香,等.5种常用渔药对蒙古鲌的急性毒性作用[J].江苏农业科学,2016,44(10):311-314.
[12] 黄琪琰.水产动物疾病学[M].上海:上海科学技术出版社,2003:55-56.
[13] 耿龙武,徐伟,金国雄,等.4种常用水产药物对大鳞鲃的急性毒性试验[J].江西农业大学学报,2011,33(3):568-572.
[14] 冯晓宇,杨仲景,邓闽中,等.银鲈对五种常用药物的敏感性试验[J].水产科学,2004,23(7):12-14.
[15] 邓国成,姜兰,许淑英,等.加州鲈鱼苗对十种药物的敏感性试验[J].淡水渔业,1994,24(3):14-17.
[16] 蔡永祥,陈校辉,王明华,等.四种常用药物对澳洲宝石鲈稚鱼的急性毒性试验[J].水产养殖,2007,28(1):4-6.
[17] 杨先乐,陆承平,战文斌,等.新编渔药手册[M].北京:中国农业出版社,2005:156-245.
[18] 常藕琴,石存斌,吴淑勤.硫酸铜中毒对剑尾鱼肝脏和鳃损伤的病理学研究[J].广东农业科学,2012,39(21):136-138.
[19] 王雨辰,胡廷尖,刘士力,等.四种常用渔药对泥鳅苗种急性毒性试验[J].江西农业大学学报,2011,33(4):781-785.
[20] CarvalhoCSand Fernandes MN.Effect oftemperature on copper toxicity and hematological responsesin the neotropical fish Prochilodus scrofa at lowand high pH[J].Aquaculture,2006,251(1):109-117.
[21] Lemus MJ and Chung K S.Effect of temperature on copper toxicity,accumulation and purification in tropical fish juveniles Petenia kraussii(Pisces:Cichlidae)[J].Caribbean Journal ofScience,1999,35(12):64-69.
