LifePort持续低温灌注对CDCD边缘供肾保存效果的影响
2018-03-22,,,,,
, ,,,,
(1.南华大学附属第二医院泌尿外科,湖南 衡阳 421001;2.南华大学附属第一医院放疗科)
同种异体肾脏移植术是治疗终末期肾功能衰竭最有效的治疗手段,但是现在器官来源短缺情况非常严重。我国已经全面禁止利用死囚器官[1],而亲属活体捐赠则有违医学不伤害伦理原则,当前肾脏移植供体的主要来源途径是中国公民逝世后器官捐献(Chinese Donation After Citizen’s Death,CDCD)。因此急需通过改良供肾保存方式以提高CDCD供肾质量,改善CDCD供肾有效使用率[2]。供肾保存方法主要有普通冷藏保存和以LifePort(肾脏转运器)为代表的机械持续低温灌注保存两种。前者在保存过程中,供肾容易发生缺血再灌注损伤,移植术后肾功能延迟恢复(Delayed Recovery of Renal Function,DGF)发生率较高。LifePort持续低温灌注保存CDCD供肾能改善供体肾脏缺血再灌注损伤,能较好地弥补普通冷藏保存法的缺陷[3]。本文就LifePort持续低温灌注保存CDCD供肾的优势和经验进行综合评价,为临床移植供肾保存方式的选择提供参考依据。
1 资料与方法
1.1临床资料供者共26例,其中男性19例,女性7例;年龄16~57岁,平均33.4±12.7岁;供体均为Maastricht Ⅳ类(中国Ⅲ类)。脑死亡原因分别为:脑血管意外13例,颅脑外伤12例,脑部肿瘤1例。本次研究选用的CDCD供者均为边缘供体,所有供者在接受器官获取手术之前均接受过1~2次心肺复苏或术前收缩压低于60 mmHg时间均超过30 min,终末血肌酐为145~340.7 μmol/L,平均为231.3±54.1 μmol/L。受者共52例,都是第一次接受肾脏移植,其中男性38例,女性14例;年龄14~60岁,平均36.8±11.7岁;原发疾病为慢性肾小球肾炎者47例,梗阻性肾功能衰竭者3例,多囊肾者2例。受者病程≥1年,透析时间≥半年,术前均未行输血治疗,女性受者生育小孩数≤2个。LifePort组和普通冷藏组各26例,两组在性别构成、年龄、血液透析患者比例及治疗时间、糖尿病患者比例、身体质量指数、HLA错配数等方面差异均无统计学意义。
1.2供肾分组和保存获取供肾后,在无菌低温环境下将供者左右肾分别进行常规修整手术,然后将左右供肾随机分组,将一侧供肾采用LifePort灌注(LifePort组),对侧供肾则采用普通冷藏保存(普通冷藏组)。两试验组的灌注液均为KPS-1液,每500 mL灌注液中常规加入654-2 10 mg,维拉帕米10 mg,肝素6 250 IU,保持灌注温度为0~4 ℃。LifePort组供肾修整完毕,将其放置在LifePort灌注液储肾盒适当位置,选择与供肾动脉血管管径相匹配的套管,将其与供肾动脉连接好,然后把储肾盒及供肾转移到机器中。对机器相关参数如灌注液温度、灌注压、最终阻力系数等进行设置,完成后,启动机器开始灌注。灌注过程中,动态观察显示器上压力、流速、血管阻力系数及温度数值,确保都在正常范围内。若灌注压力≤0.4 mmHg/min·mL,则应立即终止灌注,若灌注压力≥0.4 mmHg/min·mL,则至少要求灌注6 h[4]。灌注完成后将供肾从储肾盒中移出,装入肾袋,送上手术台以供移植。普通冷藏组供肾在修整手术完毕后利用输液器缓慢灌注500 mL KPS-1液后装入肾袋,低温保存,以供移植。按常规供肾肾脏移植手术方法,分离出髂血管,将供肾静脉与髂外静脉行端侧连续吻合,将供肾动脉与髂内动脉行端端连续吻合(或与髂外动脉行端侧连续吻合),阻断供肾血管根部,试行开放髂血管,仔细观察吻合口确认无明显渗血。快速开放供肾静、动脉血流,立即使用热生理盐水纱布对供肾进行复温;将供肾放入髂窝内,将供肾的输尿管与受体的膀胱缝合,并留置D-J管,逐层关闭切口。
1.3术后肾功能恢复情况评定标准以患者在肾脏移植术后第1周内需要血液透析,或者虽然未恢复透析,但是在术后第7天血肌酐值仍然大于400 μmol/L作为判断DGF的标准[5]。
1.4样本采集与检测方法给52例肾脏移植患者分别于术后第1、3、7、14、21、28天各抽晨血1次,采用ELISA方法检测血清细胞间黏附分子-1(serum Intercellular Cell Adhesion Molecule-1,sICAM-1)、超氧化物歧化酶(Superoxide Dismutase,SOD) 、丙二醛(Malondialdehyde,MDA) 浓度,使用日本日立7600型全自动生化分析仪进行检测,Cr采用苦味酸动力学法,试剂购自上海沪峰科技有限公司;胱抑素C( Cystatin C,Cys C) 采用颗粒增强速率散射免疫比浊法(PETIA)在IMMAGE特种蛋白分析仪(美国贝克曼公司生产)上测定,试剂购自上海沪峰科技有限公司。
1.5统计学分析所有的数据均使用SPSS(23.0版)软件进行统计处理,计量资料以均数±标准差表示。连续变量的均数比较使用t检验,非连续变量的比较使用卡方(χ2)检验。以α=0.05为检验水准,P<0.05为差异具有统计学意义。
2 结 果
2.1两组血清中sICAM-1值比较收集两组受者肾脏移植术后不同时间段血液标本,进行检测,发现术后LifePort组受者sICAM-1浓度先短暂升高,于术后第3天达到最高峰(437±58 μg/L),而后开始逐渐下降,至术后第14天左右达到稳定水平。普通冷藏组受者术后sICAM-1的变化趋势同LifePort组(表1),但其峰值(643±66 μg/L)明显高于LifePort组(P<0.05)。

表1 两组受者肾移植术后sICAM-1监测结果(μg/L)
与普通冷藏组比较,aP<0.05
2.2各组血清中SOD活性比较收集两组受者肾脏移植术后不同时间段血液标本,进行检测,发现术后LifePort组受者血清中SOD活性先短暂升高,于术后第3天达到峰值(114.53±5.93 IU/mL),然后呈递减性下降,于术后28天左右回到术前水平。普通冷藏组SOD活性变化规律同LifePort组(表2),但其峰值(87.23±6.39 IU/mL)明显低于LifePort组(P<0.05)。

表2 各组受者肾移植术后SOD监测结果(IU/mL)
与普通冷藏组比较,aP<0.05
2.3各组血清中MDA活性比较术后LifePort组受者血清中MDA活性先短暂升高,于术后第3天达到峰值(4.60±0.34 μmol/L),然后呈递减性下降,于术后28天左右回到术前水平(表3)。普通冷藏组MDA活性变化规律同LifePort组,但峰值(5.90±0.43 μmol/L)明显高于LifePort组(P<0.05)。

表3 各组受者肾移植术后MDA监测结果(μg/L)
与普通冷藏组比较,aP<0.05
2.4各组血清中Cr值比较两组受者在术后没有发生DGF的情况下血清中Cr平均值均急剧下降,术后2周左右恢复正常并维持在稳定水平。与普通冷藏组比较,LifePort组受者血清中Cr平均值降低幅度更大(见图1),出院时LifePort组Cr平均值(118.38±24.40 μmol/L)明显低于普通冷藏组(143.08±31.79 μmol/L)(见图2,P<0.05)。
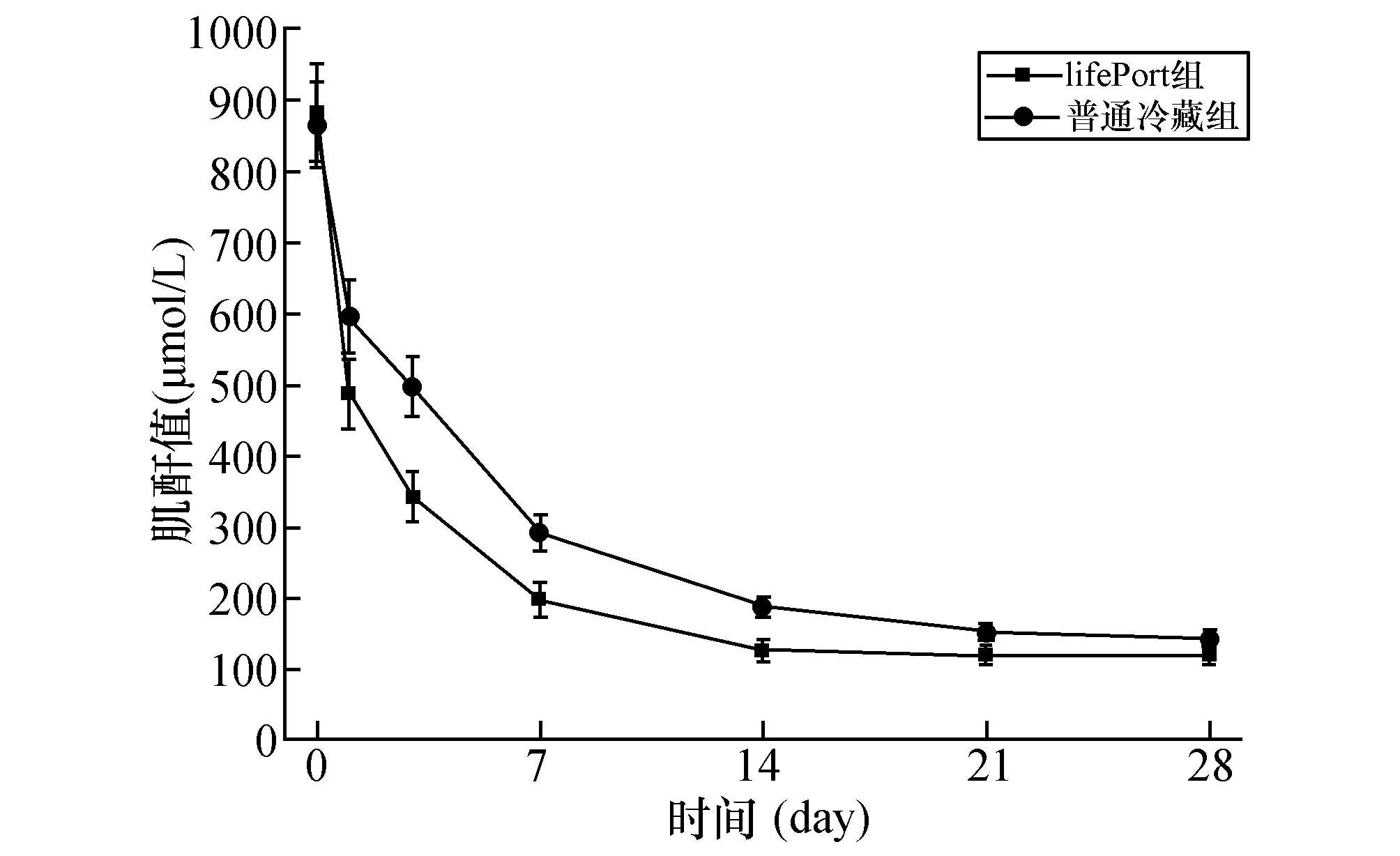
图1 两组受者出院时肌酐平均值比较
2.5各组血清中Cys C值比较两组受者在术后没有发生DGF及AR的情况下血清中Cys C平均值均急剧下降,术后2周左右恢复正常并维持在稳定水平。与普通冷藏组比较,LifePort组受者血清Cys C平均值降低幅度更大,出院时LifePort组Cys C平均值(1.15±0.57 μmol/L)明显低于普通冷藏组(1.74±0.63 μmol/L),两组差异具有显著性(P<0.05,见图3、4)。

图2 两组受者肾移植术后平均肌酐下降情况与普通冷藏组比较,#P<0.05
2.6 DGF发生率52例受者均未发生移植肾丢失,其中LifePort组5例(19.2%)发生DGF,经治疗后在10~18天内(14.7±3.1)逐渐恢复正常。普通冷藏组12例(46.2%)发生DGF,经治疗后在15~27天内(20.3±5.2)逐渐恢复正常。两组间差异有显著性(χ2=9.846,P=0.002)。见表4。
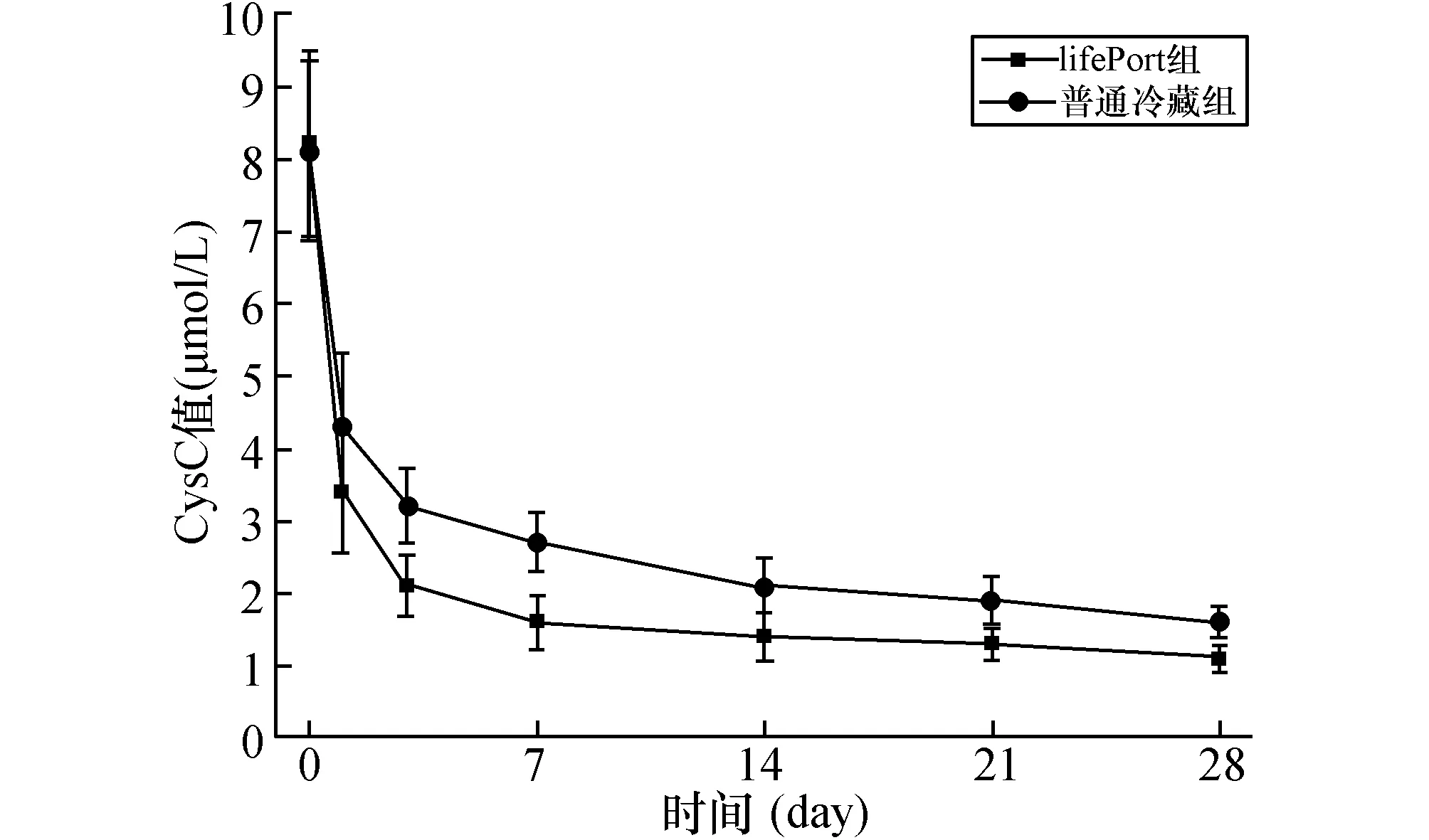
图3 两组受者肾移植术后胱抑素C下降情况
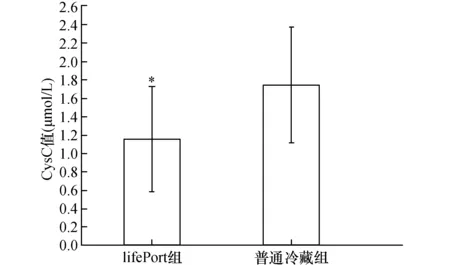
图4 两组受者出院时CysC平均值比较与普通冷藏组,*P<0.05

表4 两组受者肾移植术后DGF发生情况
3 讨 论
大量文献证实,选择不同的供肾保存方法对于维持CDCD供肾的活性来说效果差异明显,因此高效的CDCD供肾保存方法对临床肾脏移植十分重要[6-7]。传统普通冷藏保存方法容易发生缺血再灌注损伤(Ischemia Reperfusion Injury,IRI) ,移植术后DGF发生率较高。此外,其还可作为一种非免疫因素通过影响免疫机制促进急性排斥反应(Acute Rejection Reaction,AR) 的发生[8]。所以传统普通冷藏保存作为供肾常规的保存技术,其保存效果受到了越来越多研究者的诟病,目前临床需要在肾移植早期寻求改善移植肾IRI的有效措施。
LifePort作为一款肾脏机械灌注仪器在国外已广泛应用于临床,LifePort保存CDCD供肾时,它主要是通过机器将低温灌注液持续灌注供肾,为供肾提供营养物质和氧气,并将其代谢产物转运出去来降低CDCD供肾的缺血再灌注损伤,能较好地弥补普通冷藏保存法的缺陷,同时可以清除肾脏残余微血栓、疏通肾脏微血管[9]。本文中,52例受者均未发生移植肾丢失,DGF总发生率为32.7%,其中LifePort组DGF发生率为19.2%,普通冷藏组DGF发生率为46.2%,两者差异具有统计学意义。此外,从结果中还可以看出,两组受者肾脏移植术后DGF发生率均较高,尤其是普通冷藏组DGF发生率远远高于平均水平。这是因为本次研究选用的CDCD供者均为边缘供体,其供肾质量相对较差,故其结果更能体现LifePort灌注保存CDCD供肾的优势,更具说服性。研究结果显示LifePort持续低温灌注保存CDCD供肾能明显降低肾脏移植术后DGF的发生率。
近年来,有研究[10]表明IRI对供肾组织损伤及诱发供肾在移植术后DGF的发生起着重要作用,其机制可能与粘附分子,氧自由基的形成,钙超载及内皮素等有关[11]。通过测定血清sICAM-1、SOD和MDA的含量可反映体内氧自由基的产生和清除状况,间接地反应移植肾脂质过氧化的损伤程度[11-12]。本研究对两组不同肾移植患者血清sICAM-1动态监测发现,两组患者肾移植术后体内sICAM-1水平呈规律变化。肾脏移植术后早期体内sICAM-1浓度先有短暂的升高,于术后第3天左右达高峰,这阶段主要是移植肾缺血再灌注损伤引起诸如TNF-α,IL-1等细胞因子的释放,造成肾脏组织及白细胞sICAM-1表达增加,从而导致血清sICAM-1浓度增高。随着创伤的修复,移植肾组织结构逐渐恢复正常,肾组织中ICAM-1的表达也逐步下降,于术后第14天左右可以达到稳定水平。本次研究还发现,LifePort组肾脏移植受者术后血清sICAM-1表达水平明显较普通冷藏组低,组间差异具有统计学意义。两组受者在肾脏移植术后体内SOD/MDA水平先有短暂的升高,于术后第3天左右达到峰值,这阶段主要是由于供肾缺血再灌注损伤产生的氧自由基增多,触发机体的保护机制,使机体内清除氧自由基的能力反应性增高,加速氧自由基的代谢。随着移植肾功能的不断恢复,氧自由基的不断被清除,体内SOD/MDA水平也逐步下降,于第28天左右回到术前水平。这也证实了脂质过氧化与移植肾缺血再灌注损伤有关。同时,与普通冷藏组比较,LifePort组SOD活力增高水平较高,MDA含量增高水平较低,组间差异明显,具有统计学意义。由此说明LifePort可以通过减少CDCD供肾氧自由基的产生并加速其代谢来降低肾脏缺血再灌注损伤程度。
血清Cr、Cys C是反映肾脏损伤程度及功能而易监测的重要指标,他们灵敏度非常高[13],尤其是近年来对Cys C的相关研究[13-14]表明:Cys C在体内产生速率恒定,经肾小球滤过,不重新入血,故其在血液中浓度完全取决于机体肾小球滤过率。因此,它被一致认为是一种比较理想的评价GFR的指标。本研究中所有肾脏移植受者术后在没有DGF发生的情况下,Cr和Cys C均急剧下降,术后一周左右恢复正常水平。但是与普通冷藏组对比,LifePort组受者术后血清中Cr和Cys C值下降速度更快,幅度更大,且出院时血清Cr、Cys C水平明显低于普通冷藏组。此结果表明,使用LifePort灌注保存的CDCD供肾损伤程度较轻,也就是LifePort具有保护CDCD供肾质量的作用。
综上所述,LifePort用于CDCD供肾灌注保存可以减少供肾缺血再灌注损伤程度,降低移植术后DGF发生率,临床效果明显优于传统普通冷藏保存方法,尤其是对那些边缘供肾,效果更为显著。
[1] 黄洁夫.我国仅1%需要者可获得器官移植机会[J].中国卫生,2010,9:7.
[2] MOERS C,PIRENNE J,PAUL A,et al.Machine perfusion or cold storage in deceased-donor kidney transplantation[J].N Engl J Med,2012,366 (8):770-1.
[3] CATENA F,COCCOLINI F,MONTORI G,et al.Kidney preservation:review of present and future perspective[J].Transplant Proc,2013,45(9):3170-3177.
[4] 袁小鹏,周健,陈传宝,等.心脏死亡器官捐献肾移植101例分析[J].中华移植杂志,2014,8(1):4-8.
[5] MALLON DH,SUMMERS DM,BRADLEY JA,et al.Defining delayed graft function after renal transplantation:simplest is best[J].Transplantation,2013,96(10):885-9.
[6] JOCHMANS I,MOERS C,SMITS JM,et al.Machine perfusion versus cold storage for the preservation of kidneys donated after cardiac death:a multicenter,randomized,controlled trial[J].Ann Surg,2010,252(5):756-64.
[7] BATHINI V,MCGREGOR T,MCALISTER VC,et al.Renal perfusion pump vs cold storage for donation after cardiac death kidneys:a systematic review[J].J Urol,2013,189(6):2214-20.
[8] ABBOUD I,ANTOINE C,GAUDEZ F,et al.Pulsatile perfusion preservation for expanded-criteria donors kidneys:impact on delayed graft function rate[J].Int J Artif Organs,2011,34(6):513-8.
[9] BOND M,PITT M,AKOH J,et al.The effectiveness and cost-effectiveness of methods of storing donated kidneys from deceased donors:a systematic review and economic model[J].Health Technol Assess,2009,13(38):1-156.
[10] ANDREW SIEDLECKI,WILLIAM IRISH.Delayed graft function in the kidney transplant[J].Am J Transplant,2011,11(11):2279-96.
[11] VAN DER VLIET JA,WARLE MC.The need to reduce cold ischemia time in kidney transplantation[J].Curr Opin Organ Transplant,2013,18(2):174-8.
[12] AKSU U,DEMIRCI C,INCE C.The pathogenesis of acute kidney injury and the toxic triangle of oxygen,reactive oxygen species and nitric oxide[J].Contrib Nephrol,2011,174:119-28.
[13] PREMARATNE E,MACISAAC RJ,FINCH S,et al.Serial measurements of cystatin C are more accurate than creatinine-based methods in detecting declining renal function in type 1 diabetes[J].Diabetes Care,2008,31(5):971-3.
[14] 周铁成,杨小云,秦庆,等.胱抑素C测定在肾脏疾病诊断中的临床应用[J].现代检验医学杂志,2008,(3):107-9.
