细菌酯酶研究进展
2018-03-21韦德琴张晓兰宋英莉
韦德琴, 张晓兰, 宋英莉, 朱 辉
(哈尔滨医科大学 生理学教研室,黑龙江 哈尔滨 150081)
酯酶能够催化酯水解生成醇和酸。在自然界中酯酶的来源广泛,其中微生物主要涉及真菌、细菌及个别种类的放线菌。真菌在其中承担着重要作用,真菌中12属23种可产生酯酶,主要是青霉、根霉、须霉、毛霉、链孢霉、红曲霉、黑曲霉、黄曲霉和酵母菌等;其次酯酶存在于包括链球菌、金黄色葡萄球菌、新型隐球菌、绿脓杆菌、结核杆菌等多种细菌中。
1 酯酶的结构、分类、作用机制及基因调控
1.1 酯酶的结构
酯酶属于α/β水解酶超家族,具有Ser-His-Asp(在一些脂肪酶中Glu会代替Asp)构成的催化中心三联体,其中 Ser 通常位于具有保守的 Gly-x-Ser-x-Gly五肽结构内[1-2],如图1所示。
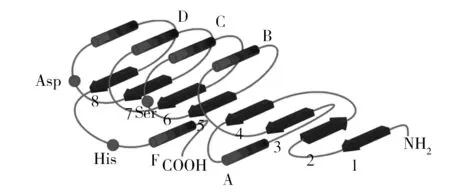
图1 酯酶的空间结构示意图Fig.1 Spatial structure of esterase 1~8:β-折叠;A~F:α-螺旋 1-8: β-sheet; A-F: α-helix
1.2 酯酶的分类
广义的酯酶种类繁多,大致分类如图2所示,包括羧酸酯酶(carboxylesteraseas)、磷脂酶(phospholipase)、硫酸酯酶和硫磷酯酶,羧酸酯酶研究比较广泛,可分为一般所说酯酶和脂肪酶,其中酯酶可分为羧酸酯水解酶、芳香酯水解酶和乙酸酯水解酶。狭义的酯酶主要包括脂肪酶(lipase)、羧酸酯酶和各种磷酯酶。脂肪酶和羧酸酯酶在生化方面没有本质区别,但在底物特异性上,羧酸酯酶倾向于水解酰基链长度小(≤C10)且简单的酯(例如乙酰乙酯)的底物,而脂肪酶倾向于水解酰基链长度大(≥C10)且不溶于水的底物。

图2 广义酯酶的分类Fig.2 Classification of generalized esterases
1.3 酯酶的作用机制
主要介绍羧酸酯酶与脂肪酶的作用机制。这两种酯酶分子都是由两部分组成,分别具有亲水、
疏水活性,活性中心靠近分子的疏水端。羧酸酯酶和脂肪酶的活化中心都是丝氨酸基团,两种酯酶水解机制基本相同:①底物与酯酶活化中心上的丝氨酸基团结合,产生有催化性His和Asp稳定的四面体中间体残基,该四面体中间体裂解生成醇和酰基-酶复合物。②水结合酰基-酶复合物,再次形成四面体中间体,然后裂解生成产物酸和游离酶。人羧酸酯酶催化水解机制(图3):(a→b)一个质子从丝氨酸转移到组氨酸,产生具有亲核能力(原子的电负性越小,越容易给出电子,那么亲核能力就越好)的丝氨酸羟基。接着GLU与HIS(在其他的酯酶里可能是HIS与ASP)之间形成氢键而稳定,此时亲核的丝氨酸结合底物酯中缺少电子的羰基,四面体中间体形成,此中间四面体由于具有两个甘氨酸而更稳定;(b→c)此四面体中间体解体形成酰基-酶复合物,包含酯酶中的组氨酸部分,酯酶丝氨酸结合底物中的羰基部分和底物中的醇;(d→e)水分子激活的组氨酸,接着攻击酰基-酶复合物,再次形成四面体中间体;(e→f)四面体中间体裂解释放酯酶和酸。
脂肪酶与羧酸水解酶特性的区别主要体现在五方面(表1):①结构上脂肪酶在活性位点上有一个疏水基团,故脂肪酶作用于脂溶性底物,最经典的是长链脂肪酸组成的甘油三酸酯,而羧酸水解酶通常水解不超过6个C的短链酯类。②只有脂肪酶具有界面活性现象,即脂肪酶在水油界面上有特殊的催化活性,而在单一水相或油相无催化活性或低催化活性。③在底物活性方面,羧酸水解酶遵从经典的米-曼动力学公式,而脂肪酶的高反应活性只需要很低的底物浓度。④两种酯酶活性对pH的依赖性,脂肪酶在pH 8时活性最高,而羧酸水解酯酶在pH 6时活性最高。⑤两种酯酶在有机溶剂里都稳定有效[3]。

表1 脂肪酶与羧酸酯酶性质的比较
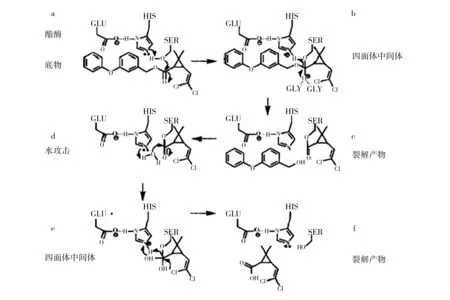
图3 人羧酸酯酶催化水解示意图Fig.3 Catalytic hydrolysis of human carboxylesterase
1.4 基因调控
酯酶的基因调控主要涉及五个方面:直接调控因子、群体感应系统、Gas/Rsm 信号转导系统、调控 Gac/Rsm信号转导系统的调控因子和其他调控因子等。直接调控因子的调控中,细菌酯酶基因的转录受到双组分系统 NtrB/C蛋白超家族的直接调控。NtrB蛋白超家族是感应蛋白激酶(sensor kinase),能感应到细胞外未知信号分子发挥作用。NtrC蛋白超家族是反应调控因子(response regulator),可以与上游激活序列 (upstream activating sequence,UAS)结合从而激活基因转录NtrB 。在调控过程中,NtrB受信号分子刺激后随即发生自身磷酸化,NtrC被激活后行使转录激活因子功能,进一步激活NtrB。目前对于群体感应系统激活酯酶基因表达的分子调控机制只在铜绿假单胞菌中得到阐述[4]。双组分系统GacS/A在细菌酯酶基因表达调控中主要体现在gacS、gacA 或gacS/A的缺失会抑制酯酶基因表达[5]。Gac/Rsm 信号转导系统在革兰阴性菌中由高度保守的GacS/A、CsrA 家族(RsmY/Z或RsmX/Y/Z)和CsrA/RsmA 家族(RsmA或 RsmA/E)组成,这些调控因子通过调控 GarA/RsmA 信号转导系统起到对酯酶基因的调控[6]。目前研究关于核受体(the NR protein pregnane X receptor)和CAR(constitutive androstane receptor)对于人和动物肝脏与肠道羧酸酯酶的调控及地塞米松的治疗已经取得初步进展[5]。Stok等的研究表明肝脏中Ces2、Ces3和小鼠体内Ces6等PXR受体基因的表达与脂类物质水解有关[6-7]。而对于CAR介导的调节,研究表明Ces6是关键基因,并且两种有差异的CAR激活药物苯巴比妥和1,4-双(2-(3,5-二氯吡啶氧基))都能通过CAR起作用[8]。
2 细菌的酯酶
2.1 细菌酯酶的分类及特性
细菌酯酶包括八大家族(表2):“true”lipase(Ⅰ)、GDSL(Ⅱ)、Family(Ⅲ)、the hormone-sensitive lipase(HSL)(Ⅳ)、FamilyⅤ~Ⅷ,其中ture lipase又包括六个亚家族。其中研究较普遍的是Ⅰ[9]和Ⅱ[10]家族。

表2 细菌酯酶分类
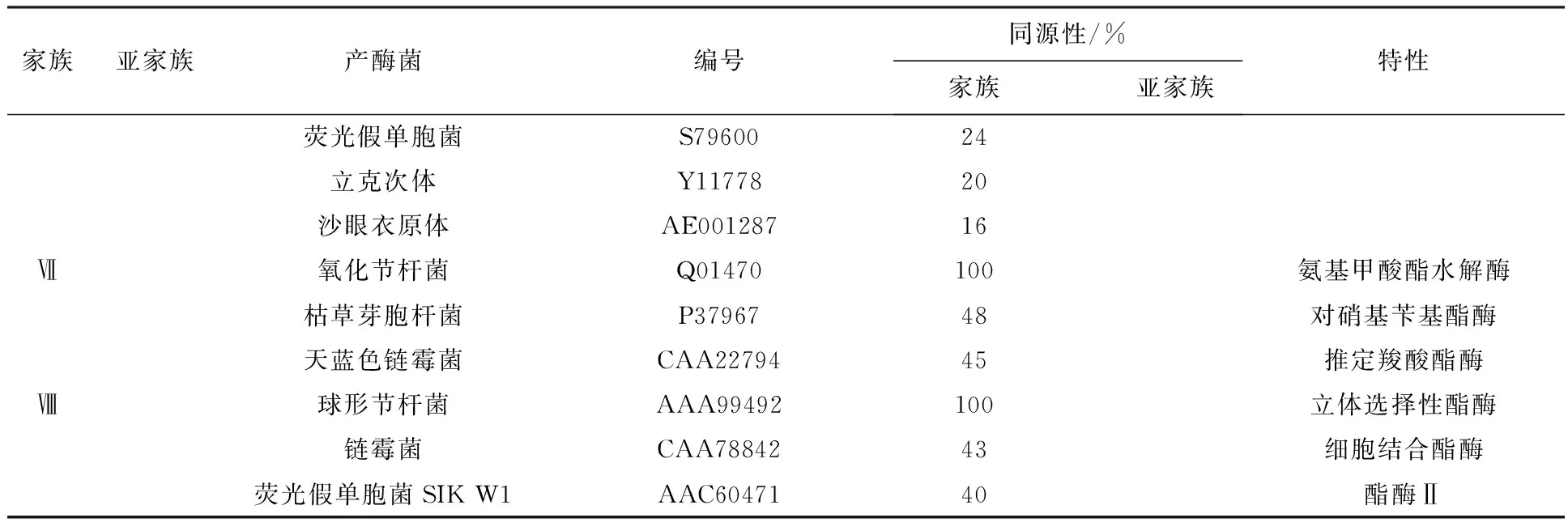
续表2
注:OM:胞外膜;PHA:聚羟基烷酸酯
2.2 酯酶在细菌中的研究进展
2.2.1 酯酶在链球菌中的研究 A组链球菌(group A Streptococcus, GAS )可引起呼吸道、皮肤软组织严重的侵袭性感染及其后遗症,如风湿热、心脏病、肾小球肾炎等。目前对于链球菌所致疾病还没有针对性的治疗方案,只能休息和服用抗菌药物如青霉素、红霉素、林可霉素等。服用抗菌药物疗程至少10 d,使得近年来大量的GAS菌株产生耐药性。GAS疫苗的研究面临着两大难点:① GAS按照细胞壁M蛋白可分为150多个血清型,各血清型之间缺乏交叉,因此很难研发一种针对所有流行菌株的疫苗;② GAS 与人类组织蛋白存在共同抗原,排除所有的与人类组织蛋白有交叉反应的表位,成为筛选GAS疫苗的难点。GAS的多种分泌型成分包括溶血素、链激酶、透明质酸酶、DNA酶、链球菌致热外毒素等与GAS致病密切相关[11]。
最近研究者在GAS中新发现的一种分泌型酯酶SsE可能是一种新的GAS毒力因子[12-13]。在小鼠感染实验中发现,sse基因敲除菌株感染的小鼠死亡率、皮肤感染面积、血液和器官组织中侵袭的细菌数量明显低于野生型菌株。应用SsE蛋白对实验小鼠进行被动免疫,可以降低小鼠的死亡率,这一结果与敲除sse基因结果是相似的。
SsE作用机制可能与水解血小板活化因子(platelet activation factors, PAF)有关[14]。PAF是一种具有炎症细胞趋化活性的磷脂分子,是内皮细胞、中性粒细胞、巨噬细胞和嗜酸性颗粒细胞应对促炎症因子、吞噬作用或其他一些刺激物产生的,它通过与靶细胞膜上的PAF受体结合介导IL-12诱导NK细胞和中性粒细胞的趋化作用,能够诱导中性粒细胞到达感染部位。SsE通过水解PAF削弱宿主中性粒细胞募集。SsE的功能受CovR/CovS双组分调控系统的调控[15]。CovR/CovS双组分调控系统是GAS中最重要的调控系统之一,能直接或间接地影响链球菌15%以上的基因表达,包括溶血素S、链激酶、链道酶等重要的毒力因子。
2.2.2 酯酶在葡萄球菌中的研究 球菌(Staphylococcusaureus,SA)是社区和医院感染的重要危险致病菌之一,是一种典型的革兰阳性细菌,能导致多种疾病,例如普通的皮肤感染(细胞炎、脓疮)、肺炎、血管炎和中毒性休克等。SA的致病性强,感染率高,传播速度快,耐药性强,治疗十分困难。感染SA通常选用抗生素治疗, 但由于近年来多种耐药菌株的出现,通常的抗生素治疗已不可靠。目前研究者正致力于寻找能够预防SA感染的疫苗的有效靶点,希望研制出能有效预防金黄色葡萄球菌感染的疫苗。SA的致病因素取决于毒素与侵袭性酶,主要包括外毒素、杀白细胞素、血浆凝固酶、核酸酶和脂肪酶。
FmtA是一种羧酸酯酶,是SA细胞壁促病毒素中的一种,在青霉素耐药性金黄色葡萄球菌(Mthicillin resistantStaphylococcusaureus, MRSA)中作为毒力因子存在。研究证实,使FmtA失活后,MRSA的青霉素耐药性降低,并且MRSA发生自溶现象。FmtA作用机制是通过作用于磷壁酸(teichoic acid, TA)而发生作用。TA参与细胞分裂,细胞壁的合成,生物膜的形成和细菌的黏附与定殖。TA骨架的糖基化修饰和D-丙氨酸化(D-Ala)对于上述过程十分重要。膜磷壁酸(lipoteichoic acid, LTA)和壁磷壁酸(wall teichoic acid, WTA)都富含磷酸盐,D-Ala上的正电荷部分掩蔽了多元醇磷酸骨架的负电荷,因此,D-Ala含量的变化将导致TA的电荷调节。FmtA能特异性水解D-Ala, 并且酯酶活性调节表明FmtA对TA电荷的调节剂起作用,因此FmtA可能通过作用于TA骨架中的D-Ala而参与金黄色葡萄球菌细胞分裂、生物膜形成、自溶和定居[16]。关于FmtA如何作为调节剂,有研究表明金黄色葡萄球菌酯酶像其他细菌脂肪酶一样,具有可能参与这些酶的界面活化的盖状结构域,该盖状结构是由α-螺旋链组成的空间结构,是脂肪酶的活性部位,在水-油交界面具有特殊活性。双组份调节系统VraSR直接或间接调节FmtA[17]。
2.2.3 酯酶在结核杆菌中的研究 结核杆菌是一种耐酸耐碱的革兰阳性杆菌,细胞表面分子及分泌蛋白、细胞代谢相关因子和转录调节因子是结核杆菌主要致病因素。对于结核病的治疗,早期的药物如异烟肼、利福平、乙胺丁醇联合治疗具有很好的治疗效果。然而近年来,耐药性结核杆菌和超级耐药性结核杆菌感染病例不断出现,使得目前抗结核病药物的药效急剧降低,需要研发针对全新靶点的抗结核药物。
目前,研究发现结核杆菌中有多种酯酶作为毒力因子:①在致病性分枝杆菌中发现一种分泌蛋白PcaA,PcaA是一种环丙烷合成酯酶。在一项致死性小鼠试验中,结核杆菌pcaA基因缺失突变株与野生型菌株相比表现为毒力减弱[18]。这表明PcaA对结核杆菌的致病性具有一定的作用。致病杆菌的致病机制是通过驻留在吞噬体的巨噬细胞中,PcaA酯酶使得分枝菌酸环丙烷基化,阻碍人类单核细胞衍生的巨噬细胞吞噬体成熟和与溶酶体融合,从而逃脱了吞噬体的吞噬作用而致病[19]。②mPTPB是一种酪氨酸酯酶,是结核杆菌的必要毒力因子。研究发现mPTPB能够使结核杆菌逃逸宿主免疫反应,致病机制是mPTPB由结核杆菌分泌到巨噬细胞的细胞质,通过阻断ERK1/2和p38介导IL-6的产生和激活Akt途径,在细胞质中导致结核杆菌变性,从而使结核杆菌能在宿主中生存。并且证实了一种来自于二齿螯合物苯茯苓水杨酸衍生物组合库的选择性mPTPB抑制剂,可以通过细菌的磷脂酶逆转已经改变的宿主免疫反应,阻止结核杆菌在宿主内的生长[20];③结核分枝杆菌lipF基因编码一种羧酸酯酶,研究证实LipF对于结核杆菌致病也十分重要[21]。这种羧酸酯酶LipF受酸性环境的诱导,在pH 值降低时表达量增高。羧酸酯酶LipF的致病机制可能是水解干酪坏死性结核病灶中的有毒脂肪酸,或对适应性反应后损伤的结核杆菌细胞壁进行修复,间接通过细胞壁的毒力作用发挥作用,具体机制尚处于研究阶段。
2.2.4 酯酶在其他细菌中的研究 铜绿假单胞菌是一种有鞭毛革兰阴性菌,无芽胞,能形成荚膜。中耳炎、脑膜炎、呼吸道感染、尿道感染、败血症等是铜绿假单胞菌所致的常见疾病。铜绿假单胞菌毒力因子主要是内毒素、外毒素、蛋白分解酶和杀白细胞素等。在治疗方面,铜绿假单胞菌的耐药性是当今的难点。生物膜的形成与该菌所致相关感染的难治性联系密切。分泌型酯酶EstA是黏液型铜绿假单胞菌在生物膜生长期间产生的细胞外水解酶,致病机制是estA的过表达影响细胞外聚合物质(extracellular polymeric substances, EPS)的组成和物理化学性质。研究表明estA过表达导致细胞外鼠李糖脂的浓度增加,具有提高单鼠李糖脂水平的能力,从而导致EPS疏水性和黏度增加。此外,酯酶EstA还影响细胞运动性,过度表达的estA导致细胞失去动力。并且EstA过量表达导致菌株完全丧失3D生物膜的形成能力[22]。现已根据铜绿假单胞菌分泌的EstA,研究出能水解β-乙酰硫代丁酸甲酯的外旋甲基,产生D-对映体的药物,目前用于治疗高血压[23]。
枯草芽胞杆菌是能形成芽胞的革兰阳性杆菌,可引起结膜炎、虹膜炎和全眼炎。YesT蛋白是在枯草芽胞杆菌中发现的一种鼠李半乳糖醛酸聚糖乙酰酯酶,在大肠埃希菌中表达,这种酶具有嗜热性,分子量为37 kDa。实验证实YesT、链霉菌的酯酶、PAF-AH和大肠埃希菌的硫酯酶都属于SGNH家族[24]。SGNH家族是细菌酯酶GDSL家族中的亚家族。该家族具有的特有结构是它的丝氨酸活性位点靠近N-端。目前没有文献报道YesT是否作为枯草芽胞杆菌的毒力因子,但是根据其相似性,YesT是否与上述几种酶作用机制相关值得探讨。
在热带地区,类鼻疽伯克霍尔德菌是一类导致败血病的革兰阴性杆菌。类鼻疽伯克霍尔德菌能够产生许多与毒力相关的分泌型物质, 如蛋白酶、 脂酶、 过氧化氢酶、 超氧化物歧化酶和溶血素等,其中一些毒力因子与免疫逃避机制有关。研究人员发现来自伯克霍尔德菌产生细胞外脂肪酶和细胞结合型脂肪酶,其中三种细胞结合脂肪酶LipA、LipC21和LipC24都能在E.coil中表达,LipA和Lip24显示出脂肪酶活性,水解中等长度的酰基(C10-C14)[25]。
3 展 望
酯酶广泛存在于自然界,是许多致病性细菌的毒力因子。细菌中酯酶作为毒力因子,致病机制有相似之处,也存在特异性的差异。目前的研究发现,酯酶作为毒力因子的致病机制大部分是酯酶使得细菌能够逃逸机体的免疫反应。但是不同细菌中酯酶如何参与免疫逃逸现象不尽相同,关联性也没有明确研究。如果能够全面认识酯酶,明确酯酶在各种致病菌中的致病机制,找出致病机制中的关键靶点,将有可能对致病菌所致疾病在免疫水平上得到初步解决,在治疗水平与其他应用方面提供新的思路,成为医学治疗的突破性研究。
[1] Angkawidjiaja C, Koga Y, Tzkano K, et al. Structure and stability of a thermostable caeboxyl-esterase from the thermoacidophilicarchaeonSulfolobustokodaii[J]. FEBS Journal, 2012, 279(17):3071-3084.
[2] Stok JE, Goloshchapov A, Song C, et al. Investigation of the role of a second conserved serine in carboxylesterases via site-directed mutagenesis[J]. Biochim Biophys Acta, 2004, 430(2): 247-255.
[3] Chahinian H,Fantini J,Garmy N,et al. Non-lipolytic and lipolytic sequence-related carboxyl-esterases: a comparative study of the structure-function relationships of rabbit liver esterase 1 and bovine pancreatic bile-salt-activated lipase[J]. Biochim Biophys Acta, 2010, 1801(11):11 95-1204.
[4] Williams P, Camara M. Quorum sensing and environmental adaptation inPseudomonasaeruginosa: a tale of regulatory networks and multifunctional signal molecules[J]. Current opinion in microbiology, 2009, 12(2): 182-191.
[5] Lalaouna D, Fochesato S, Sanchez L, et al. Phenotypic switching inPseudomonasbrassicacearuminvolves GacS-and GacA-dependent Rsm small RNAs[J]. Applied and environmental microbiology, 2012, 78(6): 1658-1665.
[6] Stok JE, Huang H, Jones PD, et al. Identification, expression, and purification of a pyrethroid-hydrolyzing carboxylesterase from mouse liver microsomes[J].The Journal of biological chemistry, 2004, 279(28):29863-29869.
[7] Xu C, Wang X, Staudinger JL. Regulation of tissue-specific carboxylesterase expression by pregnane x receptor and constitutive androstane receptor[J]. Drug Metab Dispos, 2009, 37(7): 1539-1547.
[8] Staudinger JL, Xu C, Cui YJ, et al. Nuclear receptor-mediated regulation of carboxylesterase expression and activity[J]. Expert opinion on drug metabolism & toxicology, 2010, 6(3):261-271.
[9] Bia ecka-Florjańczyk E,Fabiszewska AU, Krzyczkowska J, et al. Synthetic and Natural Lipase Inhibitors[J]. Mini-Reviews in Medicinal Chemistry, 2016, 16.
[10] Shakiba MH, Ali MS, Rahman RN, et al. Cloning, expression and characterization of a novel coldadapted GDSL family esterase fromPhotobacteriumsp. strain J15[J]. Extremophiles, 2016, 20(1):44-55.
[11] Sugimori D, Kano K, Matsumoto Y. Purification, characterization, molecular cloning and extracellular production of a phospholipase A1 fromStreptomycesalbidoflavusNA297[J]. FEBS open bio, 2012, (2):318-327.
[12] Liu M, Zhu H, Li J, et al. Group AStreptococcussecreted esterase hydrolyzes platelet-activating factor to impede neutrophil recruitment and facilitate innate immune evasion[J]. PLoS pathogens, 2012, 8(4):1002624.
[13] Feng W, Liu M, Chen DG, et al. Contemporary Pharyngeal and Invasive emm1 and Invasve emm12 Group AStreptococcusIsolates Exhibit Similar In Vivo Selection for CovRS Mutants in Mice[J]. PloS one, 2016, 11(9):0162742.
[14] Liu G, Liu M, Xie G, et al. Characterization ofStreptococcalplatelet-activating factor acetylhydrolase variants that are involved in innate immune evasion[J]. Infection and immunity, 2013, 81(9):3128-3138.
[15] Alam FM, Turner Ce Fau-Smith K, Smith K Fau-Wiles S, et al. Inactivation of the CovR/S virulence regulator impairs infection in an improved murine model ofStreptococcuspyogenesnasopharyngeal infection[J]. PLoS One, 2013, 8(4):61655.
[16] Rahman MM, Hunter HN, Shamina Prova, et al. TheStaphylococcusaureusmethicillin resistance factor fmtA is a d-Amino esterase that acts on teichoic acids[J]. mBio, 2016, 7(1): e02070-15.
[17] Chen H,Xiong Z,Liu K, et al.Transcriptional profiling of the two-component regulatory system VraSR inStaphylococcusaureuswith low-level vancomycin resistance[J]. Int J Antimicr-ob Agents, 2016,47(5):362-367.
[18] Takayama K, Wang C, Besra GS. Pathway to synthesis and processing of mycolic acids inMycobacteriumtuberculosis[J]. Clin Microbiol Rev, 2005, 18(1):81-101.
[19] Rosa Milagros Corrales, Virginie Molle, Jade Leiba, et al. Phosphorylation ofMycobacterialPcaA Inhibits Mycolic Acid Cyclopropanation[J]. Journal of biological chemistry, 2012, 287(31):26187-26199.
[20] He R, Zeng LF, He Y, et al. Organocatalytic multicomponent reaction for the acquisition of a selective inhibitor of mPTPB, a virulence factor of tuberculosis[J]. Chem Commun (Camb), 2013, 1149(20):2064-2066
[21] Zhang M, Wang JD, Li ZF, et al. Expression and characterization of the carboxyl esterase Rv3487c fromMycobacteriumtuberculosis[J]. Protein Expr Purif, 2005, 42(1):59-66.
[22] Tielen P, Rosenau F, Wilhelm S, et al. Extracellular enzymes affect biofilm formation of mucoidPseudo-monasaeruginosa[J]. Microbiology, 2010,156(7):2239-2252.
[23] Kovacic F, Bleffert F, Caliskan M, et al. A membrane-bound esterase PA2949 fromPseudomonaaeruginosais expressed and purified fromEscherichiacoli[J]. FEBS Open Bio, 2016, 6(5):484-493.
[24] Martinez-Martinez I, Navarro-Fernandez J, Daniel Lozada-Ramirez J, et al.YesT: a new rhamnogalacturonan acetyl esterase fromBacillussubtilis[J]. Proteins, 2008, 71(1):379-388.
[25] Shu Z, Lin H, Shi S, et al. Cell-bound lipases fromBurkholderiasp. ZYB002: gene sequence analysis, expression, enzymatic characterization, and 3D structural model[J]. BMC Biotechnol, 2016, 16(1):38.
·写作常识·
署名
论文的作者应在发表的作品上署名。署名者可以是个人作者、合作作者或团体作者。
1 署名是拥有著作权的声明。《中华人民共和国著作权法》规定:著作权属于作者。著作权包括发表权、署名权、修改权、保护作品完整权等。署名权即表明作者在作品上署名的权利;署名表明作者的劳动成果及作者本人都得到了社会的承认和尊重,即作者向社会声明,作者对该作品拥有了著作权。
2 署名是表示文责自负的承诺。署名即表明作者愿意承担责任。
3 署名便于读者与作者联系。署名即表明作者有同读者联系的意愿。
4 论文的署名者应具备下列条件:①本人应是直接参加课题研究的全部或主要部分的工作,并做出主要贡献者;②本人应为作品创作者,即论文撰写者;③本人对作品具答辩能力,并为作品的直接责任者。
不够署名条件但确对研究成果有所贡献者可作为“致谢”段中的感谢对象。可以由学生和导师共同署名,一般是学生在前导师在后。个人署名一般应使用真实姓名。多位作者共同完成的作品联合署名时,署名顺序按对该文的贡献大小排列。第一作者是主要贡献者和直接创作者,除有特别声明外,第一作者就是第一权利、第一责任和第一义务者。翻译的作品,应同时注明原作者和编译者。
