异源副粘病毒感染对雏鸭血清抗氧化酶活性的影响
2018-03-21周明辉顾有方
周明辉, 顾有方
(1.合肥师范学院 生命科学学院,安徽 合肥 230039;2.安徽科技学院 动物科学学院,安徽 凤阳 233100)
随着生命科学和医学的发展,对生命现象和疾病机理的探讨已深入到细胞和分子水平,而自由基则扮演相当重要的角色[1]。机体在正常情况下,体内自由基的产生和清除保持着动态平衡,这种平衡能够保护身体免受细菌、病毒等有害物质侵害[2-3]。但在某些情况下,如感染了某些病毒或者是机体的某些功能发生了紊乱,从而打破了这种动态平衡,使自由基的产生远远超出清除的水平,自由基在体内越积越多,引起了多种细胞成分发生改变,甚至使细胞受到损伤;并且攻击细胞,促使蛋白质、核苷酸、脂肪的代谢异常,细胞产生突变而引起疾病[4-5]。为了维持这种动态平衡,细胞内存在有防止生物分子氧化损伤的抗氧化剂和抗氧化酶以及修复系统,而其中清除过量自由基主要依靠抗氧化酶系统[6]。抗氧化酶系统主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)及谷胱甘肽过氧化物酶(GSH-Px)等,这些酶不但协同防止自由基损伤效应而且相互间起着保护作用[7-8]。此外自由基引发脂质过氧化反应,从而引起组织损伤,该损伤主要是通过脂质过氧化反应实现的[9-10]。因此研究机体抗氧化损伤程度可以通过检测血液及组织中的各类抗氧化酶活性与丙二醛(MDA)含量来衡量。近年来副粘病毒属广泛传播,并且能在禽类中发生流行,国内外对此病的研究主要在鸡病方面,但近年来,鸭、鹅源副粘病毒的感染也有了报道[11-13]。因此,本研究通过检测雏鸭在感染异源副粘病毒后血液中SOD、CAT、GSH-Px活性及MDA含量的变化,研究异源副粘病毒感染后雏鸭机体内抗氧化酶活性是否存在差异,以及脂质过氧化程度与抗氧化酶活性变化的相关性,为禽类感染副粘病毒的防控提供依据。
1 材料与方法
1.1 材料
1.1.1 毒株 鸡源、鹅源和鸭源副粘病毒毒株,由安徽科技学院预防兽医学实验室提供,均为复壮的SPF鸡胚绒尿液。
1.1.2 实验动物及饲养管理 1日龄雏鸭200只,购自某孵化场,雏鸭饲养于彻底消毒的实验动物房内。雏鸭入舍后立即给予高锰酸钾溶液饮水,并用百毒杀溶液喷雾消毒,7 h后给予饮用糖盐水,并开食,雏鸭入舍后8 h颈部皮下注射抗鸭病毒性肝炎高免血清。
1.1.3 测定项目及方法 SOD:黄嘌呤氧化酶法;CAT:钼酸铵法;MDA:硫代巴比妥酸比色法;GSH-Px:DTNB法;蛋白质:考马斯亮兰法。以上所用试剂均由南京建成生物研究所提供。
1.2 方法
1.2.1 试验设计 选择饲养20日龄健康雏鸭100只,随机分成Ⅰ、Ⅱ、Ⅲ、Ⅳ四组,每组数目相等,均为25只。第Ⅰ组为对照组,第Ⅱ、Ⅲ、Ⅳ组分别为鸡新城疫病毒、鹅源副粘病毒、鸭源副粘病毒攻毒组。雏鸭至21日龄时,将病毒鸡胚尿囊液用灭菌的生理盐水按1∶5稀释,按0.5 mL/只皮下注射各攻毒组的雏鸭,对照组的雏鸭用等量灭菌的生理盐水进行皮下注射。攻毒后7、14、21、28 d随机抽取Ⅰ、Ⅱ、Ⅲ、Ⅳ组雏鸭各5只进行静脉放血,采集血液,2000 r/min离心分离血清,-30 ℃冰箱保存备用。
1.2.2 抗氧化酶活性与MDA含量检测 对所选雏鸭攻毒后的28 d,以7 d为1个周期,检测对照组与3组不同来源的副粘病毒感染的血清中SOD、CAT、GSH-Px及MDA的活性与含量,同时以4 d为一个周期检测雏鸭机体内抗氧化酶的活性与脂质过氧化标志物MDA的变化趋势。
1.2.3 数据处理 利用SPSS软件对Ⅰ、Ⅱ、Ⅲ、Ⅳ四组血清中抗氧化酶活性与MDA含量的差异性进行分析。
2 结果与分析
2.1 异源副粘病毒接种对雏鸭血清SOD活性影响
由表1可知,攻毒后7 d时,各组雏鸭血清中SOD活性均无显著性差异(P>0.05),攻毒后14、21、28 d时,鸭源副粘病毒、鸡源副粘病毒、鹅源副粘病毒与试验对照组的SOD分别存在极显著差异(P<0.01)、显著差异(P<0.05)、极显著差异(P<0.01),且攻毒组之间SOD也存在着不同程度的差异。
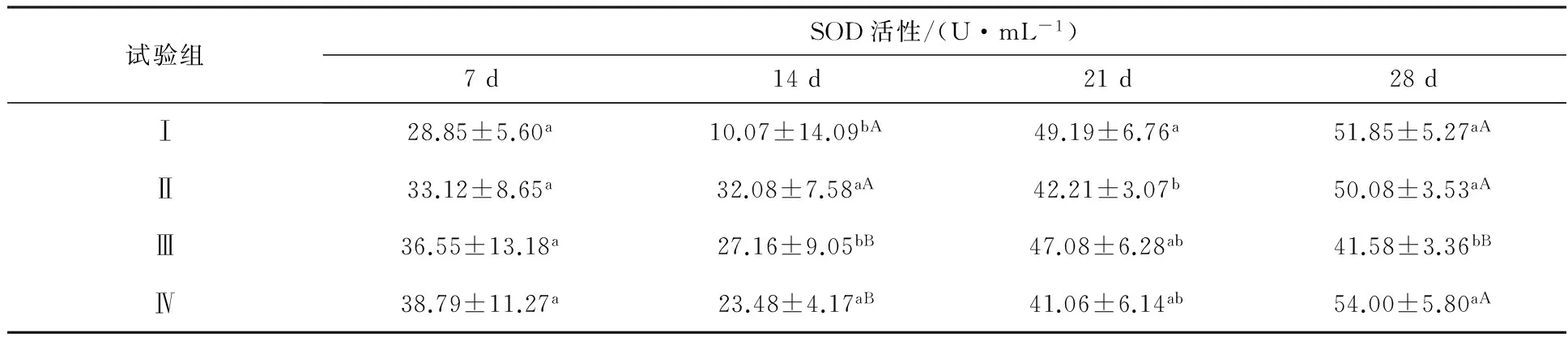
表1 异源副粘病毒对雏鸭血清SOD活性影响
注:同一列中小写字母不同表示显著差异(P<0.05),大写字母不同表示极显著差异(P<0.01),下表同
2.2 异源副粘病毒接种对雏鸭血清CAT活性影响
由表2可知,攻毒后7 d时,试验对照组与各攻毒组血清CAT活性均有极显著差异(P<0.01),攻毒后14 d时,鸭源副粘病毒、鹅源副粘病毒与试验对照组的CAT存在极显著差异(P<0.01),攻毒后21 d时血清CAT活性均无显著性差异(P>0.05),攻毒后28 d时实验中出现一无效值,无法比较。
2.3 异源副粘病毒接种对雏鸭血清MDA含量影响
由表3可知,攻毒后7、14、28 d时,血清MDA含量均无显著性差异(P>0.05),21 d时,对照组与鸭源副粘病毒血清MDA含量存在显著差异(P<0.05),攻毒14 d时,攻毒组的MDA含量要明显高于对照组,至21 d时又显著下降。

表2 异源副粘病毒对雏鸭血清CAT活性影响
注:“-”代表无效值

表3 异源副粘病毒对雏鸭血清MDA活性影响
2.4 异源副粘病毒接种对雏鸭血清GSH-Px活性影响
由表4可知,攻毒后7、28 d时血清的GSH-Px活力均无显著性差异(P>0.05),攻毒后14 d时,对照组与鸭源副粘病毒血清GSH-Px含量存在显著差异(P<0.05),攻毒后21 d时,对照组与各攻毒组均存在显著差异(P<0.05)。

表4 异源副粘病毒对雏鸭血清GSH-Px活性影响
2.5 病毒感染后雏鸭血清中抗氧化酶活性与脂质过氧化程度变化趋势
在攻毒后的28 d中,每隔4 d检测雏鸭血清中抗氧化酶活性与MDA含量,以确定它们的变化趋势及相互关系,结果见图1。由图1可知,攻毒后12 d中,雏鸭血清中MDA含量呈现上升趋势,而SOD与GSH-Px的活性呈下降趋势,在12~20 d时,MDA含量明显下降,而SOD与GSH-Px呈明显上升趋势,最终达到一个平衡的状态,而CAT的活性与MDA含量变化趋势基本一致。

图1 雏鸭血清中抗氧化酶活性与MDA含量变化Fig.1 Antioxidant enzyme activity and MDA content in serum wrinkle duck
3 讨 论
自由基是一些具有不配对电子的分子、原子、离子或原子团,如·O2-、HO·、H2O2、 ONOO-、NO·等,在机体内具有较强的氧化反应能力,如不能及时清除会引起机体的损伤[14]。病毒感染机体后,由于发生氧化应激,会有大量活性氧自由基(ROS)产生,从而引起抗氧化系统的变化[15]。本研究结果表明,在攻毒初期,对照组与各攻毒组中的SOD、MDA、GSH-Px活力差异均不显著;对照组和各攻毒组之间CAT均存在极显著差异,而各攻毒组之间的CAT活力差异均不显著;这说明在雏鸭攻毒初期对CAT的活力影响较大,同时也间接反映了异源的副粘病毒对自由基的代谢产生了不同的影响,而其他三种物质活性与含量的差异不显著,可能与病毒感染初期机体的抗氧化系统没有得到激发有关。雏鸭接种病毒后,机体受到病毒的影响逐渐增加,异源副粘病毒也对各氧化物的活力产生不同的影响,同时各攻毒组之间的差异也有增加的趋势,而MDA的活力在各组之间并没有产生显著差异,或许与其自身的性质有关,如对病毒的感染不敏感等,需要进一步研究。攻毒后的28 d,机体可能产生了与之相应的免疫抗体,从而阻止了病毒对自由基代谢的继续影响。因此,异源副粘病毒对机体的抗氧化物的活力产生了明显的影响,且来源不同的病毒组之间也存在差异,而同属的鹅源与鸭源的副粘病毒对雏鸭的敏感性要强于鸡源的副粘病毒,这可能与病毒扩增的载体是鸡胚有关[16]。由于异源副粘病毒感染导致雏鸭机体内抗氧化物活性的差异,也会引起自由基代谢程度的不同。 通过对感染副粘病毒雏鸭血清中SOD、CAT、GSH-Px活性与MDA含量的测定发现,在感染后初期机体受到病毒感染,体内自由基产生过多,MDA含量增高,而抗氧化系统未被有效激发,随着感染后时间延长,机体的抗氧化系统启动,抗氧化酶活性增高,清除体内过多的自由基,MDA含量明显减少,通过图1曲线变化趋势发现,此过程中降低的MDA主要由SOD、GSH-Px活性升高所致,而CAT对MDA含量变化作用不明显,因此抗氧化系统对由于病毒感染引起自由基的清除效应具有一定的滞后性。
[1] Circu ML, Aw TY. Reactive oxygen species cellularredox systems and apoptosis[J]. Free Radical Biology & Medicine, 2010, 48:749-762.
[2] 刘倩,严玉霖,高洪,等. 病毒感染与自由基的相互作用[J]. 动物医学进展,2011,32(6):167-170.
[3] 孟婷婷,王倩,葛宝. 甘肃鼢鼠哈氏腺组织结构及其抗氧化能力[J]. 动物学杂志,2017,52(2):283-293.
[4] Chen P, Ma Q, Ji C, et a1. Dietary lipoic acid influences antioxidant capability and oxidative status of broilers [J]. Int J Mol Sci, 2011, 12:8476-8488.
[5] 陈可新,王桂英,赵志军. 低温对黑线仓鼠能量代谢、抗氧化能力和氧化应激的影响[J]. 兽类学报,2015,35(4):412-421.
[6] Ano Y, Sakudo A, Kimata T, et al. Oxidative damage to neurons caused by the induction of microglial NADPH oxidase in encephalomyocarditis virus infection[J].Neu roscience Letters, 2010, 469(1):39-43.
[7] Shaw CA, Taylor EL, Fox S, et al. Differential susceptibility to nitric oxide evoked apoptosis in human inflammatory cells[J]. Free Radic Biol Med, 2011, 50(1):93-101.
[8] 顾有方,操志锋,陈会良,等. 异源新城疫病毒感染对雏鸭组织抗氧化酶活性的影响[J]. 中国兽医学报, 2008,28(11):1247-1250.
[9] Sirelkhatim A, Mahmud S, Seeni A, et al. Review on zinc oxide anoparticles:Antibacterial activity and toxicity mechanism[J]. NanoMicro Letters, 2015, 7(3):219-242.
[10] Wang D, Zhao Y, Jiao Y, et al. Antioxidative and hepatoprotective effects of the polysaccharides fromZizyphusjujubecv.Shaanbeitanzao[J]. Carbohydrate Polymers, 2012, 88(4):1453-1459.
[11] 赵宝路. 自由基、营养、天然抗氧化剂与衰老[J].生物物理学报,2010,26(1):26-36.
[12] 田卫军,刘宽辉,高珍珍,等. 多糖-硒化多糖复方抗氧化活性的比较[J]. 畜牧兽医学报,2017,48(2):359-368.
[13] 阿燕. 真菌多糖抗氧化活性的研究进展[J]. 微生物学杂志,2012,32(4):83-86.
[14] Kaya H, Aydin F, Gürkan M, et al. Effects of zinc oxide nanoparticles on bioaccumulation and oxidative stress in different organs of tilapia(Oreochromisniloticus)[J]. Environmental Toxicology and Pharmacology, 2015, 40(3):936-947.
[15] Chang YY, Yang DJ, Chiu CH, et al. Antioxidative and anti-inflammatory effects of polyphenol rich litchi(LitchichinensisSonn.) flower water extract on livers of high fat diet fed hamsters[J]. Journal of Functional Foods, 2013, 5(1):44-52.
[16] Kaya H, Aydin F, Gürkan M, et al. A comparative toxicity study between small and large size zinc oxide nanoparticles in tilapia(Oreochromisniloticus):Organ pathologies,Osmoregulato-ry responses and immunological parameters[J]. Chemosphere, 2016, 144:571-582.
