戊糖乳杆菌发酵培养基氮源条件的优化
2018-03-21安慧莹白凤武任剑刚
安慧莹, 白凤武,2, 任剑刚*
(1.大连理工大学 生命科学与技术学院,辽宁 大连 116023;2.上海交通大学 生命科学技术学院,上海 200240)
乳酸应用十分广泛,已经被美国食品药品监督管理局批准为GRAS[1](大众安全健康食品);由于乳酸具有抗氧化、保湿、杀菌[2]等功效,也备受化妆品行业的青睐;尤其是生物可降解材料聚乳酸[3-4]的需求更是大力推动了乳酸的生产。近年来乳酸的需求量不断增长,预计在2020年将超过百万吨[5]。目前乳酸发酵还在大量使用淀粉和精制的糖类为碳源,这些原料与人类所需食品供应链形成竞争且成本高昂[6],以农业秸秆为主的木质纤维素为原料的生产已经被提上日程。木质纤维素经水解可以得到大量的葡萄糖、木糖等[7]碳源,但能直接利用木糖进行代谢的微生物还比较少,因此选择能够利用木糖生产乳酸的菌株具有十分重要的意义。乳酸菌通常需要在含有丰富营养物成分的培养基中才能生长[8-9]。乳酸菌发酵常用的MRS培养基[10]成分非常复杂,仅氮源就有4种,而氮源又是培养基成本中占比最高的成分[11],尤其更适合细菌生长的酪蛋白胨,价格甚至比其他有机氮源都高得多。简化氮源成分,减少氮源用量,选择廉价的氮源[12]都是改善乳酸生产的重要方面。玉米浆是玉米淀粉加工工业的副产物,含有丰富的氨基酸、多肽和维生素[13],适合于大多数微生物生长。Rivas等[14]、Liu等[15]都曾把玉米浆作为替代的有机氮源进行乳酸发酵,并得到了良好效果。本研究以实验室前期自行筛选得到的一株能利用木糖为碳源生产乳酸的戊糖乳杆菌为出发菌株,通过单因素实验比较不同氮源对戊糖乳酸杆菌的发酵影响,利用响应面方法优化所选有机氮源与柠檬酸氢二铵的比例,来代替原来培养基配方中的氮源组成,以期优化发酵培养基中的氮源,简化氮源种类,降低生产成本。
1 材料与方法
1.1 材料
1.1.1 实验菌种 戊糖乳杆菌(LactobacilluspentosusDLL8),为大连理工大学生物过程工程课题组从酸菜中分离,经诱变并保存的一株可代谢木糖的乳酸发酵菌株。
1.1.2 培养基(MRS培养基,g/L) 种子培养基:木糖20,牛肉膏10,酵母粉5,酪蛋白胨10,柠檬酸氢二铵2,磷酸氢二钾2,乙酸钠5,硫酸镁 0.1,一水合硫酸锰0.05,吐温-80 1;发酵培养基:木糖50,牛肉膏10,酵母粉5,酪蛋白胨10,柠檬酸氢二铵2,磷酸氢二钾2,乙酸钠5,硫酸镁0.1,一水合硫酸锰0.05,吐温-80 1,碳酸钙50。
1.1.3 主要试剂 木糖、牛肉膏、酪蛋白胨、酵母粉、柠檬酸氢二铵、乙酸钠、吐温-80、磷酸氢二钾、硫酸镁、一水合硫酸锰、碳酸钙均购自大连博诺生物化学试剂工厂。
1.2 方法
1.2.1 培养方法 将-80 ℃保存的戊糖乳杆菌接种于种子培养基中37 ℃静置培养24 h,将种子液以体积分数1%的接种量接到装有100 mL液体发酵培养基的250 mL三角瓶中,37 ℃静置培养。
1.2.2 木糖及乳酸含量测定[16]取发酵液离心后的上清液稀释,利用高效液相色谱分析发酵液中木糖及乳酸的含量。
1.2.3 单因素试验设计 计算发酵培养基中所有氮源的总氮量,分别换算成单一的牛肉膏、酵母粉、酪蛋白胨、柠檬酸氢二铵和玉米浆,在其他条件不变的前提下进行发酵。
1.2.4 响应面优化试验设计 选用单因素试验中效果最好的有机氮源与柠檬酸氢二铵进行优化,由于玉米浆是比较廉价的有机氮源,所以根据单一玉米浆发酵的效果,把玉米浆作为一个优化因素并选择合适的复合条件进行优化。利用Expert-Design软件进行实验设计,以乳酸产量作为响应值建立响应面模型。
2 结果与分析
2.1 不同氮源对乳酸发酵的影响
不同氮源的含氮量有着较大差别,乳酸菌发酵所用的MRS培养基中包括3种有机氮源和1种无机氮源,本研究选用这4种氮源加上廉价易得的玉米浆按照MRS培养基中的总氮量3.198 g/L 进行相应比例的换算,具体氮源的含氮量[17]及单一氮源的用量见表1。
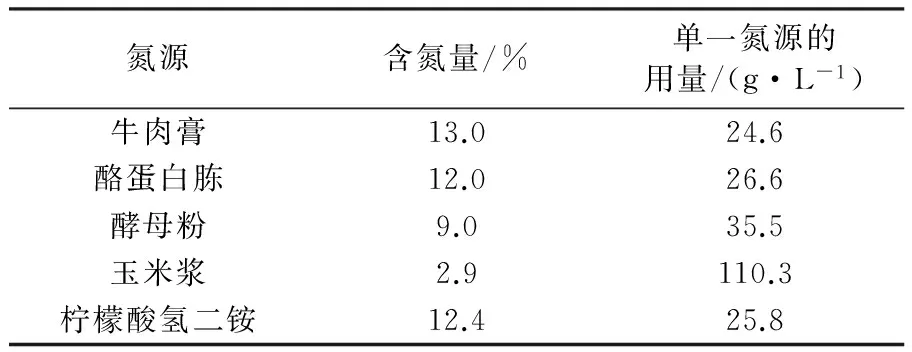
表1 不同氮源的含氮量及单一氮源的用量
用不同的氮源进行乳酸发酵,菌体对不同氮源表现出较高的选择性。如图1所示,以牛肉膏为氮源时乳酸的产量最高,甚至高于正常MRS培养基(37.58 g/L);酵母粉为氮源的乳酸产量基本与MRS培养基一致,没有牛肉膏高,但是对木糖的利用速率很快,在第2天木糖就几乎消耗完全;酪蛋白胨为氮源时乳酸产量较低;玉米浆为氮源时代谢速率过慢,当其他氮源都已经发酵结束,玉米浆仍在缓慢的发酵中;以柠檬酸氢二铵作为唯一氮源时,菌体无法利用单一的无机氮源,不能代谢木糖也没有乳酸产生。
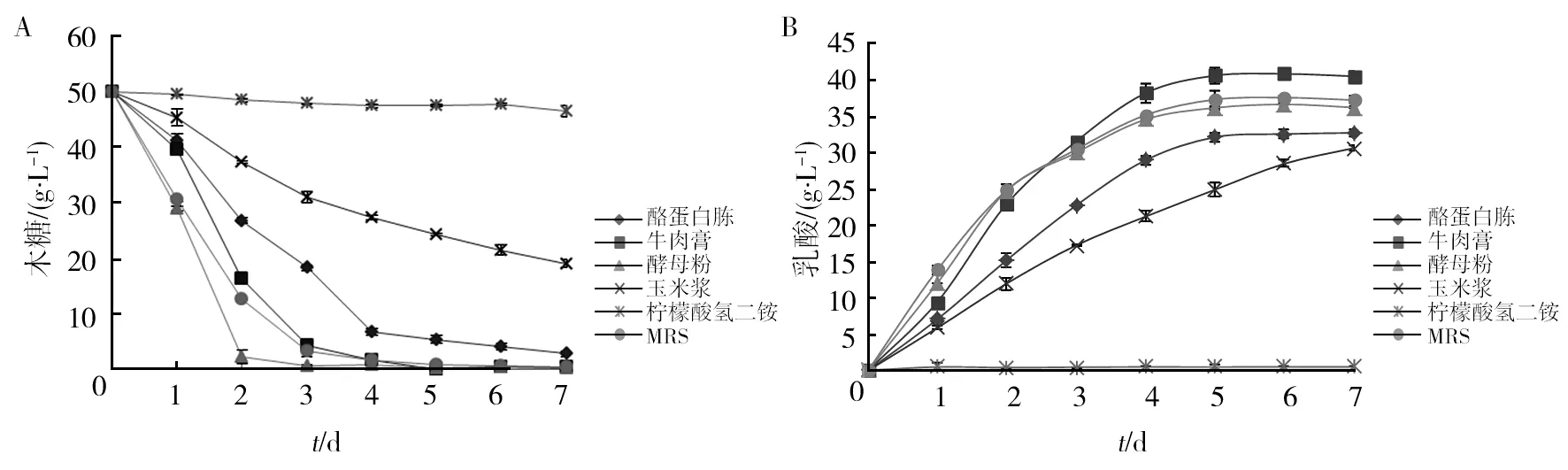
图1 不同氮源条件下对木糖消耗(A)及乳酸产量(B)的影响Fig.1 Effect of different nitrogen source on xylose consumption (A) and lactic acid production (B)
2.2 牛肉膏与柠檬酸氢二铵复合条件的优化
虽然单一的无机氮源无法进行乳酸生产,但一般复合氮源能够为微生物提高充足营养,更有利于微生物生长[18]。况且柠檬酸氢二铵本身用量不多且价格不高,所以实验中将其保留。选择柠檬酸氢二铵与单因素实验中效果最好的牛肉膏两个变量,利用Design-Expert软件采用中心组合法进行设计,每个因素取5个水平(表2)。
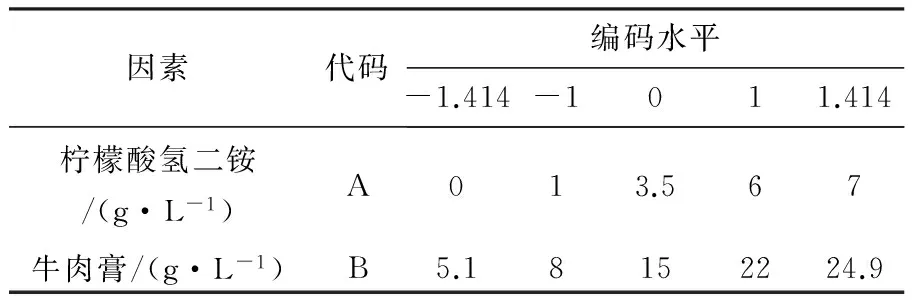
表2 中心组合实验因素及编码水平
实验设计及结果见表3,以乳酸产量(Y)为响应值,对实验结果进行方差分析,得到的回归方程为Y=41.83-0.63A+0.93B-3.19AB-1.47A2-3.81B2。对该模型进行方差分析(表4),B对乳酸产量有直接影响(P<0.05),虽然A对乳酸产量的影响不十分明显(P=0.089 4),但A、B有着显著的交互作用(P=0.000 2),且A、B二次项上的显著性表明二者均为乳酸发酵的限制性因素。回归模型在99.99%的水平上极显著(P<0.000 1),失拟项不显著(P=0.142 2),说明实验数据与模型相符,可信度高。复相关系数的平方R2=0.965 2,说明96.52%乳酸产量的变化可以用该模型解释。

表3 中心组合实验设计及结果

表4 响应面模型的方差分析
回归方程可以提供分析图,两个因素柠檬酸氢二铵和牛肉膏相拟合的等高线图和响应面图如图2所示。凸形的响应面表明存在明确的最佳变量,而等高线可以推断出因素之间的交互作用,椭圆形等高线证明因素之间存在交互作用[19]。从图2中可以看出模型存在稳定的极大值点,对模型进行分析,得到最高的乳酸产量所对应的因素水平为柠檬酸氢二铵1.91 g/L,牛肉膏17.72 g/L,预测最大乳酸产量为42.21 g/L。
2.3 玉米浆、酵母粉与柠檬酸氢二铵复合条件优化
玉米浆作为一种廉价的氮源可以降低发酵成本,但以其作为氮源时发酵速度较慢,而酵母粉对木糖的代谢速率很快,所以将它们组合以期得到更好的效果。Box-Behnken设计方法只能针对三因素以上的实验设计,两因素的实验设计采用中心组合法,但Box-Behnken法设计的实验次数较中心组合法少[20-21],更加简单方便,故此实验采用Box-Behnken设计方法,各因素水平如表5所示。
实验设计及结果见表6,以乳酸产量(Y)为响应值,对实验结果进行方差分析,得到回归方程:Y=41.27+2.20A-0.18B+0.39C+0.19AB+0.59AC-0.97BC-2.35A2-1.19B2-2.03C2。

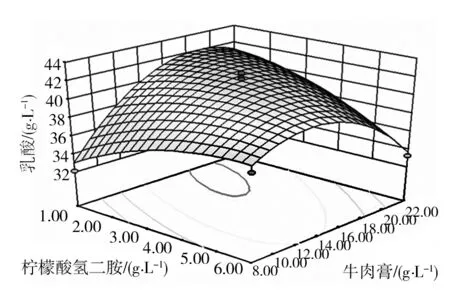
图2 柠檬酸氢二铵和牛肉膏交互作用 对乳酸产量的影响Fig.2 Effect of interaction between ammonium hydrogen citrate and beef extract on lactic acid production
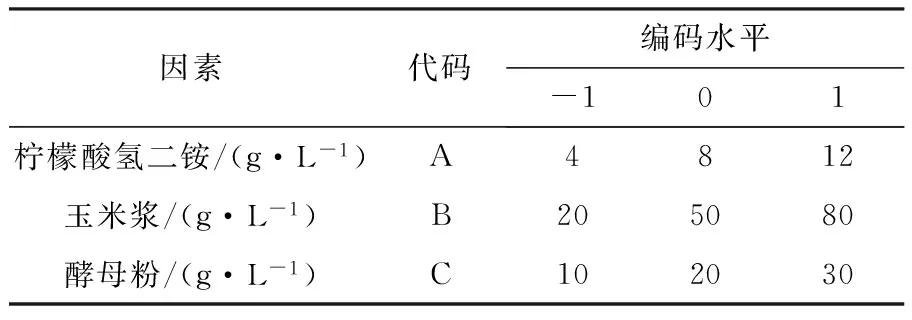
因素代码编码水平-101柠檬酸氢二铵/(g·L-1)A4812玉米浆/(g·L-1)B205080酵母粉/(g·L-1)C102030
对该模型进行方差分析,表7表明各因素对乳酸产量的影响极显著(P<0.000 1)。一次项、平方项、交叉项均对响应值有显著影响,其中柠檬酸氢二铵和酵母粉的显著性高于玉米浆,且柠檬酸氢二铵与玉米浆的交互作用(P=0.333 4)弱于其他二者。失拟项不显著(P=0.079 8),说明实验数据与模型相符,可信度高。复相关系数的平方R2=0.989 9说明98.99%乳酸产量的变化可以用该模型解释。
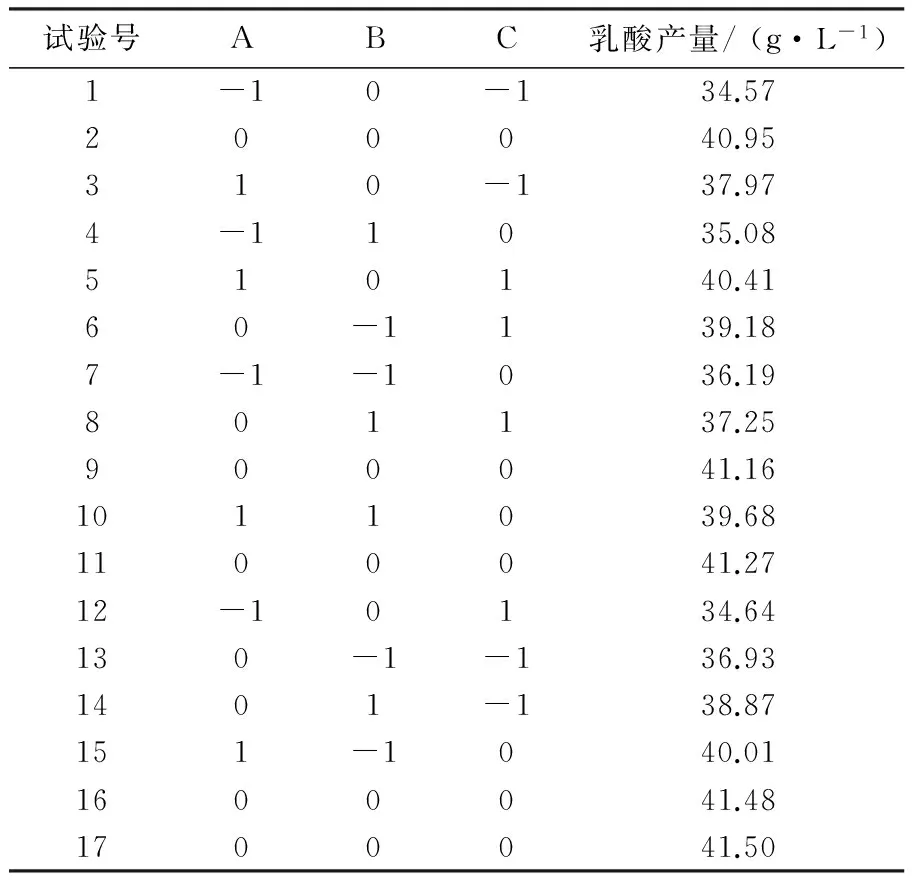
表6 Box-Behnken实验设计及结果

表7 响应面模型的方差分析

续表7
通过回归方程得到的等高线图和响应面立体分析图见图3、图4、图5。每个不同的响应面和等高线图都代表着不同的两个因素之间的相互作用。椭圆的等高线表明每两个因素间都存在交互作用,响应面呈凸形表明存在稳定的极大值点。对模型进行分析,得到最高的乳酸产量所对应的因素水平:柠檬酸氢二铵9.95 g/L,玉米浆46.54 g/L,酵母粉21.95 g/L,预测最大乳酸产量为41.86 g/L。

图3 柠檬酸氢二铵和玉米浆交互作用对乳酸产量的影响Fig.3 Effect of interaction between ammonium hydrogen citrate and corn steep liquor on lactic acid production

图4 柠檬酸氢二铵和酵母粉交互作用对乳酸产量的影响Fig.4 Effect of interaction between ammonium hydrogen citrate and yeast extract on lactic acid production

图5 玉米浆和酵母粉交互作用对乳酸产量的影响Fig.5 Effect of interaction between corn steep liquor and yeast extract on lactic acid production
2.4 优化条件下乳酸产量的验证
按照优化好的氮源组成配制培养基进行乳酸发酵实验,得到的结果如图6、图7所示。牛肉膏和柠檬酸氢二铵的组合最终得到乳酸42.37 g/L,与预测结果基本一致,表明该组合可以用于培养基中氮源的优化。未经优化的MRS培养基三种有机氮源总量为25 g/L,得到乳酸产量37.58 g/L,代谢副产物乙酸产量16.47 g/L。经过优化后的乳酸产量比优化前高12.7%,有机氮源种类及用量大大减少,只有单一有机氮源牛肉膏用量为17.71 g/L,氮源绝对质量减少了29.16%,不仅提高了乳酸产量,而且简化了操作,节约了成本。
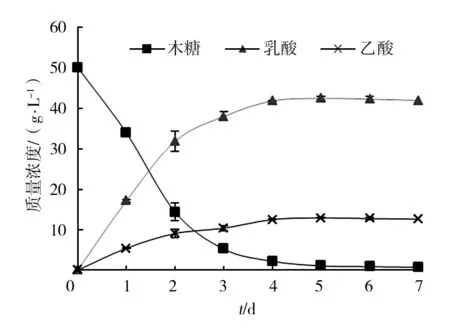
图6 牛肉膏和柠檬酸氢二铵为氮源时 最优条件下的发酵曲线Fig.6 Fermentation curve of nitrogen source of beef extract and ammonium hydrogen citrate under optimum conditions
玉米浆、酵母粉和柠檬酸氢二铵的组合最终得到乳酸41.06 g/L,比预测结果低1.67%,与预测结果基本一致,表明此法用于优化培养基中的氮源是可行的。优化后的乳酸产量比MRS培养基37.58 g/L的乳酸产量提高了9.26%,且发酵速率比单一玉米浆显著提高,解决了玉米浆代谢速率过慢的问题。虽然与上一组合相比剩余的残糖量略高,但代谢副产物乙酸的产量仅为7.76 g/L,比上一组合的12.92 g/L显著降低。玉米浆的使用代替了一部分高成本的有机氮源,减少了生产成本,也为以后更好地利用玉米浆进行乳酸发酵奠定了基础。 但氮源绝对总量大量增加,会增加培养基中的多肽、蛋白等大分子物质,对一些常用的乳酸分离方法如吸附法、膜分离法等造成一定影响,是此种组合方法的弊端,也是以后有待改进的地方。
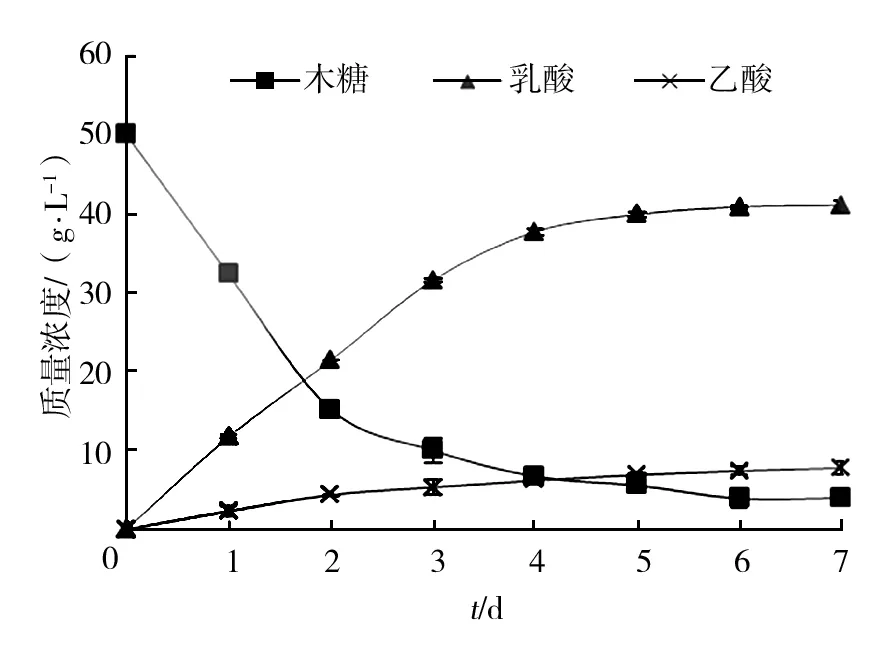
图7 玉米浆、酵母粉和柠檬酸氢二铵为 氮源时最优条件下的发酵曲线Fig.7 Fermentation curve of nitrogen source of corn steep liquor, yeast extract and ammonium hydrogen citrate under optimum conditions
3 讨 论
随着以乳酸为基质的生物材料代替化工合成产品的广泛应用,提高乳酸的产量日益成为研究的热点。目前研究学者主要通过改善氮源、分子改造、优化培养条件来提高乳酸产量[22-24]。乳酸的生产过程中优化培养条件的方法被广泛应用,而利用响应面方法优化培养条件是目前比较流行的一种微生物发酵优化手段[25]。孙骏飞等[26]利用麸皮的蛋白酶水解液和纤维素酶水解液替代葡萄糖和酵母粉发酵制备D-乳酸,不仅提高乳酸产量,同时还降低了发酵的生产成本。李秀康等[27]利用响应面优化方法对L-乳酸发酵培养基进行优化,优化后的培养基氮源和碳源为葡萄糖148 g/L、酵母膏12.4 g/L条件下L-乳酸产量达到134.7 g/L,比优化前提高24.3%。
本研究通过单因素实验比较不同氮源对戊糖乳酸杆菌的发酵影响,利用响应面方法优化所选有机氮源与柠檬酸氢二铵的比例,得到两组优化的氮源组合。牛肉膏和柠檬酸氢二铵的组合能够使乳酸产量最高,达到42.37 g/L,比优化前乳酸产量提高12.7%,与MRS培养基比较明显减少了氮源的物质种类,简化了培养基的配方。玉米浆、酵母粉和柠檬酸氢二铵组合比牛肉膏和柠檬酸氢二铵组合乳酸产量略低,达到41.06 g/L,但代谢副产物较少。这两个组合都在一定程度上减少了昂贵有机氮源的用量,极大地降低了乳酸生产成本,提高了经济可行性,为以后该戊糖乳杆菌大规模工业生产发酵培养提供参考。
[1] Upadhyaya BP, DeVeaux LC, Christopher LP. Metabolic engineering as a tool for enhanced lactic acid production[J]. Trends in biotechnology, 2014, 32(12): 637-644.
[2] Martinez FAC, Balciunas EM, Salgado JM, et al. Lactic acid properties, applications and production: a review[J]. Trends in food science & technology, 2013, 30(1): 70-83.
[3] Maharana T, Pattanaik S, Routaray A, et al. Synthesis and characterization of poly (lactic acid) based graft copolymers[J]. Reactive and Functional Polymers, 2015, 93: 47-67.
[4] Lasprilla AJR, Martinez GAR, Lunelli BH, et al. Poly-lactic acid synthesis for application in biomedical devices-A review[J]. Biotechnology advances, 2012, 30(1): 321-328.
[5] Christopher LP, Kapatral V, Vaisvil B, et al. Draft genome sequence of a new homofermentative, lactic acid-producing Enterococcus faecalis isolate, CBRD01[J]. Genome announcements, 2014, 2(2): e00147-14.
[6] Abdel-Rahman MA, Tashiro Y, Sonomoto K. Lactic acid production from lignocellulose-derived sugars using lactic acid bacteria: overview and limits[J]. Journal of biotechnology, 2011, 156(4): 286-301.
[7] Jordan DB, Bowman MJ, Braker JD, et al. Plant cell walls to ethanol[J]. Biochemical Journal, 2012, 442(2): 241-252.
[8] Vázquez JA, González MP, Murado MA. A new marine medium: use of different fish peptones and comparative study of the growth of selected species of marine bacteria[J]. Enzyme and Microbial Technology, 2004, 35(5): 385-392.
[9] Aspmo SI, Horn SJ, Eijsink VGH. Use of hydrolysates from Atlantic cod (Gadus morhua L.) viscera as a complex nitrogen source for lactic acid bacteria[J]. FEMS Microbiology Letters, 2005, 248(1): 65-68.
[10] De Man JC, Rogosa M, Sharpe ME. A medium for the cultivation of lactobacilli[J]. Journal of applied Bacteriology, 1960, 23(1): 130-135.
[11] Safari R, Motamedzadegan A, Ovissipour M, et al. Use of hydrolysates from yellowfin tuna (Thunnus albacares) heads as a complex nitrogen source for lactic acid bacteria[J]. Food and Bioprocess Technology, 2012, 5(1): 73-79.
[12] Abdel-Rahman MA, Tashiro Y, Sonomoto K. Recent advances in lactic acid production by microbial fermentation processes[J]. Biotechnology Advances, 2013, 31(6): 877-902.
[13] Cardinal EV, Hedrick LR. Microbiological assay of corn steep liquor for amino acid content[J]. Journal of Biological Chemistry, 1948, 172(2): 609-612.
[14] Rivas B, Moldes AB, Domínguez JM, et al. Development of culture media containing spent yeast cells of Debaryomyces hansenii and corn steep liquor for lactic acid production withLactobacillusrhamnosus[J]. International journal of food microbiology, 2004, 97(1): 93.
[15] Liu B, Yang M, Qi B, et al. Optimizing L-(+)-lactic acid production by thermophileLactobacillusplantarumAs. 1.3 using alternative nitrogen sources with response surface method[J]. Biochemical Engineering Journal, 2010, 52(2): 212-219.
[16] 白冬梅, 赵学名, 胡宗定. 高效液相色谱手性流动相添加剂分离乳酸对映体[J]. 分析化学, 2001, 29(4): 413-415.
[17] 于雷, 雷霆, 裴晓林, 等. L-乳酸发酵培养基中氮源的优化[J]. 食品科技, 2007, 32(6): 49-53.
[18] 杨学昊, 尹春华, 傅四周, 等. 根霉脂肪酶发酵优化和酶性质的研究[J]. 中国油脂, 2004, 29(7): 29-32.
[19] Yu L, Lei T, Ren X, et al. Response surface optimization of l-(+)-lactic acid production using corn steep liquor as an alternative nitrogen source byLactobacillusrhamnosusCGMCC 1466[J]. Biochemical Engineering Journal, 2008, 39(3): 496-502.
[20] Khuri AI, Mukhopadhyay S. Response surface methodology[J]. Wiley Interdisciplinary Reviews: Computational Statistics, 2010, 2(2): 128-149.
[21] Bezerra MA, Santelli RE, Oliveira EP, et al. Response surface methodology (RSM) as a tool for optimization in analytical chemistry[J]. Talanta, 2008, 76(5): 965-977.
[22] 田康明, 周丽, 陈献忠, 等. L-乳酸的发酵生产和聚L-乳酸的化学加工[J]. 中国生物工程杂志, 2011, 31(2): 102-115.
[23] 姜旭, 王丽敏, 张桂敏, 等. 基因工程菌发酵生产L-乳酸研究进展[J]. 生物工程学报, 2013, 29(10): 1398-1410.
[24] 闫智慧, 高静, 周丽亚, 等. 乳酸的应用与发酵生产工艺[J]. 河北工业大学学报, 2004, 33(3): 15-19.
[25] Blanco AS, Durive OP, Pérez S B, et al. Simultaneous production of amylases and proteases byBacillussubtilisin brewery wastes[J]. Brazilian Journal of Microbiology, 2016, 47(3): 665-674.
[26] 孙骏飞,周成,何冰芳,等. 菊糖芽孢乳杆菌利用麸皮水解液发酵生产D-乳酸[J]. 生物加工过程,2017,(1): 1-7.
[27] 李秀康,徐慧,刘建军. 产高光学纯度L-乳酸菌株HY-38发酵培养基优化[J]. 中国酿造,2017,(2): 30-34.
