双重PCR方法检测检疫性细菌洋葱腐烂病菌和菊基腐病菌
2018-03-21杨万风陆辰晨邵沛泽谌运清赵文军
杨万风,刘 艳,陆辰晨,邵沛泽,谌运清,赵文军
(1.连云港出入境检验检疫局,江苏 连云港 222042; 2.连云港市农业科学院,江苏 连云港 222001; 3.中国检验检疫科学研究院,北京 100029)
菊基腐病菌[1](Erwiniachrysanthemi)和洋葱腐烂病菌[2-3](Burkholderiagladiolipv.alliicola)是引起郁金香软腐病的重要细菌。这2种病原菌因其在国外发生分布广、定殖风险高、经济危害大,已被中国出入境机构列为进境植物检疫性有害生物。近年来,国内花卉消费快速增长,我国进口郁金香种球呈逐年增长态势。国外郁金香主产国多数是这2种病菌的疫区,因此这2种病菌随进口郁金香种球传入我国的风险较大。目前,国内种苗指定口岸对细菌的检测多数仍采用传统的分离培养和生化鉴定方法,鉴定时间较长,影响快速通关。因而,建立快速实用、准确灵敏、操作简便的分子检测技术对控制病菌的传入具有重要意义。
目前,对这2种细菌的分子检测技术已有不少报道。国内外不少学者已初步建立了洋葱腐烂病菌的常规PCR检测方法[2-4]。Lee等[5]运用RFLP和PFGE方法分析了台湾的菊基腐病菌;刘鹏等[6]设计了专化性引物,鉴定了菊基腐病菌。但是上述研究均只检测1种细菌,同步检测上述2种细菌的分子检测方法还未见报道。双重PCR技术可在1次反应中同时检测2种病菌,大幅节约检测时间,提高检测效率,降低检测成本。目前,该技术在植物病原物的检测应用中比较广泛[7-10]。
本研究根据洋葱腐烂病菌核糖体基因ITS序列设计特异性引物,与已发表的菊基腐病菌的专化性引物组合成双重PCR体系,对洋葱腐烂病菌和菊基腐病菌进行同步检测,以期提高种苗指定口岸检疫性细菌疫情检出率。
1 材料与方法
1.1 供试菌株
供试的洋葱腐烂病菌、菊基腐病菌及其相关细菌菌株见表1。
1.2 试剂、耗材及仪器
2×TaqMaster Mix和细菌基因组提取试剂盒购自上海捷瑞生物公司,DNA Marker购自大连宝生物公司。研究所用仪器包括PCR仪(ABI)、分光光度计(Biochrom)、高速离心机(Eppendorf)、凝胶成像系统(UVP)等。
1.3 引物序列
根据GenBank上发表的洋葱腐烂病菌核糖体基因ITS序列保守区域(GenBank登录号为KU507041.1),通过比较同属其他细菌的保守序列和差异区域,运用Primer premier5.0软件设计1对引物B3/B6,扩增片段长度为208 bp,引物由南京思普金生物科技有限公司合成,序列见表2。
1.4 引物B3/B6的PCR反应
PCR反应体系为25 μL∶2×TaqMaster Mix 12.5 μL,引物B3/B6 (20 μmol·L-1)各0.25 μL,模板0.5 μL,补足双蒸水至25 μL。反应程序为:94 ℃ 3 min;94 ℃ 30 s,66 ℃ 20 s,72 ℃ 30 s,30个循环;最后72 ℃延伸5 min。产物电泳检测后在凝胶成像系统上拍照。
1.5 引物B3/B6特异性检测
将参试的细菌菌株培养到对数期,利用试剂盒提取基因组,以引物B3/B6分别扩增各参试菌株,无菌水作阴性对照,PCR反应条件同1.4节。试验重复3次。
1.6 引物B3/B6灵敏度检测
将洋葱腐烂病菌NCPPB 948振荡培养后提取基因组,利用分光光度计测定基因组浓度,然后以无菌水对基因组进行10倍梯度稀释,以稀释后的梯度浓度基因组作为模板进行PCR反应,并分析其灵敏度。试验重复3次。
1.7 双重PCR检测
1.7.1 双重PCR反应体系的建立
利用设计的洋葱腐烂病菌特异性引物B3/B6同文献[1]公布的菊基腐病菌特异性引物ADE1/ADE2结合,建立双重PCR体系。ADE1/ADE2的序列见表2,该引物可对菊基腐病菌特异性扩增出1条420 bp的条带。
双重PCR反应条件优化:以2种病菌的基因组DNA为模板,设计60~67 ℃ 8种不同的退火温度(梯度1 ℃)、0.1~0.5 μL 5种不同梯度的引物量(20 μmol·L-1)、25~40次4种不同循环次数(梯度5次)进行扩增。
双重PCR反应体系为25 μL∶2×TaqMaster Mix 12.5 μL,2对引物(20 μmol·L-1) 0.3 μL,模板0.5 μL,补足双蒸水至25 μL。反应程序为:94 ℃ 3 min;94 ℃ 30 s,66 ℃退火20 s,72 ℃ 40 s,30个循环;最后72 ℃延伸5 min。产物电泳检测后在凝胶成像系统上拍照。实验重复3次。
1.7.2 双重PCR特异性检测
表1供试菌株
Table1Bacterial strains tested
编号No.菌株Strain菌株代号NamePCR产物PCRproducts引物B3/B6PrimerB3/B6引物B3/B6和ADE1/ADE2PrimerB3/B6andADE1/ADE21Burkholderiagladiolipv.alliicolaNCPPB948++2B.gladiolipv.alliicolaLMG2121++3B.gladiolipv.alliicolaLMG6915++4ErwiniachrysanthemiICMP10850-+5E.chrysanthemiNCPPB2309-+6E.chrysanthemiATCC11662-+7B.gladiolipv.gladioliLMG2216--8B.gladiolipv.agaricicolaNCPPB3580--9B.caryophylliICMP512--10B.andropogonisLMG2129--11B.cepaciaLMG1222--12B.glumaeATCC33617--13B.plantariiDSM9510--14B.ambifariaNCPPB4421--15B.multivoransNCPPB4234--16B.phenaziniumLMG2247--17B.stabilisNCPPB4238--18E.carotovorasubsp.carotovoraECC--19CurtobacteriumpusillumNCPPB4113--20C.flaccumfacienspv.oortiiATCC25283--21C.flaccumfacienspv.flaccumfaciensLMG5473--22Pseudomonassyringaepv.syringaePSS--23P.syringaepv.glycineaATCC8727--24RalstoniasolanacearumRS--25Clavibactermichiganensissubsp.michiganensisATCC14456--26EscherichiacoliBL21--27Xanthomonasaxonopodispv.vignicolaATCC11648--28X.campestrispv.campestrisXCC--29X.oryzaepv.oryzaePXO99--30X.oryzaepv.oryzicolaRSGD42--31X.fragariaeXF--32Leucobactersp.P6--33Kocuriasp.P7--34Enterococcussp.P8--
+, 检测到PCR产物;-,未检测到PCR产物。
+, expected PCR products; -, no expected PCR products.
表2引物序列
Table2Nucleotide sequences of primers used in this study

引物Primer引物序列(5′⁃3′)Sequences产物大小PCRproduct/bp来源SourceB3TGGCGGTAGAAACCTGAGAG208GenBankaccessionNo.KU5070411B6ACGACAGCCGATAAGCACACTADE1GATCAGAAAGCCCGCAGCCAGAT420Reference[1]ADE2CTGTGGCCGATCAGGATGGTTTTGTCGTGC
以供试菌株的基因组DNA为模板,利用已建立的双重PCR反应体系,检测双重PCR反应体系的特异性。同时以洋葱腐烂病菌NCPPB 948和菊基腐病菌ICMP 10850的混合DNA为模板,进行双重PCR检测。产物电泳检测后在凝胶成像系统上拍照。
1.7.3 双重PCR灵敏性检测
利用试剂盒提取洋葱腐烂病菌NCPPB 948和菊基腐病菌ICMP 10850基因组DNA,并以分光光度计测其浓度,分别用无菌水调整其至1.0×102ng·μL-1,以混合DNA作模板,检测双重PCR的灵敏度。产物电泳检测后在凝胶成像系统上拍照。
1.8 带菌样品的检测
将洋葱腐烂病菌NCPPB 948和菊基腐病菌ICMP 10850在培养基上28 ℃培养24 h后用无菌水制成1.0×108cfu·mL-1的菌悬液,用接种针直接蘸取菌悬液后刺穿郁金香种苗叶片进行接种。1~3 d后收集发病区域的叶面。用试剂盒提取植物全基因组DNA后进行双重PCR反应,以接种无菌水的叶片DNA作为阴性对照。
2 结果与分析
2.1 引物B3/B6常规PCR特异性检测
用试剂盒分别提取洋葱腐烂病菌和其他参试菌株的基因组DNA,进行常规PCR扩增反应,以验证设计的引物B3/B6的特异性。结果显示,只有3株洋葱腐烂病菌扩增出了208 bp的预期产物,而其他参试菌株均未扩增出相应的条带(表1)。
2.2 引物B3/B6常规PCR灵敏度检测
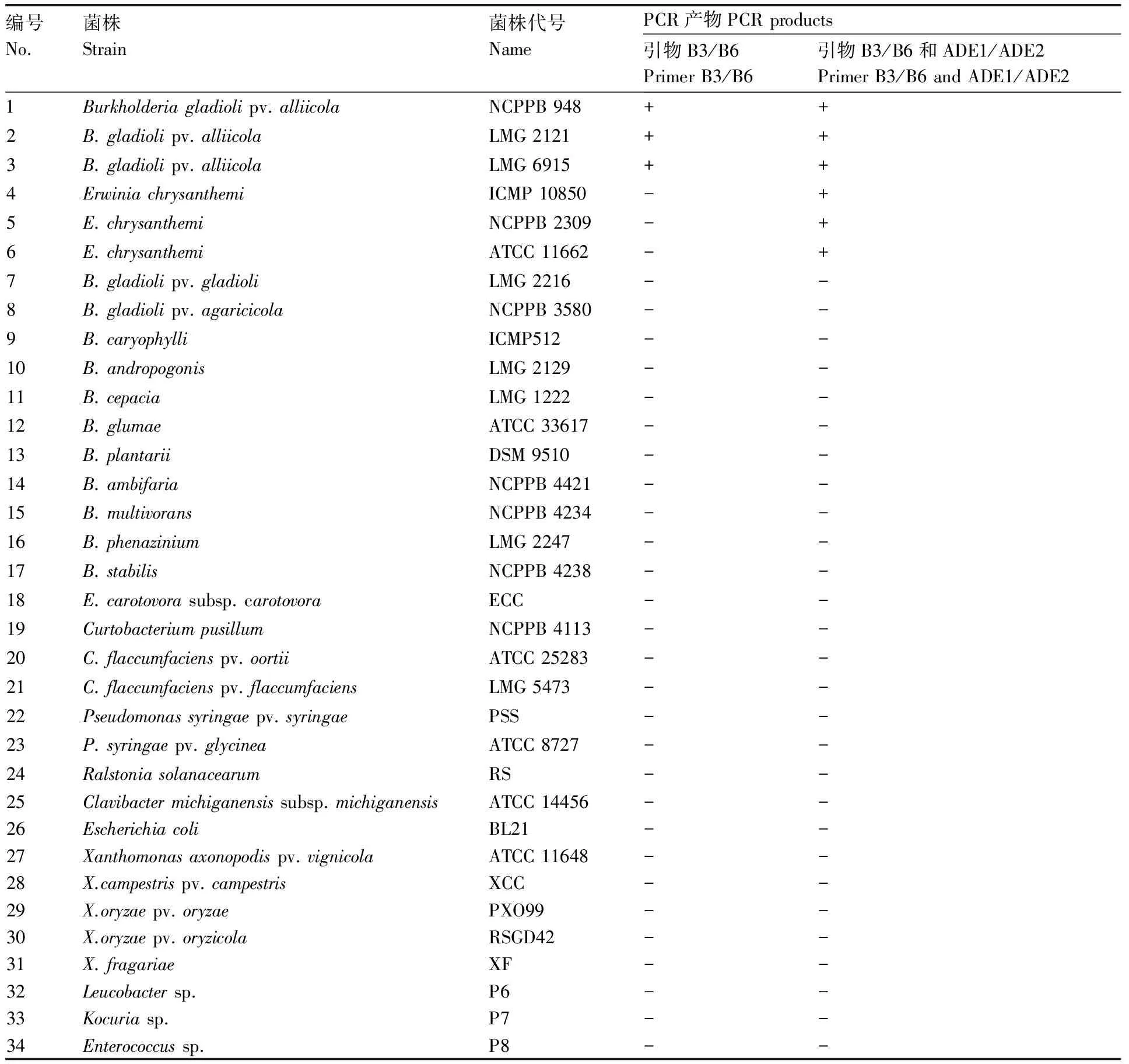
提取洋葱腐烂病菌NCPPB 948的DNA,分光光度计测出其浓度为1.684×102ng·μL-1,将其10倍等比梯度稀释后进行常规PCR。结果显示,随着DNA模板浓度的递减,PCR产物量明显减少。当DNA稀释到1.684×10-2ng·μL-1时,无法检测到扩增产物(图1)。

M, DNA marker (DL2000); 1, 2, 3, 4, 5, 6, 7:分别表示DNA 浓度为: 1.684×102, 1.684×101, 1.684×100, 1.684×10-1, 1.684×10-2, 1.684×10-3, 1.684×10-4 ng·μL-1.M, DNA marker(DL2000); 1, 2, 3, 4, 5, 6, 7: DNA concentrations 1.684×102, 1.684×101, 1.684×100, 1.684×10-1, 1.684×10-2, 1.684×10-3, 1.684×10-4 ng·μL-1, respectively.图1 引物B3/B6灵敏度检测结果Fig.1 Sensitivity of PCR for primers B3/B6 to detect serially diluted genomic DNA
2.3 双重PCR反应体系的建立
设计不同的退火温度、引物量、循环次数,对双重PCR反应条件进行优化,综合考虑检测时间、非特异性条带和引物二聚体、检测成本,经过筛选,退火温度为66 ℃、循环次数30次,引物各0.3 μL时为最佳反应体系。
2.4 双重PCR特异性检测结果
应用双重PCR反应体系,以洋葱腐烂病菌和菊基腐病菌的混合DNA作为模板,能同时观察到208 bp 和420 bp的2条目的条带(结果未显示),并且无非特异性条带和引物二聚体形成;利用双重PCR反应体系扩增表1中各参试菌株时,3株洋葱腐烂病菌产生208 bp的目的条带,3株菊基腐病菌产生420 bp的目的条带,其余参试菌株未扩增出特异性条带。
2.5 双重PCR灵敏度检测结果
PCR扩增浓度为1.0×102ng·μL-1病菌混合DNA的10倍梯度稀释模板,验证双重PCR体系的灵敏度。结果表明,当DNA浓度达到1.0×10-1ng·μL-1时仍可检测到信号(图2)。
2.6 带菌样品的检测结果
用菌液人工接种郁金香叶片,提取发病组织的总DNA后进行双重PCR检测,结果表明,运用该方法可同时检测到2种病原菌,产生2种病原菌目的条带;而健康组织的阴性对照则未扩增到相应的信号(图3)。
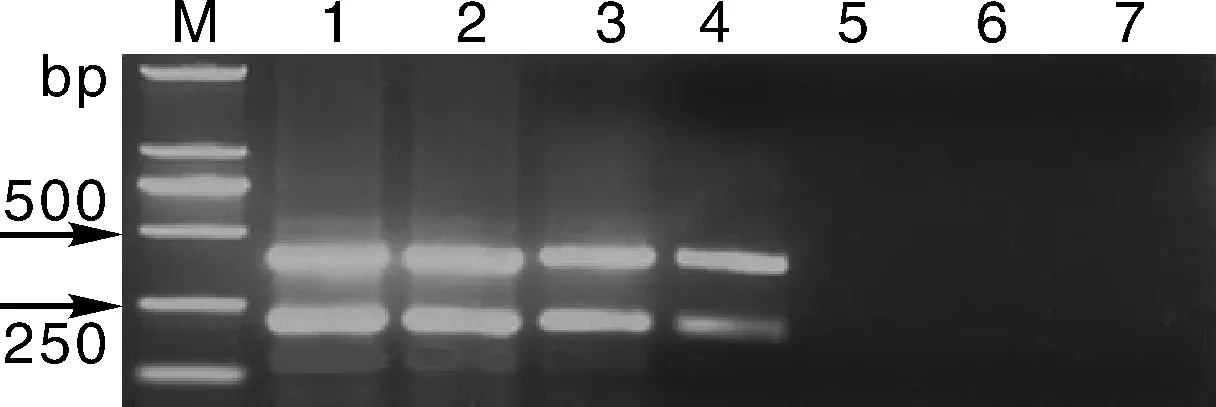
M, DNA marker (DL2000); 1, 2, 3, 4, 5, 6, 7, 依次表示DNA 浓度为 1.0×102, 1.0×101, 1.0×100, 1.0×10-1, 1.0×10-2, 1.0×10-3, 1.0×10-4 ng·μL-1。M, DNA marker(DL2000); 1, 2, 3, 4, 5, 6, 7, DNA concentrations 1.0×102, 1.0×101, 1.0×100, 1.0×10-1, 1.0×10-2, 1.0×10-3, 1.0×10-4 ng·μL-1, respectively.图2 双重PCR灵敏度检测结果Fig.2 Sensitivity of duplex PCR to detect serially diluted genomic DNA
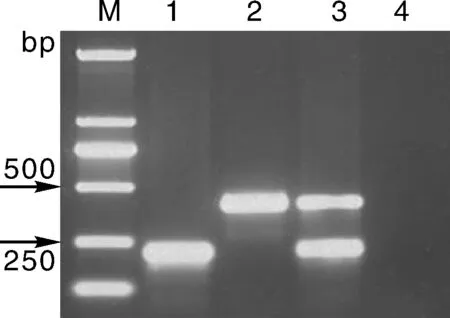
M, DNA marker (DL2000); 1, Burkholderia gladioli pv. alliicola; 2, Erwinia chrysanthemi; 3, Burkholderia gladioli pv. Alliicola, Erwinia chrysanthemi; 4, 对照。M, DNA marker (DL2000); 1, Burkholderia gladioli pv. alliicola; 2, Erwinia chrysanthemi; 3, Burkholderia gladioli pv. Alliicola, Erwinia chrysanthemi; 4, The control.图3 人工接种样品双重PCR检测结果Fig.3 DNA analysis of the seed infected artificially with duplex PCR assay
3 结论与讨论
改革开放以来,我国花卉产业取得了举世瞩目的成就,郁金香花卉产业已成为我国部分农村经济和农业转型升级的新增长点[11]。我国种植的郁金香多数是进口品种,洋葱腐烂病菌和菊基腐病菌随进口郁金香种球传入存在一定的风险。我国历年检疫截获的数据显示,我国曾从大花惠兰、石斛兰、甜玉米种子中截获过洋葱腐烂病菌,从风信子和蝴蝶兰中截获过菊基腐病菌[12],但在进口郁金香种球中还未有截获的报道。洋葱腐烂病菌和菊基腐病菌主要靠带菌种球作远距离传播,在储藏期间它们经常复合侵染,引起种球软腐,造成重大经济损失。如只用普通PCR技术分别对这2种细菌进行检测,工作量偏大,费时费力,与口岸货物快速通关要求不符。另外,进口种球类货物对时间要求较为严格,如在口岸存储时间过长易导致发芽变质,使货物失去使用价值,因而建立同时检测这2种危险性细菌的分子检测技术十分重要。
本研究设计了洋葱腐烂病菌特异性引物,在考虑到引物退火温度不同和引物间相互干扰等因素的基础上,结合已公布的菊基腐病菌的特异性引物,建立双重PCR体系,并对该体系的反应条件进行优化。该检测体系可有效地检测参试的洋葱腐烂病菌、菊基腐病菌及模拟带菌叶片,具有较强的特异性,灵敏度也较高。应用该双重PCR能够一次检测出洋葱腐烂病菌和菊基腐病菌,大幅节约实验室时间和检测成本。本研究建立的双重PCR方法可满足口岸实际的检测需求。郁金香种球进口量较大,在国外也必须经过储藏、整理、加工、运输等手段,时间跨度较长,种球上潜伏的洋葱腐烂病菌和菊基腐病菌可能会在仓库内发生和扩展。本研究立足口岸检测一线实际,建立了快速灵敏的双重PCR检测方法,应用该方法可成功检测到洋葱腐烂病菌和菊基腐病菌的针刺带菌样品。使用本研究建立的方法,对进境种球样品进行同步检测,检测有阳性的样品再进行针对性梯度分离,如为阴性则无需进行分离及种植试验。使用本研究建立的双重PCR检测方法,将大大提高各种苗指定口岸的检疫水平和工作效率,大幅减轻实验室的鉴定工作量,分离成功的可能性增大,为阻止洋葱腐烂病菌和菊基腐病菌的传入,提高口岸检出率和通关效率有较大帮助。
[1] NASSAR A, DARRASSE A, LEMATTRE M, et al. Characterization ofErwiniachrysanthemiby pectinolytic isozyme polymorphism and restriction fragment length polymorphism analysis of PCR-amplified fragments ofpelgenes[J].AppliedandEnvironmentalMicrobiology, 1996, 62(7):2228-2235.
[2] BAUERNFEIND A, SCHNEIDER I, JUNGWIRTH R, et al. Discrimination ofBurkholderiagladiolifrom otherBurkholderiaspecies detectable in cystic fibrosis patients by PCR[J].JournalofClinicalMicrobiology, 1998,36(9):2748-2751.
[3] MAEDA Y, SHINOHARA H, KIBA A, et al. Phylogenetic study and multiplex PCR based detection ofBurkholderiaplantarii,BurkholderiagumoandBurkholderiagladioliusinggyrBandrpoDsequences[J].IntemationalJournalofSystematicandEvolutionaryMicrobiology, 2006,56(5): 1031-1038.
[4] WHITBY P W, POPE L C, CARTER K B, et al.Species-specific PCR as a tool for the identification ofBurkholderiagladioli[J].JournalofClinicalMicrobiology, 2000, 38(1):282-285.
[5] LEE Y A, CHEN K P, HSU Y W. Characterization ofErwiniachrysanthemi, the soft-rot pathogen of white-flowered calla lily, based on pathogenicity and PCR-RFLP and PFGE analyses[J].PlantPathology, 2006, 55(4):530-536.
[6] 刘鹏,黄国明,刘勇,等.菊欧文氏菌分子检测技术的研究[J].植物病理学报,2007,37(6):34-37.
LIU P, HUANG G M, LIU Y, et al. Molecular detection ofErwiniachrysanthemi[J].ActaPhytopathologicaSinica, 2007,37(6):34-37. (in Chinese with English abstract)
[7] 杨万风,刘艳,刘翔,等. 双重PCR法同步检测菜豆晕疫病菌和萎蔫病菌[J]. 浙江农业学报, 2015, 27(9):1612-1618.
YANG W F, LIU Y, LIU X, et al. Duplex PCR detection ofPseudomonassavastanoipv.phaseolicolaandCurtobacteriumflaccumfacienspv.flaccumfaciensin soybean[J].ActaAgriculturaeZhejiangensis, 2015, 27(9):1612-1618. (in Chinese with English abstract)
[8] 韩广涛, 杨志辉, 朱杰华, 等. 双重PCR技术检测马铃薯环腐病菌和黑胫病菌方法的建立[J]. 中国农业科学, 2011,44(20):4199-4206.
HAN G T, YANG Z H, ZHU J H, et al. Development of duplex PCR assay for detection ofClavibactermichiganensissubsp.sepedonicusandPectobacteriumatrosepticafrom potato[J].ScientiaAgriculturaSinica, 2011, 44(20):4199-4206. (in Chinese with English abstract)
[9] 陈庆河, 李本金, 兰成忠, 等. 双重 PCR 检测马铃薯晚疫病菌和青枯病菌方法的建立及应用[J]. 植物病理学报, 2009, 39(6): 578-583.
CHEN Q H, LI B J, LAN C Z, et al. Development and application of duplex PCR assay for detection ofPhytophthorainfestansandRalstoniasolanacearum[J].ActaPhytopathologicaSinica, 2009, 39(6): 578-583. (in Chinese with English abstract)
[10] PRICE J A, SMITH J, SIMMONS A, et al. Multiplex real-time RT-PCR for detection ofWheatstreakmosaicvirusandTritcummosaicvirus[J].JournalofVirologicalMethods, 2010, 165(2): 198-201.
[11] 屈连伟,苏君伟, 赵展,等. 国产郁金香种球产业化及市场营销策略探析[J].园艺与种苗,2016(9):42-45.
QU L W, SU J W, ZHAO Z, et al. Discussion on industrialization of domestic tulip bulbs and marketing strategies[J].Horticulture&Seed, 2016(9):42-45. (in Chinese with English abstract)
[12] 李娜, 周国粱, 印丽萍, 等. 进境风信子种球中菊基腐病菌的鉴定[J]. 上海农业学报, 2012, 28(3):42-45.
LI N, ZHOU G L, YIN L P, et al. Identification ofDickeyachrysanthemiin introduced hyacinth bulbs[J].ActaAgriculturaeShanghai, 2012, 28(3):42-45. (in Chinese with English abstract)
