血脂及脂蛋白代谢改变在胃癌中的临床意义
2018-03-20玄甜甜李光毅曹芳丽曲琳莉孟思博王宁宁王展梅
玄甜甜,李光毅,曹芳丽,曲琳莉,孟思博,王宁宁,王展梅
(1.山东大学齐鲁医院 化疗科,山东 青岛 266035;2.山东大学齐鲁医院 呼吸内科,山东 青岛 266035)
胃癌是最常见的消化道肿瘤之一,在世界范围内,其发病率占癌症发病率的第4位,居肿瘤相关性死亡的第3位[1]。我国每年新发胃癌67.9万例,因胃癌死亡49.8万人[2],发病率、病死率为全球平均水平的2倍,为胃癌发病率和病死率最高的国家之一。因此研究胃癌的发生、发展相关因素具有重要意义。近年来,多项研究发现血脂水平与恶性肿瘤存在相关性[3-6],但血脂与胃癌之间的关系及预后价值尚无定论。本研究旨在探讨血脂、脂蛋白代谢改变与胃癌的临床病理特征和预后的关系,为评估胃癌的恶性程度、治疗效果及预后判断提供新思路。
1 资料与方法
1.1 研究对象
收集2011年1月1日至2011年12月31日山东大学齐鲁医院收治的胃癌患者127例为胃癌组,男91例、女43例,均为初治并行胃癌根治术,病理分期II-III期,年龄35~86岁,其中89例完成术后6~8周期标准辅助化疗(mFOLFOX6、XELOX、XELODA、S-1)。另外收集同期健康体检者100例为对照组,男69例、女31例,年龄28~78岁。胃癌分期采用美国癌症联合委员会(AJCC)胃癌TNM分期(2010年第七版)标准。组织病理分级按Kloppel标准分为分化型腺癌(乳头状腺癌、高分化管状腺癌和中分化管状腺癌)及低分化型腺癌(低分化腺癌、印戒细胞癌和黏液细胞癌)。排除年龄<18岁者、术后30天因各种原因去世者,合并原发性或继发性高血压,缺血性或高血压性心脏病及糖尿病,肝肾功能不全,甲状腺疾病,家族型高脂血症,服用降血脂药物,体重超过标准体重15%及低蛋白血症患者。
1.2 脂代谢指标测定
收集受试者治疗前空腹静脉血3 mL,应用BECKMAN-CX5型全自动生化分析仪(美国Beckman-coulter公司),分别检测静脉血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平。
1.3 随 访
所有胃癌患者规律随访至死亡或5年。
1.4 统计学方法
应用SPSS17.0统计软件包,多组间比较采用单因素方差分析(ANOVA)或Kruskal-Wallis检验,两组间比较采用独立样本t检验。Kaplan-Meier生存曲线用于研究血脂及脂蛋白水平对胃癌预后的影响,COX比例风险回归模型分析影响胃癌预后的临床病理因素。P<0.05为差异有统计学意义。
2 结 果
2.1 胃癌组和对照组血脂及脂蛋白水平的比较
胃癌组治疗前TC、TG、HDL-C、LDL-C水平均低于对照组(t=6.224、2.514、4.542、2.797,P<0.05)(表1)。
表1胃癌组及对照组TC、TG、HDL-C、LDL-C的比较结果


组别例数TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)胃癌组1274.12±1.111.09±0.521.03±0.422.58±0.95对照组1004.86±0.671.28±0.601.26±0.312.87±0.59t6.2242.5144.5422.797P0.0000.0130.0000.006
2.2 胃癌组血脂及脂蛋白水平与临床病理特征的关系
胃癌患者血清TC水平与淋巴结转移及TNM分期负相关(P<0.05)。在有淋巴结转移患者中血清TG水平显著降低(P<0.05)。肿瘤长径≥5 cm及Ⅲ期患者血清HDL-C水平低于肿瘤长径<5 cm及Ⅱ期患者(P<0.05)。有淋巴结转移及Ⅲ期患者血清LDL-C水平更低(P<0.05)。见表2。
2.3 血脂及脂蛋白水平与胃癌患者预后的关系
随访资料完整者共111例,对其进行生存分析,TC、TG、HDL-C、LDL-C分别以4.16 mmol/L[4]、1.04 mmol/L[7]、1.00 mmol/L[8]、2.60 mmol/L[5]分为低水平组与高水平组,低TC组和高TC组的中位生存期分别是21个月和28个月(95%CI 18.32-23.69, 21.95-34.05;χ2=11.122,P=0.001),中位无病生存时间分别是11个月和17个月(95%CI 8.74-13.26, 11.95-22.05;χ2=11.680,P=0.001);低HDL-C组和高HDL-C组的中位生存期分别是21个月和26个月(95%CI 17.89-24.11,19.21-32.79;χ2= 5.831,P=0.006),中位无病生存时间分别是12个月和14个月(95%CI 9.79-14.21,9.47-18.53;χ2=5.971,P=0.015);而对血清TG、LDL-C分组比较,总生存和无病生存期没有统计学差异(P>0.05)。见图1。
表2胃癌组TC、TG、HDL-C、LDL-C与临床病理特征的关系

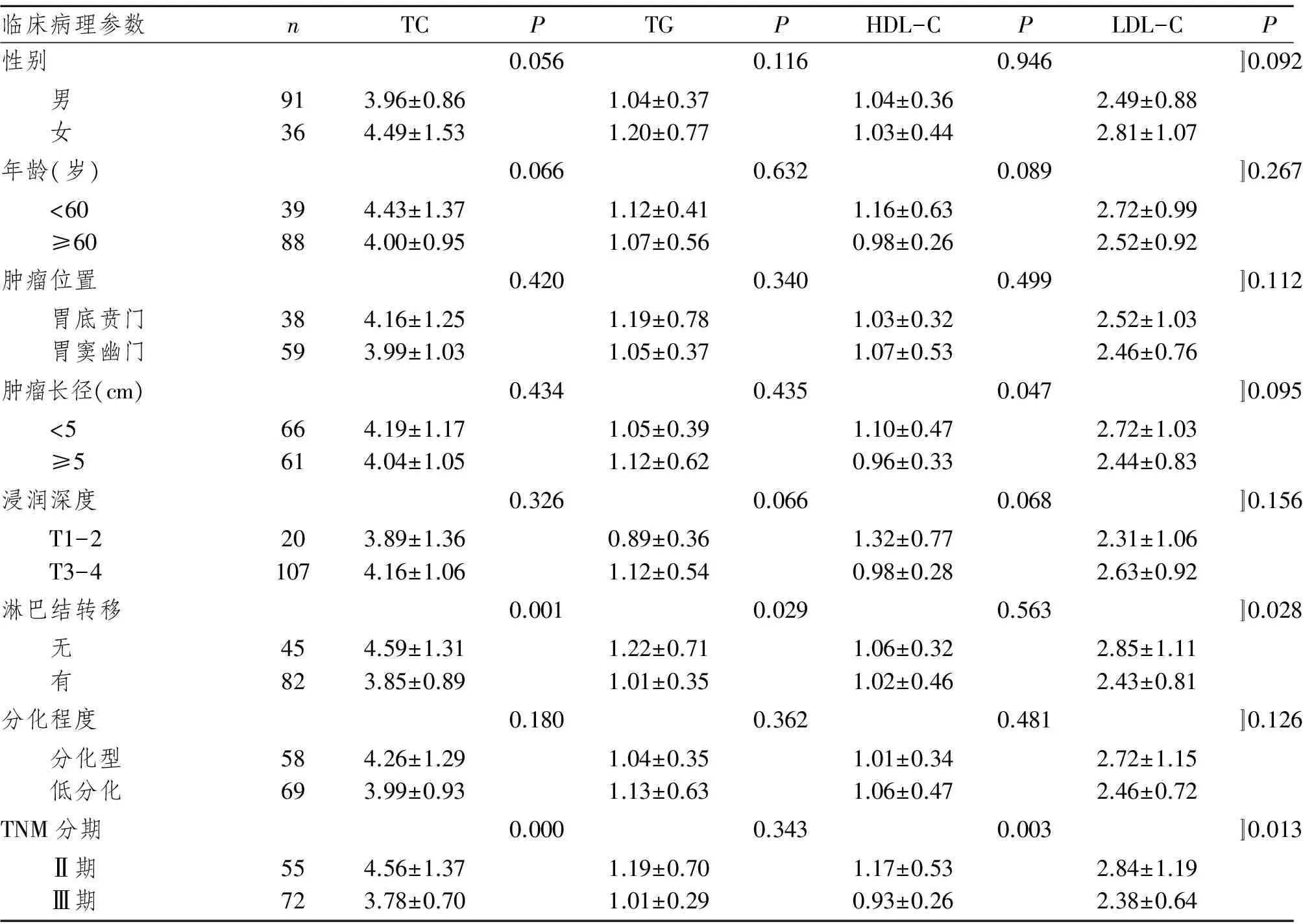
临床病理参数nTCPTGPHDL-CPLDL-CP性别0.0560.1160.946〛0.092 男 女91363.96±0.864.49±1.531.04±0.371.20±0.771.04±0.361.03±0.442.49±0.882.81±1.07年龄(岁)0.0660.6320.089〛0.267 <60 ≥6039884.43±1.374.00±0.951.12±0.411.07±0.561.16±0.630.98±0.262.72±0.992.52±0.92肿瘤位置0.4200.3400.499〛0.112 胃底贲门 胃窦幽门38594.16±1.253.99±1.031.19±0.781.05±0.371.03±0.321.07±0.532.52±1.032.46±0.76肿瘤长径(cm)0.4340.4350.047〛0.095 <5 ≥566614.19±1.174.04±1.051.05±0.391.12±0.621.10±0.470.96±0.332.72±1.032.44±0.83浸润深度0.3260.0660.068〛0.156 T1-2 T3-4201073.89±1.364.16±1.060.89±0.361.12±0.541.32±0.770.98±0.282.31±1.062.63±0.92淋巴结转移0.0010.0290.563〛0.028 无 有45824.59±1.313.85±0.891.22±0.711.01±0.351.06±0.321.02±0.462.85±1.112.43±0.81分化程度0.1800.3620.481〛0.126 分化型 低分化58694.26±1.293.99±0.931.04±0.351.13±0.631.01±0.341.06±0.472.72±1.152.46±0.72TNM分期0.0000.3430.003〛0.013 Ⅱ期 Ⅲ期55724.56±1.373.78±0.701.19±0.701.01±0.291.17±0.530.93±0.262.84±1.192.38±0.64
2.4 COX回归分析
COX回归模型对血脂、脂蛋白水平及临床病理特征进行单因素分析,TC、HDL-C、肿瘤长径、淋巴结转移、TNM分期、辅助化疗与OS相关。将单因素分析中有意义的变量纳入COX多因素分析,TC水平、TNM分期及辅助化疗是Ⅱ-Ⅲ期胃癌手术患者的独立预后因素(P<0.05),TC水平、浸润深度、TNM分期及辅助化疗是DFS的独立预测指标(表3)。
3 讨 论
近年来,恶性肿瘤患者血脂及脂蛋白的变化越来越受到人们的重视。在很多流行病学研究中,血清胆固醇及脂蛋白水平与肿瘤发生风险的关系因性别、肿瘤位置、种族等不同而存在差异。有研究发现血清总胆固醇水平与肿瘤发生风险呈正相关,与预后呈负相关,但是也有学者得出相反的结论[3-6]。在Me-Can研究中,男性肝癌、肝内胆管细胞癌、胰腺癌、淋巴血液系统肿瘤和女性乳腺癌、皮肤黑色素瘤、淋巴血液系统肿瘤均与血清胆固醇水平呈负相关[3]。韩国进行的一项前瞻性研究发现,高血清总胆固醇(≥240 mg/dL)与男性前列腺癌、结肠癌及女性乳腺癌发生呈正相关,但是与胃癌、肝癌及男性肺癌发生呈负相关[4]。Ahn J等[6]的研究也提出低胆固醇血症可能增加恶性肿瘤患者的病死率,且胆固醇水平与病情严重程度呈反比,即病情越重,胆固醇水平越低。在肺癌患者中,高血清HDL-C水平比低HDL-C患者有更好的预后[6,9],但是前列腺癌患者高血清HDL-C往往提示预后不良[10]。
胃癌患者血脂水平与临床病理特征及预后的关系仍存在争议。有学者发现,血清胆固醇和甘油三酯升高增加胃癌的发生风险[11-13],尤其是胃底贲门位置的肿瘤[14]。Kitayama等[12]发现高脂血症与早期胃癌淋巴结转移呈正相关,且对胃肠道恶性肿瘤的生长、转移具有促进作用。也有一些学者得出了完全相反的结论,认为胆固醇水平与胃癌的发病率呈负相关。Asano K等[15]对2604例患者的研究发现,低血清胆固醇水平是胃癌尤其是肠型胃癌发生的独立危险因素。Kitahara CM等[4]提出胃癌患者血清TC、HDL、LDL水平较正常人均降低。Tamura T等[8]发现血清低水平HDL-C胃癌患者的淋巴及血管转移相对增加。Guo E等[16]通过对501例胃癌患者的回顾性研究发现,胃癌患者低水平HDL-C或高TC/HDL-C比率是淋巴结分期pN2-3的潜在生物标志物,尤其是对于分化型胃癌。虽然部分流行病学研究发现高LDL-C或高TG水平者患癌风险更高[5,17],但是也有学者提出血清TG水平与胃癌及口唇肿瘤[7]的发生呈负相关。关于LDL-C,Jung MK等[18]提出LDL-C可能与胃壁异常增生相关,并被认为是胃癌发生的促动因素。另外,有学者研究发现LDL-C与新辅助化疗胃癌患者的治疗敏感性相关[19]。

图1 总生存期及无病生存期Fig 1 Overall survival and disease-free survival

表3 111例胃癌患者5年DFS和OS的COX多因素分析
综合近年来的研究结果,多数研究提出血脂及脂蛋白水平与胃癌发生负相关,考虑机制可能是:(1)胃癌细胞过度增殖,机体脂代谢活跃,体内血脂及脂蛋白改变[20]。(2)脂类是细胞膜的重要组成部分,肿瘤细胞异常分裂和过度增殖消耗大量脂类[4],导致血TC下降,胃癌患者恶性程度越高,体内脂质过氧化反应越强[21],TC、TG的消耗越多。(3)载脂蛋白合成减少[22-23],消化道肿瘤患者常伴有消化吸收功能障碍,伴随肝、肾等功能障碍,使其处于负氮平衡状态。关于血脂对恶性肿瘤发生的影响,Lavigne[24]提出,恶性肿瘤组患者LDL-C水平低于对照组,平均在诊断恶性肿瘤前18.7年出现低水平LDL-C(P=0.038),促使我们从另一个角度认识血脂代谢改变与胃癌的关系。肿瘤发生是一种特殊类型的炎症反应,该过程需要核转录因子κB (NF-κB)的参与[25],胆固醇是重要的的结构脂类,参与构成细胞膜及维持细胞膜的功能[26],长时间的低血清胆固醇状态会激活NF-κB,从而促进肿瘤的发生[27]。因此,我们推断低血清胆固醇可能是肿瘤发生的促进因素。
本研究通过比较127例胃癌患者和100例健康体检者的血脂水平,发现胃癌患者的TC、TG、HDL-C、LDL-C显著降低,TC和LDL-C与胃癌病情严重程度呈反比,与既往研究结果一致。有淋巴结转移组血清TG水平低于无淋巴结转移组,考虑与肿瘤细胞增殖转移需要机体过多的能量来源,消耗大量脂类有关。肿瘤长径≥5 cm及III期患者血清HDL-C水平显著低于肿瘤长径<5 cm及II期患者,提示HDL-C可能作为局部肿瘤大小的预测指标。
进一步分析血脂水平与胃癌患者预后的关系,Kaplan-Meier生存曲线及Log-rank法比较发现低TC组和低HDL-C组OS及DFS显著低于高TC和高HDL-C组。COX多因素分析显示,低TC水平、TNM III期及术后未行化疗患者有更高的死亡风险。
综上所述,胃癌患者存在脂代谢异常,脂质及脂蛋白的水平与临床病理特征相关,胃癌患者血清总胆固醇低、TNM分期晚、未行化疗提示较差的预后。血脂水平可能作为进展期胃癌患者病情评估、预后判断的探索性指标。
[1] Lindsey A, Freddie Bray, Rebecca L, et al. Global Cancer Statistics, 2012[J]. CA Cancer J Clin,2015,65(2):87-108.
[2] Chen W,Zheng R,Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[3] Strohmaier S,Edlinger M,Manjer J,et al.Total serum cholesterol and cancer incidence in the Metabolic syndrome and Cancer Project (Me-Can) [J].PLoS One, 2013, 8(1): e54242.
[4] Kitahara CM,Berrington de González A,Freedman ND,et al.Total cholesterol and cancer risk in a large prospective study in Korea[J].J Clin Oncol, 2011, 29(12): 1592-1598.
[6] Ahn J, Lim U, Weinstein SJ, et al.Prediagnostic total and high-density lipoprotein cholesterol and risk of cancer[J]. Cancer Epidemiol Biomarkers Prev, 2009, 18(11):2814-2821.
[7] Lohe VK, Degwekar SS, Bhowate RR,et al.Evaluation of correlation of serum lipid profile in patients with oral cancer and precancer and its association with tobacco abuse[J]. J Oral Pathol Med, 2010, 39(2): 141-148.
[8] Tamura T, Inagawa S, Hisakura K, et al.Evaluation of serum high-density lipoprotein cholesterol levels as a prognostic factor in gastric cancer patients[J].J Gastroenterol Hepatol, 2012, 27(10): 1635-1640.
[9] Chi PD, Liu W, Chen H, et al. High-density lipoprotein cholesterol is a favorable prognostic factor and negatively correlated with C-reactive protein level in non-small cell lung carcinoma[J].PLoS One, 2014, 9(3): e91080.
[10] Kotani K, Sekine Y, Ishikawa S, et al. High-density lipoprotein and prostate cancer: an overview[J]. J Epidemiol, 2013, 23(5): 313-319.
[11] Chen KC, Liao YC, Wang JY,et al. Oxidized low-density lipoprotein is a common risk factor for cardiovascular diseases and gastroenterological cancers via epigenomical regulation of microRNA-210[J].Oncotarget, 2015, 62(7):24105-24118.
[12] Kitayama J,Tabuchi M,Tsurita G,et al.Adiposity and gastrointestinal malignancy[J]. Digestion, 2009, 79(1): 26-32.
[13] Kim HY.Metabolic syndrome is associated with gastric dysplasia[J]. Eur J Gastroenterol Hepatol, 2011, 23(10): 871-875.
[14] López-Carrillo L, López-Cervantes M, Ward MH, et al.Nutrient intake and gastric cancer in Mexico[J]. Int J Cancer, 1999, 83(5): 601-605.
[15] Asano K, Kubo M, Yonemoto K, et al.Impact of serum total cholesterol on the incidence of gastric cancer in a population-based prospective study: the Hisayama study[J].Int J Cancer, 2008, 122(4): 909-914.
[16] Guo E, Chen L, Xie Q,et al.Serum HDL-C as a potential biomarker for nodal stages in gastric cancer[J].Ann Surg Oncol, 2007, 14(9):2528-2534.
[17] Borena W, Stocks T, Jonsson H, et al.Serum triglycerides and cancer risk in the metabolic syndrome and cancer (Me-Can) collaborative study[J].Cancer Causes Control, 2011, 22(2): 291-299.
[18] Jung MK, Jeon SW, Cho CM, et al. Hyperglycaemia, hypercholesterolaemia and the risk for developing gastric dysplasia[J]. Dig Liver Dis, 2008, 40(5): 361-365.
[19] Zhou JC, Guo JF, Teng RY, et al.New utility of an old marker: serum low-density lipoprotein predictshistopathological response of neoadjuvant chemotherapy in locally advanced gastric cancer[J].Onco Targets Ther, 2016, 12(9):5041-5047.
[20] 张婷,崔戈,冯文明,等.胃癌患者糖脂代谢指标与临床病理学特征的相关性分析[J].中华医学杂志,2016, 96(32): 2545-2547.
[21] Enjoji M, Kohjima M, Ohtsu K, et al. Intracellular mechanisms underlying lipid accumulation (white opaque substance) in gastric epithelialneoplasms: A pilot study of expression profiles of lipid-metabolism-associated genes[J]. J Gastroenterol Hepatol, 2016, 31(4): 776-781.
[22] Healy LA, Howard JM, Ryan AM, et al.Metabolic syndrome and leptin are associated with adverse pathological features in male colorectal cancer patients[J].Colorectal Dis, 2012, 14(2): 157-165.
[23] Yeh HC, Platz EA, Wang NY, et al.A prospective study of the associations between treated diabetes and cancer outcomes[J].Diabetes Care, 2012, 35(1): 113-118.
[24] Lavigne.LDL Cholesterol is Related to Cancer Risk[N]. Science Daily, 2012.
[25] Kim YE, Hwang CJ, Lee HP, et al. Inhibitory effect of punicalagin on lipopolysaccharide-induced neuroinflammation, oxidative stress and memory impairment via inhibition of nuclear factor-kappaB[J]. Neuropharmacology, 2017, 26(117): 21-32.
[26] Liu ML, Scalia R, Mehta JL. Cholesterol-induced membrane microvesicles as novel carriers of damage-associated molecular patterns: mechanisms of formation, action, and detoxification[J]. Arterioscler Thromb Vasc Biol, 2012, 32(9): 2113-2121.
[27] Chen J, Lan T, Zhang W, et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma[J]. Oncogene, 2015, 34(40): 5114-5127.
