高压氧对急性一氧化碳中毒大鼠心肌超微结构及心电图的影响
2018-03-20戴淑芳孙艺平于德钦穆靖洲崔晓雯姜永珊刘克敏
戴淑芳, 孙艺平,傅 雷,于德钦,徐 静,穆靖洲,崔晓雯,姜永珊,刘克敏
(1.大连医科大学 基础实验教学中心,辽宁 大连 116044; 2. 大连医科大学附属第一医院 中医康复科,辽宁 大连 116011)
急性一氧化碳中毒(carbon monoxide poisoning,CO-P) 是生活和生产中常见的中毒性疾病, 严重者可危及生命。CO-P对机体的损害快速而广泛,特别是体内血管吻合支少而且代谢旺盛的器官如大脑和心脏最易遭受损害,但由于其常以头晕、神志不清、反应迟钝和昏迷等为主要临床表现,掩盖了心脏及其他脏器受损的表现,医务工作者常把注意力集中在神经系统的损害方面,而忽略了对心肌损害的预防及治疗。临床上高压氧(hyperbaric oxygenation,HBO)对急性 CO-P 的治疗作用众所周知,但它对急性 CO-P 导致的心肌损伤是否有预防作用,却无定论。本研究观察急性CO-P大鼠心电图及心肌超微结构的病理改变以及高压氧(HBO)对其影响, 旨在进一步探讨 HBO 对急性 CO-P预防及治疗的可能机制。
1 材料和方法
1.1 实验动物及分组
健康雄性SD 大鼠50只,体重230~270 g, 购自大连医科大学SPF实验动物中心。动物许可证号:SCXK(辽)2013-0003。
随机分为正常对照组(NC组)10只;40只大鼠用于模型建立,死亡12只,剩余28只造模成功的急性 CO-P 大鼠,按体重随机分为急性一氧化碳中毒组(CO-P组)14只;急性一氧化碳中毒高压氧治疗组(HBO组)14只。
1.2 急性CO中毒模型的建立
室温20~24 ℃下,采用分次腹腔注射法建立大鼠急性 CO中毒模型。首次注射 CO 纯品气体(高纯一氧化碳99.9%)120 mL/kg后,连续3次按首次剂量的1/2即 60 mL/kg追加注射,间隔时间为4 h[1]。另取10只正常SD大鼠同法注射等量空气作为对照组。
对照组:大鼠按照120 mL/kg接受腹腔注射空气后,立即表现出烦躁兴奋状态,随后精神逐渐萎靡不振,蜷缩成团。约10~15 mL后自然缓解、状态逐渐恢复,跟踪观察数天未发现任何后遗症表现,无死亡。
模型组:分次腹腔注射纯品 CO 气体后,大鼠均在 15 min内出现不同程度的脑损伤:陆续出现少动、四肢瘫软、抽搐,肢端皮肤呈樱桃红色等表现。部分大鼠在发病过程中死亡,主要死亡于第1次和第2次注射CO后, 40只大鼠第1次注射CO后(约2 h左右)死亡11只,第2次注射CO后1 h死亡1只,死亡率30%。约于末次染毒6~8 h后剩余大鼠完全苏醒,饮食和日常活动无明显异常。死亡动物尸检发现内脏重度充血伴散在出血点,脑组织充血水肿符合急性CO中毒表现[2]。
染毒后大鼠舒适饲养,高压氧组大鼠给予高压氧治疗。
1.3 HBO 治疗
将HBO组动物于 CO 染毒后第 1 天置于实验动物高压氧舱内,同时开放充气阀和排气阀以纯氧洗舱 10 min,用测氧仪测得舱内氧浓度>95%后,关闭排气阀,观察舱内压力表进行匀速加压,时间为 15 min,目标压力为 0.2 MPa(2.0ATA),达目标压力后,关闭充气阀,稳压 60 min,稳压过程中注意观察压力表以便发现有无氧气泄漏及定时用测氧仪监测舱内氧浓度,保证在稳压过程中舱内氧浓度始终保持在95%~99%,如氧浓度低于此范围及时进行等压换气。稳压 60 min后,缓慢打开排气阀,边观察压力表,边进行匀速减压,用 15 min减压至常压。
HBO 治疗均于每天下午进行,1 次/d,共 15次。即染毒后第15天停止。
1.4 心电图检测
将清醒大鼠固定于操作台,在四肢皮下刺入6号金属注射器针头,位置参照人的相应部位。BL-420F 生物信号采集系统专用心电图导联线的鳄鱼夹与注射器针头连接并作屏蔽处理,大鼠状态稳定后描记心电图。
于CO染毒前,第1、2、3、4次CO注射术后1 h,第 3、7、15天,测量大鼠标准肢体Ⅱ导联心电图。打开BL-420F生物信号采集系统,选中一段心电图,点击工具条上“心功能参数测量”按钮,观察并记录ST 段改变情况。
1.5 心肌显微结构观察
于染毒后第1天和第16天取CO-P组和HBO组大鼠左心室小块组织,置于4%戊二醛电镜固定液中固定12 h,锇酸后固定,常规透射电镜超薄切片制片,醋酸铀和柠檬酸铅双染,H7500型透射电镜观察其组织形态学变化。
1.6 统计学方法
2 结 果
2.1 各组大鼠心肌超微结构改变
正常对照组心肌细胞肌丝排列整齐,结构清晰, 肌节规则,线粒体丰富, 线粒体膜完整, 嵴密集且排列规则,基质密度均匀(图1)。
CO-P组第1天可见肌原纤维断裂、排列紊乱,Z线扭曲。线粒体肿胀、基质疏松密度下降,嵴数量减少、断裂、甚至出现空泡(图2)。CO-P组第16天心肌细胞损伤程度减轻,心肌纤维排列规整,线粒体嵴间隙稍有增大(图3)。HBO 组第1天的心肌细胞内肌丝排列整齐规则,线粒体结构大致正常,膜有破裂,可见轻度肿胀改变, 嵴排列不规整,电子致密度减少(图4) 。HBO 组第16天心肌细胞损伤基本恢复正常,表现为完整的肌原纤维,清晰正常的Z线,线粒体外膜完整、嵴清晰(图5)。
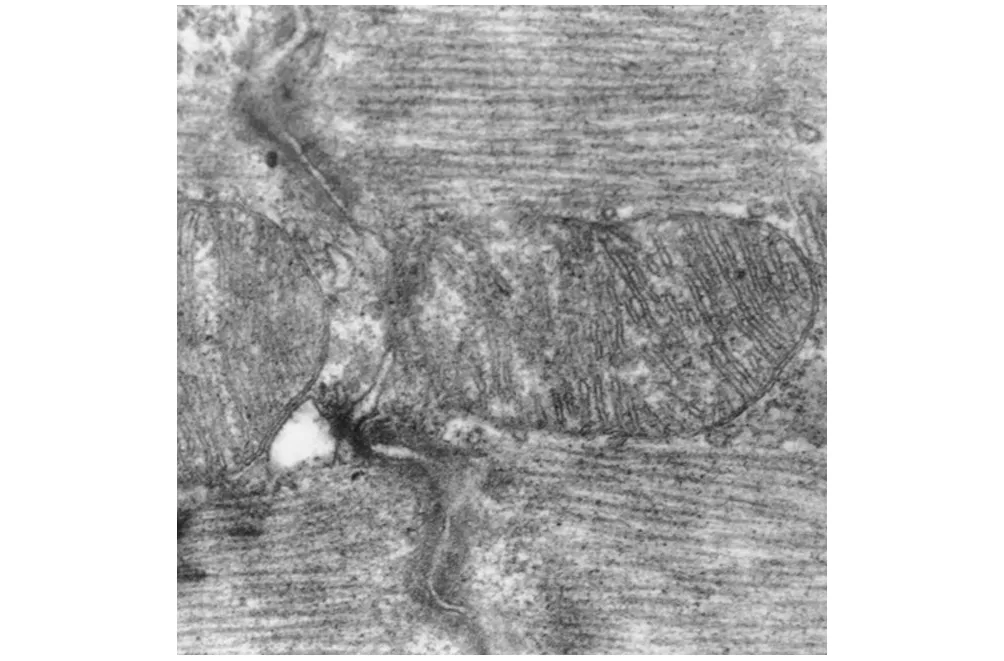
图1 NC组(×25000)Fig 1 NC group(×25000)
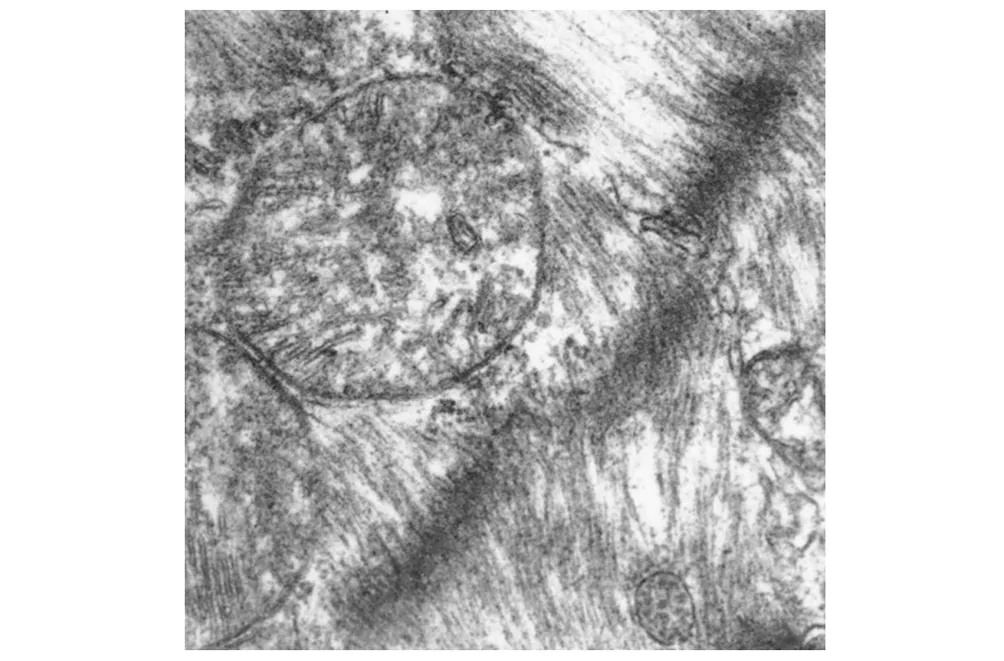
图2 CO-P组第1天(×24000)Fig 2 CO-P group day 1(×24000)

图3 CO-P组第16天(×20000)Fig 3 CO-P group day 16(×20000)
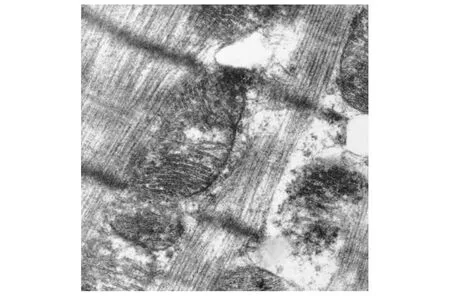
图4 HBO组第1天(×20000)Fig 4 HBO group day 1(×20000)

图5 HBO组第16天(×20000)Fig 5 HBO group day 16(×20000)
2.2 各组大鼠心电图ST段改变
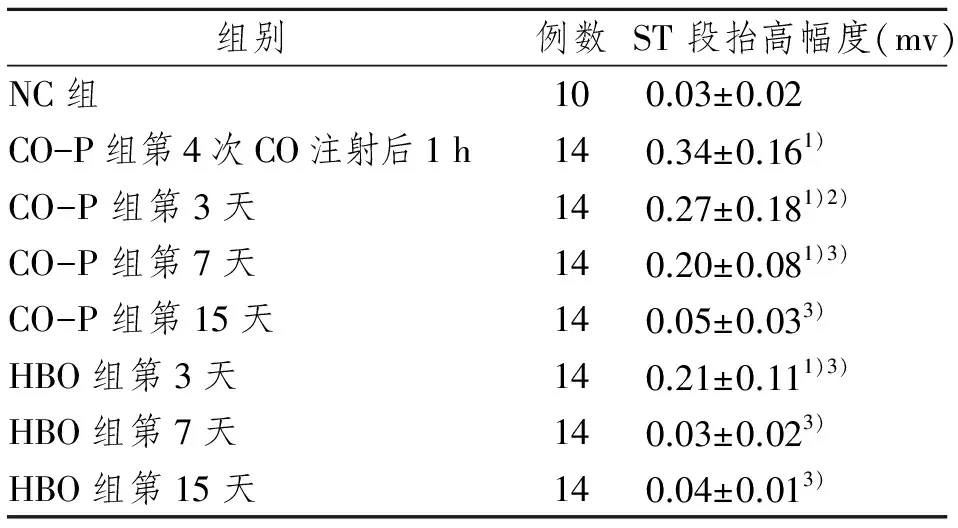
和正常对照组相比,CO-P组第4次CO注射后1 h、第3、7天和HBO组第3天ST段均明显抬高(P<0.01)。和CO-P组第4次CO注射后1 h相比,CO-P组第3天ST段明显降低(P<0.05),CO-P组第7、15天和HBO组第3、7、15天ST段均显著降低(P<0.01)。和正常对照组相比,CO-P组第15天和HBO组第7、15天ST段改变不明显(P>0.05) (表1)。
表1各组大鼠CO染毒前、后及高压氧暴露不同时间ECG ST改变

组别例数ST段抬高幅度(mv)NC组100.03±0.02CO-P组第4次CO注射后1h140.34±0.161)CO-P组第3天140.27±0.181)2)CO-P组第7天140.20±0.081)3)CO-P组第15天140.05±0.033)HBO组第3天140.21±0.111)3)HBO组第7天140.03±0.023)HBO组第15天140.04±0.013)
1)与NC组相比P<0.01; 2)与CO-P组第4次CO注射后1 h相比,P<0.05;3)与CO-P组第4次CO注射后1 h相比,P<0.01
3 讨 论
3.1 腹腔注射染毒法建立模型的可行性
建立可靠的动物模型是本实验的前提和基础,国内传统的CO中毒模型多采用CO混合气体吸入式染毒[3]。该种方法较接近于日常生活的CO中毒途径,浓度比较稳定,所得结果可以避免缺氧、CO2蓄积和湿度增加等因素影响, 具有很好的参照性。但其仪器、设备费用较高, 且通气期间需多次检测COHb等诸多的难题,不宜于实际操作。而且实验所需的CO消耗量大, 很容易影响到操作者的自身安全,染毒过程中对操作要求较高,因此明显限制了急性CO中毒模型的制备及其研究的深入。
Fecther等[2]报告用腹腔注射CO染毒的方法建立大鼠耳蜗损伤的动物模型获得成功。正如静脉注射油酸制备的急性呼吸窘迫综合征动物模型早为大家所公认一样,本实验采用按照120 mL/kg的标准分次腹腔注射纯品建立大鼠急性 CO中毒模型,可满足CO吸入中毒模型具备的所有条件,并无明显差异。本实验结果证明,腹腔注射CO后,大鼠出现了典型的CO中毒症状,主要表现为烦躁多动、精神萎靡、抽搐昏迷等,肢端口唇粘膜也相应呈现出特征性的樱桃红色,此为CO中毒的典型表现之一。死亡动物尸检发现内脏呈现樱桃红色,充血现象严重并伴有大量散在出血点,脑组织充血水肿也都符合急性CO中毒表现。腹腔注射染毒虽然与临床急性中毒的侵入途径不同,但其中毒机制则是完全一致的。采用本方法制备CO中毒的动物模型操作简便,安全可靠且CO染毒剂量容易控制,影响因素少,对设备仪器也无特殊要求,可行性强,是一种理想的制备急性CO中毒动物模型的方法[4]。
3.2 各组大鼠心肌超微结构改变
本研究中急性CO-P大鼠心肌超微结构病理改变与文献报道类似[5], CO-P组大鼠第1天的病理改变最严重,可见心肌纤维断裂,线粒体肿胀、基质密度变淡, 线粒体嵴断裂、减少、模糊不清甚至溶解消失;到第16天心肌细胞损伤程度减轻。HBO组超微结构在第1天即明显轻于同期的CO-P组, 到第16天时已基本恢复正常。提示急性CO中毒性心肌损害经HBO治疗可以很快逆转。发生CO 中毒时,可产生大量的 COHb不能携带氧,且不易解离;还能使血红蛋白氧离曲线左移,妨碍氧的弥散和利用,导致组织缺氧、功能受损[6]。心肌细胞内ATP在严重缺氧状态下迅速耗竭,Na+-K+-ATP 酶活性降低,诱发心肌间质充血水肿,心肌纤维断裂,导致心肌细胞损伤。同时,缺氧时酸性代谢产物蓄积,使毛细血管通透性增加,引发细胞间质水肿,并使循环障碍,从而加重心肌缺血缺氧[7]。此外,CO 与肌球蛋白结合,抑制细胞色素氧化酶活性,影响了心肌细胞内氧的弥散,从而损害线粒体功能,所以细胞缺氧时线粒体会首先发生变化[8]。
3.3 各组大鼠心电图ST段改变
心电图检查是临床检查中发现心脏损害最常用的手段之一。有文献报道急性 CO 中毒患者 EEG 异常率高达93%[9]。心电图出现缺血改变判断标准多采用Ⅰ或Ⅱ导联ST段抬高[10]。ST段代表心肌早期复极的电位变化,由于心肌细胞缺氧,引起酸中毒、水肿而使细胞复极发生改变,心电图表现为 ST-T 改变,常见于心肌缺血和心肌劳损[11]。本实验中,和正常对照组相比,CO-P组第4次CO注射1 h后心电图ST段均明显抬高(P<0.01)。表明一氧化碳中毒对心肌有损害。其发生机理可能因血液中的碳氧血红蛋白增多、心肌摄氧量减少、冠状动脉痉挛导致心肌缺血。实验结果表明,CO-P组第3、7、15天和HBO组第3、7、15天ST段均显著降低(P<0.05,P<0.01),CO-P组第15天和HBO组第7、15天ST段改变基本恢复。可见无论CO-P组还是HBO组心电图ST段改变都是可逆的,高压氧治疗CO-P引起心肌缺血损伤,可减少ST段下降持续时间及ST段下降幅度,加快心肌损伤的恢复,具有较好疗效。这与寇锋军等的研究一致,CO-P对机体的影响与中毒后恢复时间有关,停止吸入CO后,第1个小时排出量最多,但碳氧血红蛋白完全解离需要24 h以上,因此,CO-P对心肌的影响或损害程度与此有关,心电图表现也不同[12-13]。
高压氧能加速碳氧血红蛋白的解离, 促进CO清除, 使血红蛋白恢复携氧功能。高压氧能提高血氧分压, 增加血氧含量, 使组织得到足够溶解氧, 大大减少机体对血红蛋白携氧的依赖性, 从而迅速纠正低氧血症,改善机体缺氧状态[14]。 综上所述,对于急性CO-P 患者必须全面观察病情,特别是无明显心脏症状的患者或因昏迷而不能提供心脏不适症状的患者,需常规做心电监护,减少漏诊。应立即脱离 CO 中毒环境,早期应用高压氧,及时给予心肌保护治疗,预防急性CO-P导致的心肌损害,改善预后[15]。本研究通过亚细胞水平和心电图分析进一步证实HBO 治疗可显著减轻CO-P性心肌损害及加速心肌损伤的恢复, 为HBO治疗急性CO-P提供了新的实验依据。
[1] 周磊,刘青乐,郑成刚,等. 急性一氧化碳中毒大鼠海马组织NaPi-IIb蛋白表达的研究[J].现代生物医学进展,2016,16(2):218-220.
[2] Fecther LD, Liu Y. MK-801 protects against carbon monoxide-induced hearing loss[J].Toxicol Appl Pharmacol, 1995,132 (2):196-202.
[3] Piantadosi CA, Zhang J, Leven ED, et al. Apoptosis and delayed neuronal damage after carbon monoxide poisoning in the rat[J]. Exp Neurol,1997,147(1):103-114.
[4] Penney DG. Acute carbon monoxide poisoning: animal models: a review[J].Toxicology,1990,62(2):123-160.
[5] 李俊坤,赵向辉,刘育慧,等.血清c TNI、MYO、CK-MB、NT-pro BNP 水平与一氧化碳中毒患者心肌损伤的相关性分析[J]. 现代中西医结合杂志,2016,25(2):157-159,212.
[6] Geraldo AF,Silva C,Neutel D,et al. Delayed leukoencephalopathy after acute carbon monoxide intoxication[J]. J Radiol Case Rep,2014,8(5):1-8.
[7] 赵洪晶.急性一氧化碳中毒患者心肌损伤状况分析[J].临床合理用药,2014,7(2): 121-122.
[8] Frank A,Bonney M,Bonney S,et al. Myocardial ischemia reperfusion injury:from basic science to clinical bedside [J]. Semin Cardiothorac Vasc Anesth,2012,16(3): 123-132.
[9] 王华萍,朱先存,张爱玲,等.急性一氧化碳中毒治疗前后心电图分析[J].淮海医药,2012,30(1) : 63.
[10] Li Q,Song JJ,Zhang HY,et al. Dexamethasone therapy for preventing delayed encephalopathy after carbon monoxide poisoning[J].Biotech Histochem,2015,8(2): 1-7.
[11] 漆婵.急性一氧化碳中毒对心肌损害的临床分析[J].江西医药,2017,52(2): 138-139.
[12] 寇锋军,王月文.108 例急性一氧化碳中毒患者并发心肌损害分析[J].江苏实用心电学杂志,2013,22(2): 587-590.
[13] 苏娟妮. 急性一氧化碳中毒转归心电图演变观察[J]. 医技与临床基层医学论坛, 2011,15(4):326-327.
[14] 刘亚宏, 刘延梅, 张雪梅,等. 急性一氧化碳中毒高压氧治疗前后的心电图分析[J].实用医技杂志,2006,13(13):2267-2268.
[15] 陈静芳, 赵学辉, 李济宏. 急性一氧化碳中毒对心肌损害的分析[J]. 临床心电学杂志, 2011, 20(3):209-211.
