单宁酸通过选择性抑制表皮生长因子受体特定位点磷酸化抑制肿瘤细胞的增殖
2018-03-20阮海华胡双艳张春晨
阮海华,胡双艳,张春晨,余 龙,张 真
(天津商业大学生物技术与食品科学学院,天津 300134)
表皮生长因子受体(epidermal growth factor receptor,EGFR)是原癌基因c-erbB1的表达产物,是EGFR Her家族成员之一,该家族包括EGFR(ErbB-1)、HER2/c-neu(ErbB-2)、Her 3(ErbB-3)和Her 4(ErbB-4)[1]。表皮生长因子是一个分子质量约为170 kDa的跨膜糖蛋白受体,具有酪氨酸激酶活性。在表皮生长因子(epidermal growth factor,EGF)或者转化生长因子α(transforming growth factor α,TGFα)等的激活下,受体发生二聚化,从而改变了受体的构象,激活酪氨酸激酶活性,催化EGFR的磷酸化激活[2]。EGFR广泛分布在许多正常和恶性上皮细胞中,其过度表达和自我激活可能与许多肿瘤的发生、发展有关[3]。研究表明,头颈部肿瘤[4]、乳腺癌[5]、阴茎鳞状细胞癌[6]以及肺癌[7]等均被发现EGFR的高水平表达。与EGFR蛋白的高表达相比,EGFR的过度磷酸化激活也是导致细胞发生癌变的关键因素之一。基于此,目前针对EGFR的抗癌药物研发主要从2 个方面出发:一方面是专一性识别EGFR的单克隆抗体,这类抗体能够与EGFR专一性结合,封闭EGFR的胞外配体识别表位,竞争性地抑制EGF等配体与EGFR结合以及由此导致的磷酸化激活[8];另一方面是EGFR酪氨酸激酶抑制剂,其通过抑制酪氨酸激酶活性抑制EGFR的磷酸化,进而调控受EGFR磷酸化控制的信号转导途径,抑制癌细胞的增殖[9]。
单宁酸(tannic acid,TA),又称中国单宁、鞣酸、五棓子单宁酸,化学式为C76H52O46,结构如图1所示。一般认为其结构是由葡萄糖的5 个羟基和没食子酰基结合而成的酯,属于水解类单宁,可水解为葡萄糖和没食子酸。单宁酸属于易溶于水的植物多酚类化合物,在红葡萄酒、茶叶、水果中均含量较多,具有抗突变[10]、抗氧化[11]、抗肿瘤[12]、抗菌[13]等生物学活性。近年来,除了自由基清除和抗氧化功能,单宁酸在抗肿瘤方面的功能愈加获得人们的关注[14]。然而,基于单宁酸的结构,其难以通过细胞膜进入细胞,迄今为止,单宁酸实现跨膜信号传递的分子机制仍不清楚。最新的研究发现,单宁酸能够作用于乳腺癌细胞EGFR,诱导乳腺癌细胞发生凋亡[15]。已知EGFR的过表达和过度激活是调控胶质瘤细胞增殖的重要因素。例如,接近40%~50%的胶质瘤细胞被发现EGFR的表达增加和过度激活[16]。因此,本研究以人恶性胶质瘤U87细胞为研究对象,探究单宁酸对人恶性胶质瘤细胞增殖的调控作用,为深入挖掘单宁酸抗肿瘤的药理作用,阐述食品中单宁酸的抗癌功效提供理论依据。
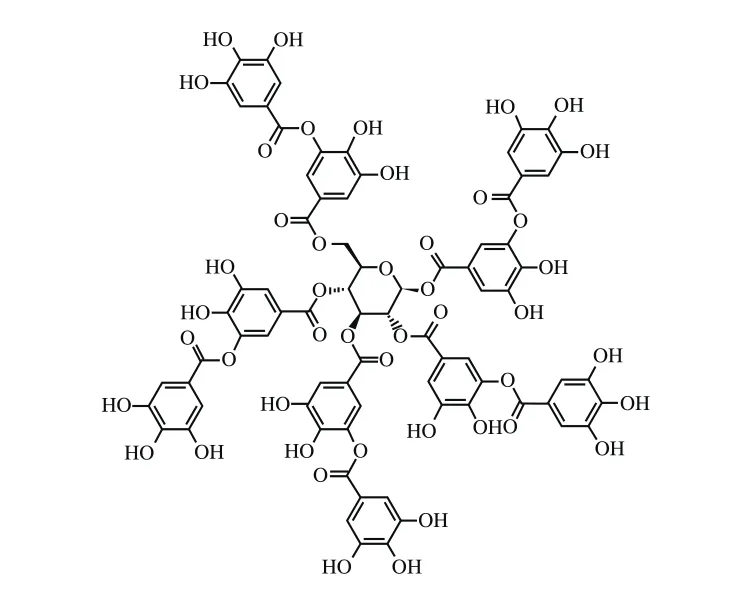
图1 单宁酸的化学结构Fig.1 Chemical structure of tannic acid
1 材料与方法
1.1 材料、培养基与试剂
单宁酸(CAS号1401-55-4,相对分子质量为1 701.20) 美国Sigma-Aldrich公司;人恶性胶质瘤U87细胞由东京大学医学院Inoue教授提供;Gibco胎牛血清 美国Thermo Fisher公司;HyClone™ DMEM高糖培养基 美国GE Healthcare公司;EGF 北京义翘神州生物技术有限公司;PathScan®磷酸化EGFR panTyr三明治酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒、磷酸化EGFR(Tyr845)抗体、磷酸化EGFR(Tyr1068)抗体、磷酸化EGFR(Tyr1045)抗体、磷酸化EGFR(Tyr992)抗体、EGFR抗体、磷酸化胞外信号调节激酶(extracellular signalregulated kinase,ERK)抗体、ERK抗体、磷酸化信号转导与转录激活因子(signal transducer and activator transcription,STAT)1 pY705抗体、STAT3抗体、STAT1抗体 美国Cell Signaling Technology公司;微管蛋白、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白、Bcl-2相关X(Bcl-2 associated X,Bax)蛋白、线粒体电压依赖性阴离子通道(voltage dependent anion channel,VDAC)蛋白、细胞色素c(cytochrome c,Cyt c)、辣根过氧化物酶(horseradish peroxidase,HRP)偶联二抗 美国Santa Cruz Technology公司;电化学发光(electrochemiluminescence,ECL)试剂盒 威格拉斯生物技术(北京)有限公司;G3850 3-(4,5-二甲基吡啶-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺苯基)-2H-四唑(3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium,MTS)细胞增殖试剂盒 美国Promega公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
细胞培养皿等细胞培养耗材 美国Corning公司;HERACELL 150iCO2培养箱 美国Thermo Fisher公司;SpectraMax M5多功能读板机 美国Molecular Device公司;Trans-Blot SD 半干转印槽、聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;AlphaImager Mini凝胶成像系统 美国Protein Simple公司;5430R小型台式高速冷冻离心机 美国Eppendorf公司。
1.3 方法
1.3.1 细胞培养
人恶性胶质瘤U87细胞培养于含体积分数10%胎牛血清的DMEM培养基(完全培养基)中,并置于37 ℃、5% CO2、饱和湿度的培养箱中培养,以0.25 g/100 mL胰蛋白酶消化传代。当单层细胞融合度达到70%~80%时进行单宁酸处理。处理培养基为完全培养基内含相应浓度单宁酸(40、80、120 μmol/L),每组3 个复孔,培养24、48、72 h后,用细胞刮刀刮取细胞,并收集至离心管中。
1.3.2 人恶性胶质瘤U87细胞增殖能力的测定
人恶性胶质瘤U87细胞以6×104个/mL的浓度接种于96 孔板内,每孔100 μL培养基。24 h后吸弃培养基,分别加入100 μL含不同浓度单宁酸(40、80、120 μmol/L)的完全培养基,每组3 个复孔,分别培养24、48、72 h。采用MTS细胞增殖试剂盒根据OD490nm测定细胞增殖能力,细胞存活率按下式计算。

1.3.3 人恶性胶质瘤U87细胞EGFR酪氨酸位点磷酸化水平的测定
获取引发式语料的方法主要有口头报告、角色扮演、话语补全任务、多项选择任务、分级任务、访谈和日记等。下面逐一介绍这些方法,重在讲明它们各自的适用范围和所针对的目标语料,因为只有明确了每种方法能做什么和不能做什么,善做什么和不善做什么,才能根据具体研究问题选择具体研究工具,才能发挥每种工具的最大效用,做到对症下药,有的放矢。
将单宁酸处理后的细胞按照PathScan®磷酸化EGFR(panTyr)三明治ELISA试剂盒的说明书进行总酪氨酸磷酸化水平的检测。
1.3.4 亚细胞组分(线粒体、细胞胞浆)的分离
经单宁酸处理后人恶性胶质瘤U87细胞的亚细胞组分的分离参照文献[17]的方法进行。
1.3.5 蛋白质印记法
检测人恶性胶质瘤U87细胞EGFR Y884、Y992、Y1068以及Y1172位点的磷酸化水平,细胞凋亡相关蛋白Bax、Bcl-2以及Cyt c等均采用蛋白质印记法。细胞处理方法同1.3.1节,收集细胞,参照文献[18]的方法制备蛋白,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)后转膜,用5%脱脂乳粉封闭。将一抗按照体积比1∶1 000稀释后于4 ℃孵育过夜。以TBST(tris buffered saline with Tween)溶液洗涤3 次后加入体积比1∶2 000稀释的二抗,室温孵育1 h。采用ECL试剂显影曝光后洗X光片,利用Alpha Imager Mini凝胶成像系统测定条带的灰度值,利用灰度值表征条带的强度。
1.4 数据处理
采用SPSS V18.0软件进行单因素方差分析,同时通过the Student’s t检验进行组间比较,以P<0.05为差异显著,P<0.01为差异极显著。所有实验结果至少重复3 次,用平均值±标准差表示。
2 结果与分析
2.1 单宁酸对人恶性胶质瘤U87细胞增殖活性的影响
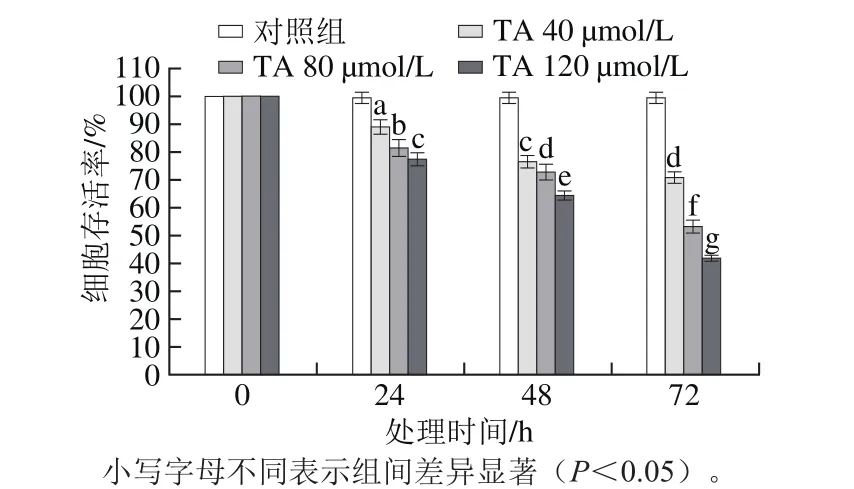
图2 单宁酸对人恶性胶质瘤U87细胞增殖活性的影响Fig.2 Effect of tannic acid on the proliferation of human glioma U87 cells
通过MTS细胞增殖检测试剂盒检测单宁酸对人恶性胶质瘤U87细胞增殖的影响,结果如图2所示。与未处理的对照组细胞相比,40 μmol/L的单宁酸处理24 h后,显著诱导人恶性胶质瘤U87细胞的死亡(P<0.05),并且细胞死亡的比率随着单宁酸处理时间的延长(48~72 h)以及单宁酸浓度的升高(80~120 μmol/L)而升高,呈现显著的时间-效应和剂量-效应关系。即单宁酸的浓度越高、处理时间越长,人恶性胶质瘤U87细胞的死亡率越高,这与Darvin等[15]发现单宁酸能够抑制乳腺癌细胞增殖的结果类似。结果表明,单宁酸能够抑制人恶性胶质瘤细胞的增殖,抗肿瘤效果显著。
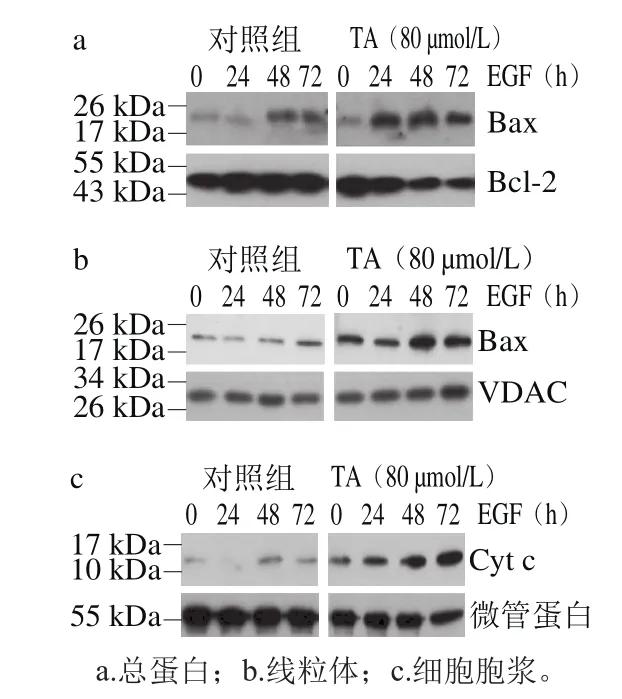
图3 单宁酸对人恶性胶质瘤U87细胞凋亡调控蛋白的影响Fig.3 Effect of tannic acid on apoptosis-related proteins in human glioma U87
由图3可知,与对照组相比,80 μmol/L单宁酸处理显著促进人恶性胶质瘤U87细胞Bax蛋白的表达,抑制Bcl-2蛋白的表达。进一步对2 种蛋白的条带灰度进行扫描后计算Bax/Bcl-2的比值,结果如图4所示。
80 μmol/L单宁酸处理24~72 h后,提高了Bax/Bcl-2的比值,与对照组相比差异极显著(P<0.01)。单宁酸处理48 h,Bax/Bcl-2比值被提高接近至7.3 倍。Bax/Bcl-2比值是表征细胞凋亡的重要指标之一,当Bax/Bcl-2比值升高时,暗示细胞凋亡的发生[19]。同时,进一步分离细胞的线粒体和细胞胞浆2 个组分发现,单宁酸处理提高了线粒体Bax蛋白的水平,同时促进了Cyt c向细胞胞浆中分泌[20]。因此推测,单宁酸抑制人恶性胶质瘤U87细胞的增殖可能与单宁酸处理诱导肿瘤细胞发生凋亡有关。
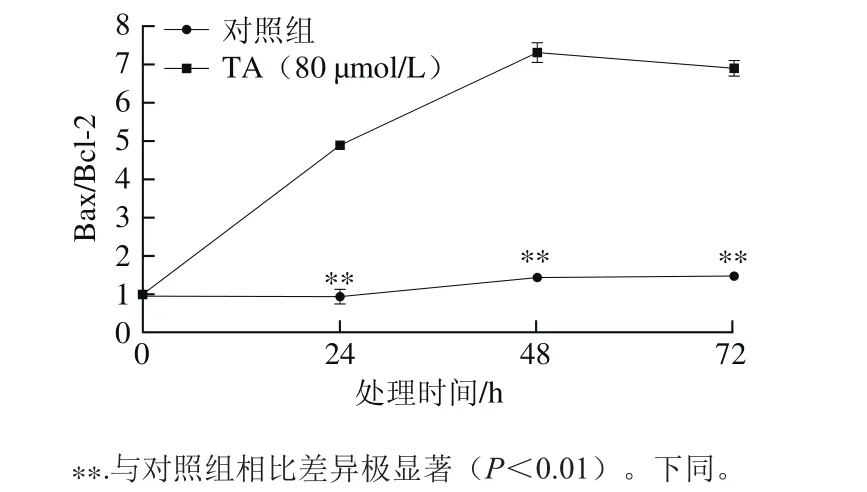
图4 单宁酸处理对人恶性胶质瘤U87细胞总Bax/Bcl-2比值的影响Fig.4 Effect of tannic acid on Bax/Bcl-2 ratio in human glioma U87 cells
2.2 单宁酸选择性抑制人恶性胶质瘤U87细胞EGFR特定位点的磷酸化
与EGFR蛋白的高表达相比,EGFR的磷酸化激活是导致细胞癌变、促进癌细胞增殖的重要因素[21]。为了研究单宁酸对人恶性胶质瘤U87细胞EGFR磷酸化的调控作用,本研究利用通路扫描磷酸化EGFR三明治ELISA试剂盒检测了EGFR总磷酸化水平,结果如图5所示。
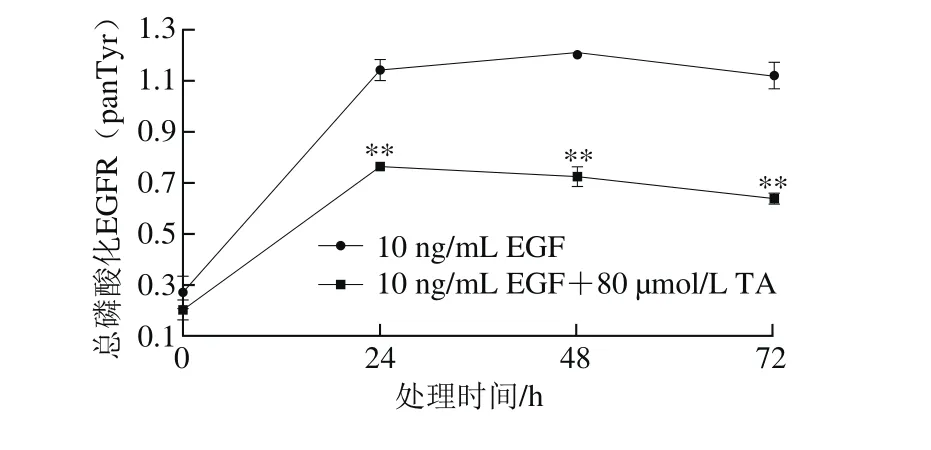
图5 单宁酸对人恶性胶质瘤U87细胞EGFR总磷酸化水平的影响Fig.5 Effect of tannic acid on the whole phosphorylation of EGFR in human glioma U87 cells
80 μmol/L单宁酸处理24 h后极显著降低了经表皮生长因子诱导的EGFR磷酸化水平,并且随着处理时间的延长,单宁酸对EGFR磷酸化的抑制程度更加显著。结果表明,单宁酸抑制人恶性胶质瘤U87细胞EGFR总酪氨酸位点的磷酸化水平。
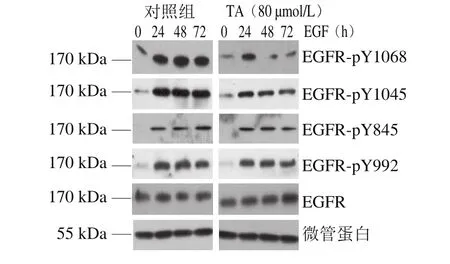
图6 单宁酸对人恶性胶质瘤U87细胞EGFR特定位点磷酸化的影响Fig.6 Site-specif i c effect of tannic acid on EGFR phosphorylation in human glioma U87 cells
鉴于EGFR不同位点的磷酸化与不同的信号转导通路相偶联,因此,为了进一步深入研究单宁酸的抗肿瘤功能,实验筛选出EGFR的Y845、Y992、Y1068和Y1045这4 个具有代表性的位点,并检测了单宁酸对EGFR单一位点磷酸化的影响。
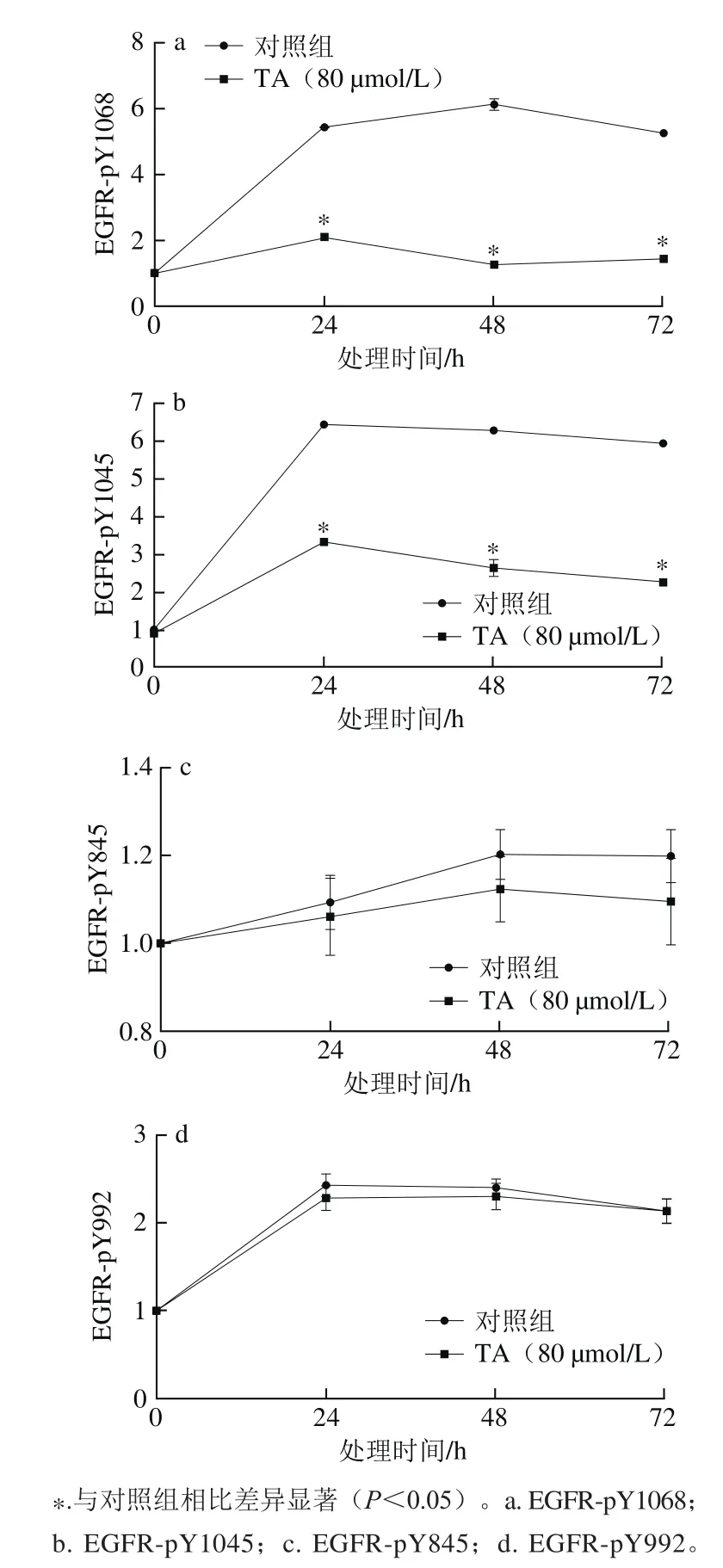
图7 Western-Blot灰度扫描定量分析单宁酸对EGFR特定位点磷酸化的影响Fig.7 Quantitative analysis of tannic acid on site-specif i c phosphorylation of EGFR in human glioma U87 cells by western blot
由图6~7可知,单宁酸处理显著抑制了EGFR Y1045以及Y1068位点的磷酸化,但是对EGFR Y845以及Y992位点的磷酸化影响不大。结果表明,单宁酸抑制人恶性胶质瘤U87细胞EGFR的磷酸化具有位点选择性。
2.3 单宁酸对人恶性胶质瘤U87细胞ERK和STAT1/3信号转导途径的影响
已有研究表明,EGFR不同位点的磷酸化与不同的下游信号转导通路相偶联,例如EGFR Y1045位点的磷酸化介导STAT1/3的磷酸化,进而激活受STAT1/3调控的信号转导通路[22];EGFR/ERK信号通路是控制细胞增殖的重要途径,其过量表达与激活易导致肿瘤的发生与发展[9]。而EGFR Y1068位点的磷酸化能够招募生长因子受体结合蛋白2(growth factor receptor-bound protein 2,Grb2)蛋白,激活MAPK/ERK的磷酸化[23]。因此,为了进一步验证单宁酸对EGFR特定位点的磷酸化调节作用,实验利用单宁酸处理人恶性胶质瘤U87细胞后,检测STAT1/3以及ERK的磷酸化激活情况。
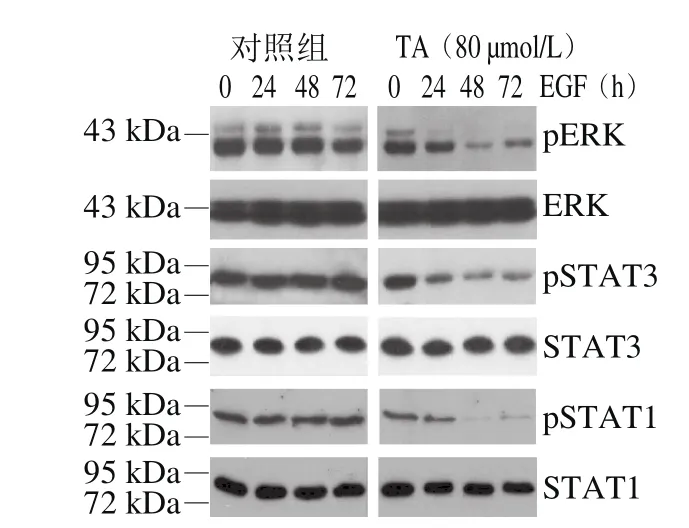
图8 单宁酸对人恶性胶质瘤U87细胞ERK以及STAT1/3磷酸化的影响Fig.8 Effect of tannic acid on the phosphorylation of ERK and STAT1/3 in human glioma U87 cells
由图8可知,单宁酸显著抑制了ERK、STAT1以及STAT3的磷酸化,这与单宁酸抑制EGFR Y1068和Y1045的磷酸化结果一致。结果表明,单宁酸通过抑制EGFR特异位点的磷酸化进而抑制了由该位点介导的下游信号转导分子的磷酸化。
3 讨 论
植物多酚的抗肿瘤活性己被广泛认可,大量研究证实,许多植物多酚(如白藜芦醇、姜黄素、原花青素、表没食子儿茶素没食子酸酯、槲皮素等)[24]可以通过干扰或阻断肿瘤细胞的信号通路进而调节其下游效应分子的表达,从而加速肿瘤细胞周期、促进细胞凋亡和抑制细胞增殖,达到抗肿瘤的作用。植物单宁酸也能够通过多种信号通路发挥其抗肿瘤作用[25]。然而,单宁类物质如何实现跨膜的信号传递一直不清楚。虽然,Darvin等[15]的研究表明,单宁酸可能通过调控EGFR的磷酸化发挥其抗肿瘤作用。但是,目前已经报道的EGFR发生磷酸化激活的位点有多个,主要包括Y845、Y992、Y1045、Y1068、Y1148、Y1173以及Y1086等,且每一个酪氨酸位点的生物学功能均不同[26]。本研究发现,单宁酸显著抑制了由EGF诱导的EGFR全位点的磷酸化水平,但是该抑制作用具有明显的选择性,单宁酸能够选择性抑制EGFR Y1045和Y1068位点的磷酸化,而对Y845和Y992的影响不大。
EGFR蛋白主要包括3 个结构域:从NH2端至第621位氨基酸残基的胞外区、从621位至644位氨基酸残基的跨膜结构域以及从644至C末端共计542 个氨基酸残基的胞内区。TGFα与EGFR结合后,即EGFR主要以背靠背的方式发生二聚化(图9a、b中A和B),而配体TGFα结合于二聚体的外侧(图9a、b中C和D)[27],二聚化的EGFR在其C末端胞内区发生磷酸化激活,调控下游信号转导途径。Darvin等[15]利用Autodock vina分子模拟软件,将EGFR胞外区与单宁酸进行分子对接,结果如图10所示,单宁酸能够与EGFR胞外区结合,并预测单宁酸的结合位点为EGFR上ATP结合位点。
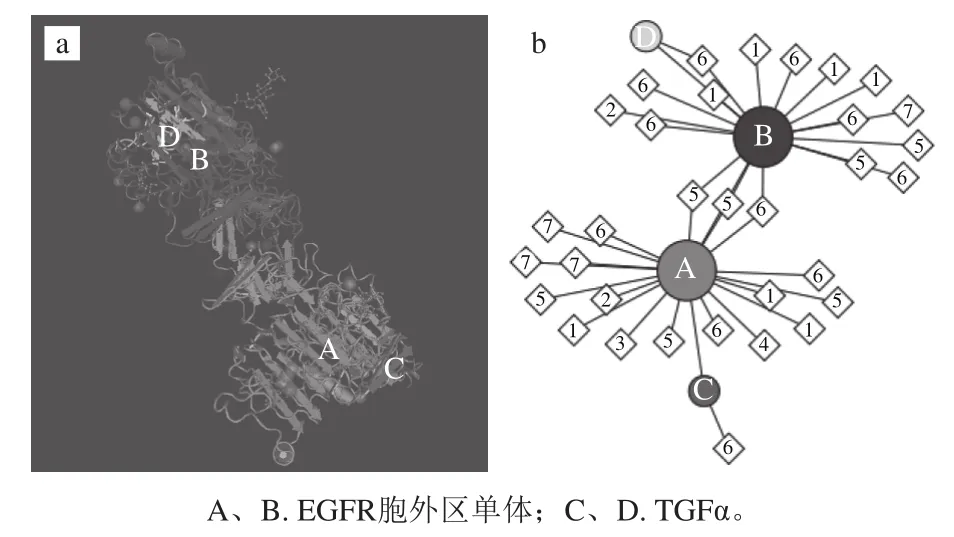
图9 EGFR胞外区与TGFα结合后形成二聚体的蛋白质晶体结构图(a)和分子互作示意图(b)[27]Fig.9 Crystal structure of dimerized human EGFR extracellular domain when binding to TGFα ligand (a) and diagram of EGFR and TGFα interaction (b)[27]
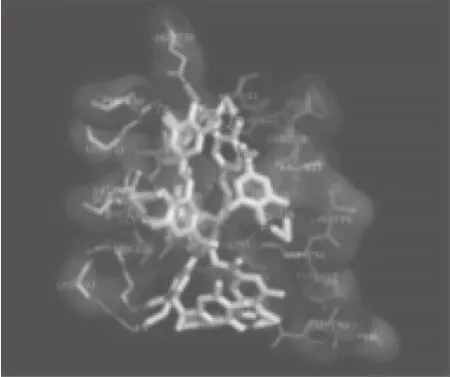
图10 单宁酸与EGFR胞外区结合结构图[15]Fig.10 Schematic of tannic acid binding to EGFR extracellular domain[15]
据此,推测单宁酸抑制EGFR的磷酸化可能有两个方面的原因:一方面,单宁酸竞争性地与EGFR结合改变EGFR的构象,单宁酸属于多酚类物质,多酚可通过疏水键向蛋白质分子表面靠近,多酚分子进入疏水袋,然后发生多点氢键与蛋白质结合,促使蛋白质被凝固[14],改变其在细胞膜上的流动性,进而抑制了EGFR的生物学活性,例如EGFR胞内区的磷酸化,这解释了单宁酸对EGFR总磷酸化水平的抑制作用;另一方面,通过检索文献发现,与图10预测的单宁酸与EGFR相互作用类似,治疗小细胞肺癌的药物吉非替尼[28]和厄洛替尼[29]也是通过与ATP竞争结合EGFR酪氨酸激酶区,阻止EGFR的自磷酸化,从而抑制受EGFR调控的信号通路,最终达到抑制肿瘤增殖的作用。据此推测,单宁酸对STAT1/3信号通路的抑制作用可能是由于单宁酸与EGFR结合后,抑制了EGFR的自磷酸化,而该自磷酸化的抑制会导致Janus酪氨酸激酶(Janus tyrosine kinase,Jak)2活性受到抑制,而Jak2是负责STAT蛋白磷酸化的主要蛋白激酶之一[10]。而单宁酸对MAPK/ERK信号通路的抑制作用可能是由于单宁酸抑制了EGFR Y1068的磷酸化,导致Y1068位点专一性Grb2蛋白至EGFR的招募受到抑制,与EGFR-Grb2结合ERK蛋白减少,ERK的磷酸化受到抑制。当利用外源单宁酸处理细胞时,单宁酸直接作用于EGFR的胞外区。因此,单宁酸与EGFR胞外区结合后有很大的可能性会引起EGFR特定构象变化,该构象的变化引起EGFR部分酪氨酸位点发生旋转扭曲,进而导致该位点的磷酸化受到抑制。而受单宁酸调控的EGFR的构象变化还需要进一步深入研究。
除了诱导肿瘤细胞增殖外,单宁酸已经被用于很多疾病的治疗中。例如Mori等[30]利用30 mg/kg(以体质量计,下同)的TA能够阻止阿兹海默症引起的细胞损伤;40 mg/kg的TA对抗癌药物顺铂引起的细胞毒性具有保护作用[31];25 mg/kg的TA对对乙酰氨基酚(acetaminophen)引起的大鼠肝细胞毒性具有保护作用[32]。而本研究中,40 μmol/L单宁酸(相当于68 μg/mL血药浓度)即对细胞增殖起到显著的抑制作用,进一步表明单宁酸在抑制肿瘤细胞增殖中应用的可行性,为挖掘植物多酚的抗肿瘤功能,开发植物多酚类抗肿瘤保健食品或药物提供理论基础。
[1] RYU J W, CHOE S, RYU S H, et al. Paradoxical induction of growth arrest and apoptosis by EGF via the up-regulation of PTEN by activating Redox factor-1/Egr-1 in human lung cancer cells[J].Oncotarget, 2016, 8(3): 4181-4195. DOI:10.18632/oncotarget.13809.
[2] WONG A J, RUPPERT J M, BIGNER S H, et al. Structural alterations of the epidermal growth factor receptor gene in human gliomas[J].Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(7): 2965-2969.
[3] HANAHAN D, WEINBERG R A. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.4161/rna.20481.
[4] LEEMANS C R, BRAAKHUIS B J, BRAKENHOFF R H. The molecular biology of head and neck cancer[J]. Nature Reviews Cancer,2011, 11(1): 9-22. DOI:10.1038/nrc2982.
[5] DAI H, GALLAGHER D, SCHMITT S, et al. Role of miR-139 as a surrogate marker for tumor aggression in breast cancer[J]. Human Pathology, 2017, 61: 68-77. DOI:10.1016/j.humpath.2016.11.001.
[6] PETA E, CAPPELLESSO R, MASI G, et al. Down-regulation of microRNA-146a is associated with high-risk human papillomavirus infection and epidermal growth factor receptor overexpression in penile squamous cell carcinoma[J]. Human Pathology, 2016, 61: 33-40. DOI:10.1016/j.humpath.2016.10.019.
[7] XU C R, ZHONG W Z, ZHOU Q, et al. Heterogeneity of the resistance to gef i tinib treatment in a non-small cell lung cancer patient with active epidermal growth factor receptor mutation[J]. Thoracic Cancer, 2016, 8(1): 51-53. DOI:10.1111/1759-7714.12382.
[8] GUEERRAB A E I, BAMDAD M, BIGNON Y J, et al. Anti-EGFR monoclonal antibodies enhance sensitivity to DNA-damaging agents in BRCA1-mutated and PTEN-wild-type triple-negative breast cancer cells[J]. Molecular Carcinogenesis, 2016, 56(5): 1383-1394.DOI:10.1002/mc.22596.
[9] CHENG L, ZHANG S, ALEXANDER R, et al. The landscape of EGFR pathways and personalized management of non-small-cell lung cancer[J]. Future Oncology, 2011, 7(4): 519-541. DOI:10.2217/fon.11.25.
[10] PARK J H, DARVIN P, LIM E J, et al. Hwanggeumchal sorghum induces cell cycle arrest, and suppresses tumor growth and metastasis through Jak2/STAT pathways in breast cancer xenografts[J]. PLoS ONE, 2012, 7(7): 1-13. DOI:10.1371/journal.pone.0040531.
[11] TOMAS-BARBERAN F A, SELMA M V, ESPÍN J C, et al.Interactions of gut microbiota with dietary polyphenols and consequences to human health[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2016, 19(6): 471-476. DOI:10.1097/MCO.0000000000000314.
[12] TATULLO M, SIMONE G M, TARULLO F, et al. Antioxidant and antitumor activity of a bioactive polyphenolic fraction isolated from the brewing process[J]. Scientif i c Reports, 2016, 6: 1-7. DOI:10.1038/srep36042.
[13] TALEB H, MADDOCKS S E, MORRIS R K, et al. The Antibacterial activity of date syrup polyphenols against S. aureus and E. coli[J].Frontiers in Microbiology, 2016, 7: 1-9. DOI:10.1038/srep36042.
[14] SHIN S Y, YOON H, AHN S, et al. Structural properties of polyphenols causing cell cycle arrest at G1 phase in HCT116 human colorectal cancer cell lines[J]. International Journal of Molecular Sciences, 2013, 14(8): 16970-16985. DOI:10.3390/ijms140816970.
[15] DARVIN P, JOUNG Y H, KANG D Y, et al. Tannic acid inhibits EGFR/STAT1/3 and enhances p38/STAT1 signalling axis in breast cancer cells[J]. Journal of Cellular and Molecular Medicine, 2017,21(4): 720-734. DOI:10.1111/jcmm.13015.
[16] NISHIKAWA R, JI X D, HARMON R C, et al. A mutant epidermal growth factor receptor common in human glioma confers enhanced tumorigenicity[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(16): 7727-7731.
[17] WEST A P, BRODSKY I E, RAHNER C, et al. TLR signalling augments macrophage bactericidal activity through mitochondrial ROS[J]. Nature, 2011, 472: 476-480. DOI:10.1038/nature09973.
[18] RUAN H H, ZHANG Z, TIAN L, et al. The Salmonella effector SopB prevents ROS-induced apoptosis of epithelial cells by retarding TRAF6 recruitment to mitochondria[J]. Biochemical and Biophysical Research Communications, 2016, 478(2): 618-623. DOI:10.1016/j.bbrc.2016.07.116.
[19] UM H D. Bcl-2 family proteins as regulators of cancer cell invasion and metastasis: a review focusing on mitochondrial respiration and reactive oxygen species[J]. Oncotarget, 2016, 7(5): 5193-5203.DOI:10.18632/oncotarget.6405.
[20] BURRI S H, KIM C N, FANG G, et al. ‘Loop’ domain deletional mutant of Bcl-xL is as effective as p29Bcl-xL in inhibiting radiationinduced cytosolic accumulation of cytochrome c (cyt c), caspase-3 activity, and apoptosis[J]. International Journal of Radiation Oncology,Biology, Physics, 1999, 43(2): 423-430.
[21] TANG N, ZHANG Q Q, FANG S, et al. Anti-tumor activity of highdose EGFR tyrosine kinase inhibitor and sequential docetaxel in wild type EGFR non-small cell lung cancer cell nude mouse xenografts[J].Oncotarget, 2016, 8(6): 9134-9143. DOI:10.18632/oncotarget.13327. 22.
[22] ZULKIFLI A A, TAN F H, PUTOCZKI T L, et al. STAT3 signaling mediates tumour resistance to EGFR targeted therapeutics[J].Molecular and Cellular Endocrinology, 2017, 451: 15-23.DOI:10.1016/j.mce.2017.01.010.
[23] BAUMDICK M, BRGUUEMANN Y, SCHMICK M, et al. EGF-dependent re-routing of vesicular recycling switches spontaneous phosphorylation suppression to EGFR signaling[J]. eLife, 2015, 4:e12223. DOI:10.18632/oncotarget.13809.24.
[24] 石芳, 廖霞, 李瑶, 等. 植物多酚通过PI3K/Akt信号通路抗肿瘤作用研究进展[J]. 食品科学, 2016, 37(15): 259-264. DOI:10.7506/spk xl002-6630-201615044.201615044.
[25] 张小利, 王慧清, 张月巧, 等. 植物多酚通过Wnt/β-catenin信号通路抗肿瘤作用研究进展[J]. 食品科学, 2015, 36(5): 227-232.DOI:10.7506/spkx1002-6630-201505042.
[26] MORANDELL S, STASYK T, SKVORTSOV S, et al. Quantitative proteomics and phosphoproteomics reveal novel insights into complexity and dynamics of the EGFR signaling network[J].Proteomics, 2008, 8(21): 4383-4401. DOI:10.1002/pmic.200800204.
[27] GARRETT T P, MCKERN N M, LOU M, et al. Crystal structure of a truncated epidermal growth factor receptor extracellular domain bound to transforming growth factor alpha[J]. Cell, 2002, 110(6): 763-773.
[28] MASSA A, ANTUNES A, VARELA P. Pyogenic granuloma in a patient on gefitinib[J]. Acta Medica Portuguesa, 2016, 29(6): 416.DOI:10.20344/amp.6343.
[29] ZHAO C H, LIN L, LIU J Z, et al. A phase Ⅱ study of concurrent chemoradiotherapy and erlotinib for inoperable esophageal squamous cell carcinoma[J]. Oncotarget, 2016, 7(35): 57310-57316.DOI:10.18632/oncotarget.9809.
[30] MORI T, REZAI-ZADEH K, KOYAMA N, et al. Tannic acid is a natural beta-secretase inhibitor that prevents cognitive impairment and mitigates Alzheimer-like pathology in transgenic mice[J]. The Journal of Biological Chemistry, 2012, 287(9): 6912-6927. DOI:10.1074/jbc.M111.294025.
[31] AKOMOLAFE S F, AKINYEMI A J, ANADOZIE S O. Phenolic acids (gallic and tannic acids) modulate antioxidant status and cisplatin induced nephrotoxicity in rats[J]. International Scholarly Research Notices, 2014, 2014: 1-8. DOI:10.1155/2014/984709.
[32] MITTAL D K, JOSHI D, SHUKLA S. Protective effects of Polygonum bistorta (Linn.) and its active principle against acetaminophen induced toxicity in rats[J]. Asian Journal of Biological Sciences, 2010, 1: 951-958. DOI:10.1016/j.toxlet.2011.05.809.
