转谷氨酰胺酶诱导调质大豆分离蛋白凝胶的水分分布及凝胶特性
2018-03-20田海娟胡耀辉于寒松王玉华朴春红刘俊梅代伟长刘景圣
田海娟,胡耀辉*,于寒松,王玉华,朴春红,刘俊梅,代伟长,刘景圣
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.吉林工商学院 粮油食品深加工吉林省高校重点实验室,吉林 长春 130507;3.国家大豆产业技术体系研发中心加工实验室,吉林 长春 130118;4.小麦和玉米深加工国家工程实验室,吉林 长春 130118)
大豆分离蛋白是一种在食品工业中普通使用的植物蛋白,其含有两种主要的蛋白,分别为11S大豆球蛋白与7S伴大豆球蛋白,分别占总蛋白质量的40%与30%[1-3]。蛋白中11S与7S比例不同,会影响蛋白凝胶过程中的交联,进而对凝胶的水分分布与凝胶特性产生影响。Nakamura等[4]研究发现,在pH 7.6、0.4 mol/L NaCl溶液条件下,7S和11S球蛋白凝胶形成的最低质量分数分别为7.5%与2.5%,11S球蛋白凝胶的硬度比7S球蛋白凝胶的大。转谷氨酰胺酶可以使大豆蛋白质中的赖氨酸残基与谷氨酸残基发生转酰基反应,从而形成ε-(γ-谷氨酰基)赖氨酸键,致使蛋白之间发生交联聚合,酶反应过程比较温和,形成凝胶不需要通过加热、改变pH值和离子强度,可以避免乳液的显著失稳[5-6],目前对于转谷氨酰胺酶诱导11S与7S不同比例的调质大豆分离蛋白凝胶的水分分布与凝胶特性鲜有报道。本实验以调质大豆分离蛋白为原料,用转谷氨酰胺酶诱导蛋白凝胶,通过低场核磁共振和质构分析等,研究不同组成的大豆分离蛋白凝胶的横向弛豫时间(T2)、质构特性、热稳定性及微观结构的变化,以揭示调质大豆分离蛋白凝胶的形成机理,为调质大豆分离蛋白凝胶的工业化应用提供参考。
1 材料与方法
1.1 材料与试剂
黑河53号大豆 黑龙江省农业科学院黑河分院;商用大豆分离蛋白 山东万德福实业集团有限公司。
大豆转谷氨酰胺酶(20 U/g) 泰兴市东圣食品科技有限公司;3595Q Marker(分子质量为6.5~100.0 kDa) 日本Takara公司;甘油、丙烯酰胺、甲叉丙烯酰胺、过硫酸铵、Tris、四甲基乙二胺、尿素北京鼎国昌盛生物技术有限责任公司;CuSO4、K2SO4、H2SO4、硼酸、甲基红、溴甲酚氯、冰醋酸、HCl、NaOH 北京化工厂;考马斯亮蓝试剂盒 北京索莱宝科技有限公司。
1.2 仪器与设备
3K15型高速冷冻离心机 美国Sigma公司;Delta 320型数显pH计、ME54E/204E型分析天平 梅特勒-托利多仪器(上海)有限公司;DYCZ-26B电泳仪电泳槽北京六一生物科技有限公司;凝胶成像仪 美国伯乐公司;NMR PQ001低场核磁测定仪 上海纽迈电子有限公司;Phenom ProX台式扫描电子显微镜 复纳科学仪器(上海)有限公司;Inf i nite 200酶标仪 瑞士TECAN公司;1-2真空冷冻干燥箱 德国Christ公司;TA-XT plus质构仪 英国Stable Micro Systems公司;85-Ⅱ型磁力搅拌器 杭州仪表电机有限公司;Q20型差示扫描量热(differential scanning calorimetry,DSC)仪 美国TA公司;K1100全自动凯氏定氮仪 济南海能仪器股份有限公司。
1.3 方法
1.3.1 大豆分离蛋白的制备
大豆粉碎过100 目筛,大豆粉与丙酮以1∶3(m/V)比例混合搅拌脱脂,制备脱脂大豆粉;脱脂大豆粉按照1∶10(m/V)比例加入蒸馏水,磁力搅拌1 h,用2 mol/L NaOH溶液调节pH值至9.0,磁力搅拌2 h,4 ℃、9 400×g离心30 min,取上清液,用1 mol/L HCl溶液调节上清液的pH值为4.5,10 ℃、3 800×g离心20 min,取沉淀,将沉淀重新分散于蒸馏水中,再用2 mol/L NaOH溶液调节pH值至7.5。放于4 ℃冰箱,去离子水透析24 h,期间换水4 次,透析完成后蛋白溶液冻干即得到大豆分离蛋白[7-8],通过凯氏定氮方法测定提取分离蛋白的纯度为88.62%。
1.3.2 11S球蛋白的制备
将1.3.1节中制备的脱脂大豆粉,按照1∶10(m/V)的比例加入蒸馏水,磁力搅拌1 h,4 ℃、9 400×g离心30 min,取上清液,用1 mol/L HCl溶液调节pH值至6.5,4 ℃冰箱中过夜,4 ℃、9 400×g离心20 min,取沉淀,溶于去离子水,透析24 h,期间换水4 次,透析完成后蛋白溶液冻干即得到大豆11S球蛋白样品[9],通过凯氏定氮法测定提取11S球蛋白样品的纯度为83.68%。
1.3.3 SDS-PAGE样品处理
取0.5 g大豆分离蛋白粉末溶于50 mL去离子水中,用考马斯亮蓝试剂盒测定蛋白溶液质量浓度,在此基础上将蛋白溶液质量浓度调整为3 mg/mL。制备12%的分离胶,5%的浓缩胶。样品处理:10 μL蛋白样品溶液溶于10 μL十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)样品缓冲液(0.125 mol/L Tris-HCl缓冲液,含1% SDS、2%巯基乙醇、5%甘油和0.025%溴酚蓝),电泳前煮沸4 min。上样量为5 μL,凝胶电泳在恒压模式下进行,电压为120 V。经过染色脱色后,用凝胶成像仪观察凝胶片,用Image Lab 5.2.1软件定性定量分析样品的11S与7S蛋白的比例[10-12]。
1.3.4 调质大豆分离蛋白样品的制备
由1.3.1与1.3.2节方法提取出的大豆分离蛋白、11S球蛋白,根据1.3.3节方法计算2 种蛋白质中11S球蛋白的质量分数,将11S球蛋白加入大豆分离蛋白中,或将53号大豆分离蛋白加入提取的11S球蛋白中,将待测大豆分离蛋白样品中11S球蛋白的质量分数分别调整为60%、70%、80%。
1.3.5 转谷氨酰胺酶催化制备调质大豆分离蛋白凝胶
调质后大豆分离蛋白分散于蒸馏水中,制备成质量分数13%的乳液,蛋白溶液中加入20 U/g的转谷氨酰胺酶,快速搅拌,再将蛋白溶液置于水浴锅中,60℃保温45 min后,4 ℃冷藏过夜,待测。
1.3.6 NMR自旋-自旋弛豫时间测定
蛋白凝胶弛豫时间测试条件:共振频率23.137 MHz,磁体强度0.55 T,线圈直径为15 mm,磁体温度为32 ℃;按照1.3.5节方法制备的凝胶样品放入直径为15 mm的核磁管,核磁管放入磁体腔中心处测试。自旋-自旋弛豫时间T2用Carr-Purcell-Mebiboom-Gill(CPMG)序列进行测量。测试参数为:回波时间100 μs,8 000 个回波,重复扫描32 次,重复扫描间隔时间为3 000 ms,得到的信号衰减曲线为指数衰减曲线。利用核磁共振弛豫时间反演拟合软件Ver 4.09进行反演[13]。
1.3.7 调质大豆分离蛋白凝胶质构特性测定
将1.3.5节方法制备的不同蛋白凝胶样品从4 ℃冰箱中取出,室温平衡30 min,切成2.5 cm×1.0 cm的圆柱体。利用质构仪检测蛋白凝胶样品的质构特征。参数设定:探头型号P/0.5,测试前速率1 mm/s,测试速率5 mm/s,测中速率与测后速率均为5 mm/s,位移7.5 mm,触发力5.0 g[14]。
1.3.8 调质大豆分离蛋白凝胶DSC测定
称取1.3.5节步骤制备的凝胶冻干样品5.0 mg放在铝盒中压片,氮气流速为20 mL/min,扫描温度20~80 ℃,升温速率为3 ℃/min,得到测试的DSC曲线[15]。
1.3.9 调质大豆分离蛋白凝胶微观结构观察
按照1.3.5节步骤制备的凝胶,切成厚度低于2 mm的薄片,加入0.1 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)、2.5%戊二醛溶液固定24 h,倒掉固定液,再用0.1 mol/L PBS浸洗2 次,每次30 min;用30%、50%、70%、90%乙醇进行梯度洗脱,每次1 h;最后用100%乙醇洗脱3 次,每次1 h;真空冻干后,真空条件下镀金,扫描电子显微镜观察[16-18]。
1.4 数据处理
实验数据使用SPSS 16.0软件单因素方差分析与Origin 7.5软件进行处理与分析。
2 结果与分析
2.1 SDS-PAGE测定结果
通过Image Lab 5.2.1分析SDS-PAGE结果(图1),获得调质后蛋白质组成的比例。从黑河53号大豆中提取总蛋白,其11S球蛋白质量分数为55.17%。对提取的大豆分离蛋白中的11S球蛋白的质量分数进行调整,制备调质大豆分离蛋白,通过Image Lab 5.2.1软件分析。
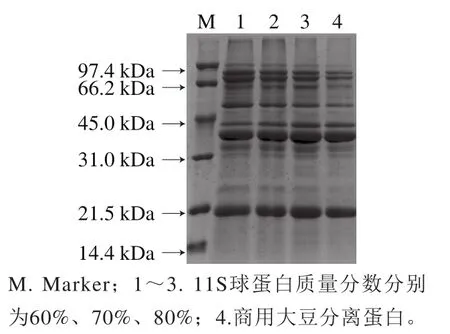
图1 调质大豆分离蛋白样品组成的SDS-PAGE分析Fig.1 SDS-PAGE analysis of modif i ed SPI samples
2.2 调质大豆分离蛋白样品转谷氨酰胺酶酶诱导凝胶中T2水分分布及迁移的影响

图2 调质大豆分离蛋白样品凝胶水分分布的变化Fig.2 Changes in moisture distribution of TGase-induced SPI gels with various glycinin contents
如图2所示,调质大豆分离蛋白样品凝胶中水分分布与凝胶中11S球蛋白的比例有关系。测试蛋白凝胶中水分分布在0.1~1 000.0 ms之间,实验样品出现3 个特征峰,其中T21(0.1~35.0 ms)区间是蛋白质分子中极性基团与水以氢键键合的水,结合比较紧密,该区间的水被认为是结合水[19-20];T22(35~180 ms)区间为蛋白质分子中的酰胺基与水以较小键能结合,为蛋白凝胶中多分子层水,与蛋白结合程度相对较差,是被凝胶网络结构束缚的水分,被认为是不易流动的水;T23(180~1 000 ms)区间为自由水,即蛋白样品凝胶过程中未束缚进网络结构的水,附着于蛋白凝胶的表面。实验蛋白凝胶样品是在相同质量下所测得水分分布变化,从图2中可知,随着11S球蛋白在蛋白样品中的比例提高,其弛豫时间向左偏移,即随着11S球蛋白质量分数提高,短弛豫时间内结合的H质子增多,被凝胶束缚在网络结构中的结合水结合的更加紧密。

表1 不同调质蛋白凝胶聚集体水分的变化Table1 Changes in moisture distribution of TGase-induced SPI gels with various glycinin contents
T21区间代表结合水,对于蛋白凝胶的组成具有实际意义。由表1可知,当11S球蛋白的质量分数由60%提高到70%,蛋白凝胶结合的H质子的量提高,当11S球蛋白的质量分数提高到80%时,蛋白凝胶结合的H质子的量急剧减少,这一结果表明,蛋白组成中11S与7S比例对凝胶中结合H质子的能力有影响,11S球蛋白比例过高,影响蛋白凝胶的交联,形成的聚集体较为疏松,导致蛋白凝胶结合的H质子的量减少,T23区间对应的面积比提高,说明蛋白凝胶结合H质子的能力下降。商用蛋白凝胶T21区间对应面积比较高,结合的H质子的量较多。T23区间未检测出,说明商用蛋白在胶凝过程中结合的H质子以结合水和不易流动性水为主,相对稳定。
2.3 调质大豆分离蛋白凝胶质构特性

表2 转谷氨酰胺酶诱导调质大豆分离蛋白的凝胶质构特性Table2 Effect of various glycinin contents on texture properties of TGase-induced SPI gels
由表2可知,调质大豆分离蛋白凝胶硬度与11S球蛋白的质量分数相关,11S球蛋白质量分数不同的调质蛋白凝胶硬度有显著差异(P<0.05),随着11S球蛋白质量分数的提高,蛋白凝胶的硬度下降;而11S球蛋白质量分数为60%蛋白凝胶与11S球蛋白质量分数为70%蛋白凝胶的黏度相似,当11S球蛋白质量分数提高到80%的蛋白凝胶黏度略微提高;蛋白凝胶的弹性与11S球蛋白质量分数的变化关系不大,呈现先降低而后稍微提高的趋势;蛋白凝胶的内聚性随着11S球蛋白质量分数的提高,呈现升高趋势;内聚性是指形成样品形态所需内部结合力的大小,实验结果表明11S球蛋白对于蛋白凝胶内部结合力的加强具有贡献作用,随着11S球蛋白在蛋白中含量的提高,凝胶内部分子间的结合力加强,形成的凝胶抵抗受损、保持凝胶完整性的能力提高。调质蛋白质凝胶的黏性指标的变化与11S球蛋白在调质蛋白中所占的质量分数有相关性,当11S球蛋白质量分数是60%时,凝胶的黏性相对较高,与11S球蛋白质量分数分别是70%、80%的蛋白凝胶黏性有显著性差异(P<0.05),随着11S球蛋白质量分数继续提高,其黏性指标无明显差异。3 种调质蛋白凝胶的弹力指标差不明显。商用蛋白的各项质构参数具高于实验研究调质蛋白凝胶参数,且差异显著(P<0.05)。
2.4 调质大豆分离蛋白凝胶的DSC分析
调质大豆分离蛋白凝胶的DSC测试数据见表3,由于蛋白质为高分子化合物,测试升温采用慢速升温过程,以提高测试准确度。由表3可知,11S球蛋白在调质大豆分离蛋白中的质量分数对蛋白凝胶的热特性有很大影响,当11S球蛋白质量分数由60%提高到70%,其蛋白凝胶的热变性温度显著提高(P<0.05),当11S球蛋白质量分数提高到80%时,其热变性温度急剧下降,组间对比差异明显(P<0.05),商用蛋白的热变性温度稍低。蛋白质的热稳定性由变性温度表征,变性温度升高是由于蛋白质凝胶中11S与7S的共价交联,当11S球蛋白质量分数很高时,调质蛋白中的单体7S量减少,导致其交联程度降低,从而表现出变性温度开始下降,稳定性降低。

表3 转谷氨酰胺酶致调质大豆分离蛋白凝胶热特性参数的显著性分析Table3 Significance analysis of the effect of various glycinin contents on texture properties of TGase-induced SPI gels
与蛋白质变性有关的热焓变(ΔH),由于交联蛋白质分子之间氢键断裂及非极性基团更多的暴露需要更多的能量,其DSC曲线显示为吸热峰,随着11S球蛋白质量分数在调质大豆分离蛋白中的提高,ΔH先降低后升高,与变性温度变化趋势相对应。在转谷氨酰胺酶酶诱导的蛋白凝胶中,由于交联程度的提高,使得生成的蛋白结构更为稳定,当11S球蛋白质量分数提高到70%,凝胶的交联反应会破坏蛋白质内的非共价相互作用;因此导致ΔH降低,但交联使得生成的结构更为稳定,不易发生变形,因此其变性温度提高,也有可能使交联度增加,蛋白质变性的程度受到限制,导致变性温度升高而ΔH降低;当11S球蛋白质量分数提高到80%时,由于7S球蛋白含量过低,限制了蛋白凝胶中的交联程度,变性温度降低而ΔH升高,ΔH相对高,其蛋白凝胶更易失去水分。商用蛋白的热稳定性低于60%的11S球蛋白与70%的11S球蛋白凝胶组,且ΔH高于其他组,其结合的水分更易损失。
2.5 调质大豆分离蛋白凝胶微观结构变化
在扫描电子显微镜下观察不同11S球蛋白含量的转谷氨酰胺酶酶诱导大豆分离蛋白凝胶,如图3所示,调质大豆分离蛋白凝胶微观结构有明显差异,这与其中的11S球蛋白含量变化有关。从图3A~C可以看出,在相同放大倍数下,随着11S球蛋白质量分数的提高,凝胶的微观结构显示出由聚集状态到松散状态的现象,当11S球蛋白质量分数达到60%时,形成致密的微观结构,孔洞细密且均匀。11S球蛋白质量分数为70%的大豆分离蛋白凝胶形成的网络结构较平整,孔洞变大且较均匀;11S球蛋白质量分数为80%的大豆分离蛋白凝胶形成的孔洞继续增大,网络结构疏松,表面不平整。11S球蛋白质量分数为60%凝胶形成的致密结构可以束缚更多的游离水,进而使得形成的凝胶具有较好的持水性与凝胶强度;这一结果与2.2、2.3、2.4节分析结果一致。图3显示的商用大豆分离蛋白凝胶微观结构有别与调质大豆分离蛋白凝胶微观结构,商用蛋白凝胶形成的网络结构孔洞不明显,微观结构出现片状层次。

图3 调质大豆分离蛋白凝胶的微观结构(×5 000)Fig.3 Typical SEM images of TGase-induced SPI gels (× 5 000)
3 结 论
调质大豆分离蛋白中11S球蛋白的质量分数变化,引起其蛋白凝胶的横向弛豫时间T2、凝胶的质构特征、热力学特性及微观结构发生显著变化。11S球蛋白的质量分数由60%提高到80%时,蛋白凝胶的横向弛豫时间先缩短后延长;凝胶的硬度、黏性、咀嚼性3 项指标值均有不同程度的降低,黏度、弹性、内聚力及弹性变化不明显;蛋白凝胶的热稳定性先提高后降低,70%的11S球蛋白蛋白凝胶ΔH最低,凝胶中水分不易失去;11S球蛋白质量分数分别为60%与70%的大豆分离蛋白凝胶形成的网络结构表面较平整,孔洞较小且相对均匀;综上,11S球蛋白在大豆分离蛋白中所占的质量分数并不是越高越好,结果表明,11S球蛋白质量分数在60%~70%区间,获得的各项指标较好。
[1] MUJOO R, TRINH D T, NG P K W. Characterization of storage proteins in different soybean varieties and their relationship to tofu yield and textures[J]. Food Chemistry, 2003, 82(2): 265-273.DOI:10.1016/S0308-8146(02)00547-2.
[2] RIBLETT A L, HERALD T J, SCHMIDT K A, et al. Characterization of β-conglycinin and glycinin soy protein fractions from four selected soybean genotypes[J]. Journal of Agricultural and Food Chemistry,2001, 49(10): 4983-4989. DOI:10.1021/jf0105081.
[3] PETRUCCELLI S, ANON M C. Soy protein isolate components and their interactions[J]. Journal of Agricultural and Food Chemistry,1995, 43(7): 1762-1767. DOI:10.1021/jf00055a004.
[4] NAKAMURA T, UTSUMI S, MORI T. Interactions during heat-induced gelation in a mixed system of soybean 7S and 11S globulins[J]. Agriculture and Biological Chemistry, 1986, 50(10):2429-2435. DOI:10.1271/bbb1961.50.2429.
[5] MATSUMURA Y, KANG I J, SAKAMOTO H, et al. Filler effects of oil droplets on the viscoelastic properties of emulsion gels[J].Food Hydrocolloids, 1993, 7(3): 227-240. DOI:10.1016/S0268-005X(09)801744.
[6] DICKINSON E. Enzymic crosslinking as a tool for food colloid rheology control and interfacial stabilization[J]. Trends in Food Science & Technology, 1997, 8(10): 334-339. DOI:10.1016/S0924-2244(97)010674.
[7] KONG F B, CHANG S K C. Changes in protein characteristics during soybean storage under adverse conditions as related to tofu making[J].Journal of Agricultural and Food Chemistry, 2013, 61(2): 387-393.DOI:10.1021/jf3032606.
[8] KONG F B, CHANG S K C, LIU Z, et al. Changes of soybean quality during storage as related to soymilk and tofu making[J].Journal of Food Science, 2008, 73(3): 134-144. DOI:10.1111/j.1750-3841.2007.00652.x.
[9] HOU D H, CHANG S K C. Structural characteristics of purified glycinin from soybeans stored under various conditions[J]. Journal of Agricultural and Food Chemistry, 2004, 52(12): 3792-3800.DOI:10.1111/j.1750-3841.2007.00652.x.
[10] LUIS C S, KARINA C R, MARIA V, et al. Optimization of extraction and isolation for 11S and 7S globulins of soybean seed storage protein[J]. Food Chemistry, 2007, 102(4): 1310-1316. DOI:10.1016/j.foodchem.2006.07.017.
[11] 唐传核, 杨晓泉, 彭志英, 等. 微生物转谷氨酰胺酶催化大豆11S球蛋白聚合研究[J]. 食品科学, 2002, 23(3): 42-46. DOI:10.3321/j.issn:1002-6630.2002.03.006.
[12] 仪淑敏, 马兴胜, 励建荣, 等. 微生物转谷氨酰胺酶催化大豆11S球蛋白聚合研究[J]. 食品科学, 2002, 23(3): 26-30. DOI:10.16429/j.1009-7848.2015.07.004.
[13] 彭喆, 侯虎, 冯雁临, 等. 磷酸化与钙交联处理对刺参胶原聚集体凝胶特性的影响[J]. 现代食品科技, 2015, 31(10): 190-195.DOI:10.13982/j.mfst.1673-9078.2015.10.032.
[14] CHAIJAN M, PANPIPAT W, BENJAKUL S. Physicochemical properties and gel-forming ability of surimi from three species of mackerel caught in Southern Thailand[J]. Food Chemistry, 2010,121(1): 85-92. DOI:10.1016/j.foodchem.2009.12.007.
[15] DAMODARAN S, AGYARE K K. Effect of microbial transglutaminase treatment on thermal stability and pH-solubility of heat-shocked whey protein isolate[J]. Food Hydrocolloids, 2013,30(1): 12-18. DOI:10.1016/j.foodhyd.2012.04.012.
[16] OUJIFARD A, BENJAKUL S, AHMAD M, et al. Effect of bambara groundnut protein isolate on autolysis and gel properties of surimi from threadfin bream (Nemipterus bleekeri)[J]. LWT-Food Science and Technology, 2012, 47(2): 261-266. DOI:10.1016/j.lwt.2012.01.016.
[17] GAN C Y, LATIFF A A, CHENG L H, et al. Gelling of microbial transglutaminase cross-linked soy protein in the presence of ribose and sucrose[J]. Food Research International, 2009, 42(10): 1373-1380.DOI:10.1016/j.foodres.2009.07.001.
[18] TANG Chuanhe, LUO Lijun, LIU Fu, et al. Transglutaminase-set soy globulin-stabilized emulsion gels: inf l uence of soy β-conglycinin/glycinin ratio on properties, microstructure and gelling mechanism[J].Food Research International, 2013, 51(2): 804-812. DOI:10.1016/j.foodres.2013.01.060.
[19] PITOMBO R N M, LIMA G A M R. Nuclear magnetic resonance and water activity in measuring the water mobility in Pintado(Pseudoplatystoma corruscans) fi sh[J]. Journal of Food Engineering,2003, 58(1): 59-66. DOI:10.1016/S0260-8774(02)00334-5.
[20] BRONDUM J, MUNCK L, HENCKEL P, et al. Prediction of waterholding capacity and composition of porcine meat by comparative spectroscopy[J]. Meat Science, 2000, 55(2): 177-185. DOI:10.1016/S0309-1740(99)00141-2.
[21] 刘海梅, 严菁, 熊善柏, 等. 淡水鱼肉蛋白质组成及其在鱼糜制品加工中的变化[J]. 食品科学, 2007, 28(2): 40-44. DOI:10.3321/j.issn:1002-6630.2007.02.006.
[22] 孙海源, 邓耿, 周瑜, 等. 差示扫描微量热法研究蛋白质及其相关体系进展[J]. 科学通报, 2016, 61(增刊2): 3091-3099.
[23] 廖彩虎, 单斌, 钟瑞敏, 等. 真空预冷新鲜猪肉水分流失和DSC蛋白分析研究[J]. 食品与机械, 2013, 29(1): 184-186; 194. DOI:10.3969/j.issn.1003-5788.2013.01.047.
[24] 田童童, 巩子路, 张建. DSC法检测抗冻蛋白的热滞活性的研究[J]. 中国酿造, 2014, 33(1): 127-132. DOI:10.3969/j.issn.0254-5071.2014.01.030.
[25] MESSION J L, CHIHI M L, SOK N, et al. Effect of globular pea proteins fractionation on their heat-induced aggregation and acid cold-set gelation[J]. Food Hydrocolloids, 2015, 26(4): 233-243.DOI:10.1016/j.foodhyd.2014.11.025.
[26] 杨淼, 唐传核. 微生物转谷氨酰胺酶对大豆分离蛋白乳液凝胶性能的影响[J]. 现代食品科技,2012, 28(1): 5-8. DOI:10.13982/J.mfst.673-9078.2012.01.016.
[27] LUO Lijun, LIU Fu, TANG Chuanhe. The role of glycinin in the formation of gel-like soy protein-stabilized emulsions[J].Food Hydrocolloids, 2013, 32(1): 97-105. DOI:10.1016/j.foodhyd.2012.11.031.
[28] LIU Fu, TANG Chuanhe. Cold, gel-like whey protein emulsions by microfluidisation emulsification: rheological properties and microstructures[J]. Food Chemistry, 2011, 127(4): 1641-1647.DOI:10.1016/j.foodchem.2011.02.031.
[29] TANG Chuanhe, LIU Fu. Cold, gel-like soy protein emulsions by microfluidization: emulsion characteristics, rheological and microstructural properties, and gelling mechanism[J].Food Hydrocolloids, 2013, 30(1): 61-72. DOI:10.1016/j.foodhyd.2012.05.008.
[30] 仪淑敏, 马兴胜, 励建荣, 等. 超高压诱导鱼糜凝胶形成中水分特性及凝胶强度的相关性研究[J]. 中国食品学报, 2015, 15(7): 26-31.DOI:10.16429/j.1009-7848.2015.07.004.
