盐胁迫对发芽糙米富集γ-氨基丁酸及蛋白组分变化的影响
2018-03-20陈春旭王利勤郭元新丁志刚杨剑婷夏定胜
陈春旭,王利勤,郭元新,*,丁志刚,杨剑婷,夏定胜
(1.安徽科技学院食品药品学院,安徽 凤阳 233100;2. 安徽盛农农业集团有限公司,安徽 当涂 243100)
糙米虽然营养价值丰富,但其消费严重受限[1]。一方面因其外表附着一层强韧的纤维质米糠层,使口感粗糙,蒸煮不便;另一方面,糙米不仅含有易被人吸收利用的谷蛋白[2],还含有可能引起过敏反应的清蛋白、球蛋白和较难消化的醇溶蛋白[3-4]。然而,糙米发芽后经淀粉酶改性,改变发芽糙米粉的糊化特性后[4],不仅使质地变软、食用品质明显提高,而且能够富集功能性营养成分,如γ-氨基丁酸(γ -aminobutyric acid,GABA)、谷胱甘肽(glutathione,GSH)等物质[5-6]。因此,研究营养价值均衡、食用品质尤佳的发芽糙米,成为当前关注的热点。
研究表明,植物在冷害、热激、盐、机械刺激和低氧等胁迫条件下能够增强谷氨酸脱羧酶(glutamate decarboxylase,GAD)的活性,从而富集GABA[7]。其中盐胁迫方法简单易行、安全环保[8]。目前,对发芽糙米的研究主要集中在改善糙米食用品质[9]、蒸煮特性[10]以及糙米蛋白的抗氧化活性[11-12]等方面,对于盐胁迫发芽富集GABA的研究只集中于大豆和玉米等常见作物[13-14],而对于盐胁迫糙米发芽富集GABA、糙米清蛋白、球蛋白、醇溶蛋白、谷蛋白4 种蛋白组分含量及蛋白亚基分布特征的变化少有报道。因此,为得到食用品质佳且营养价值更为均衡的发芽糙米,本实验研究盐胁迫糙米发芽富集GABA过程中蛋白质组成的动态变化规律,旨在为改善糙米食用品质、评价发芽糙米的营养价值以及为开发发芽糙米产品提供理论依据。
1 材料与方法
1.1 材料与试剂
稻米(南粳46) 安徽省当涂县垄谷制成糙米后装于聚乙烯塑料袋,于-20 ℃贮藏于冰箱备用。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)试剂、低分子质量标准蛋白质 上海升正生物技术有限公司;GABA标准品 上海伊卡生物技术有限公司;牛血清白蛋白标准品、L-谷氨酸、考马斯亮蓝G-250 国药集团化学试剂有限公司;冰乙酸、无水乙醇、磷酸吡多醛、γ-巯基乙醇、磷酸氢二钠、磷酸一氢钠、丙三醇、氢氧化钡、草酸、氢氧化钠、氯化钠、苯酚、正丁醇等化学试剂均为分析纯。
1.2 仪器与设备
JGMJ8098稻谷精米检测机 上海嘉定粮油仪器有限公司;KDC-160HR高速冷冻离心机 安徽科大创新股份有限公司中佳分公司;电热恒温培养箱 上海跃进医疗器械厂;高速多功能粉碎机 浙江荣浩工贸有限公司;754P型紫外-可见分光光度计 上海光谱仪器有限公司;ME403E分析天平 梅特勒-托利多仪器(上海)有限公司;KQ5200DE超声波清洗仪 昆山市超声仪器有限公司;DYY-6C电泳仪、垂直电泳槽、WD-9405D脱色摇床 北京市六一仪器厂;LC-20A高效液相色谱仪岛津(中国)有限公司。
1.3 方法
1.3.1 盐胁迫糙米发芽
参考Albarracin[5]、朱云辉[15]等的方法并作相应修改制备发芽糙米,盐胁迫氯化钠浓度133.5 mmol/L、培养温度33 ℃,分别培养0、1、2、3、4、5 d后取样,去离子水清洗后用吸水纸吸干水分,用于测定其生化指标。
1.3.2 芽长及呼吸速率的测定
芽长根据GB/T 3543.4—1995《农作物种子检验规程发芽试验》[16]进行测定,随机选取30 粒发芽糙米籽粒,使用游标卡尺测定其长度,然后取平均值作为芽长。呼吸速率采用小篮子法测定[17]。
1.3.3 GABA含量及GAD活力的测定
按照Guo Yuanxin等[18]的方法测定,其中GABA含量的测定使用二极管阵列检测器于425 nm波长处进行检测,流动相A为乙腈,流动相B为0.045 mol/L醋酸钠缓冲液(pH 4),分离时间30 min,温度30 ℃;GAD的活力测定中定义1 个单位酶的活力为40 ℃每小时GABA产生的量。
1.3.4 蛋白组分提取及含量测定
参考曹晓虹等[7]方法,按溶解性依次提取清蛋白、球蛋白、醇溶蛋白和谷蛋白4 种蛋白。各组分提取均重复3 次,提取期间超声波辅助提取10 min。各蛋白提取完毕置于-20 ℃保存,待SDS-PAGE分析以及其含量测定。提取的4 种蛋白组分含量的测定采用考马斯亮蓝G-250染色法[16]测定。
1.3.5 蛋白质相对分子质量分布的测定
采用SDS-PAGE方法:配制12%分离胶、5%浓缩胶,使用垂直板电泳槽,将提取的蛋白上清液按比例加入2 倍体积样品缓冲液,沸水浴3~5 min后,上样量15 μL,恒压(浓缩胶100 V、分离胶200 V)电泳,考马斯亮蓝R-250染色。图像和数据使用BandScan 5.0软件分析。
1.4 数据分析
所有实验均设置3 次重复,结果以平均值±标准差表示。应用SPSS软件进行方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。应用Excel 2003软件绘制曲线图。
2 结果与分析
2.1 盐胁迫糙米发芽过程中芽长和呼吸速率的变化
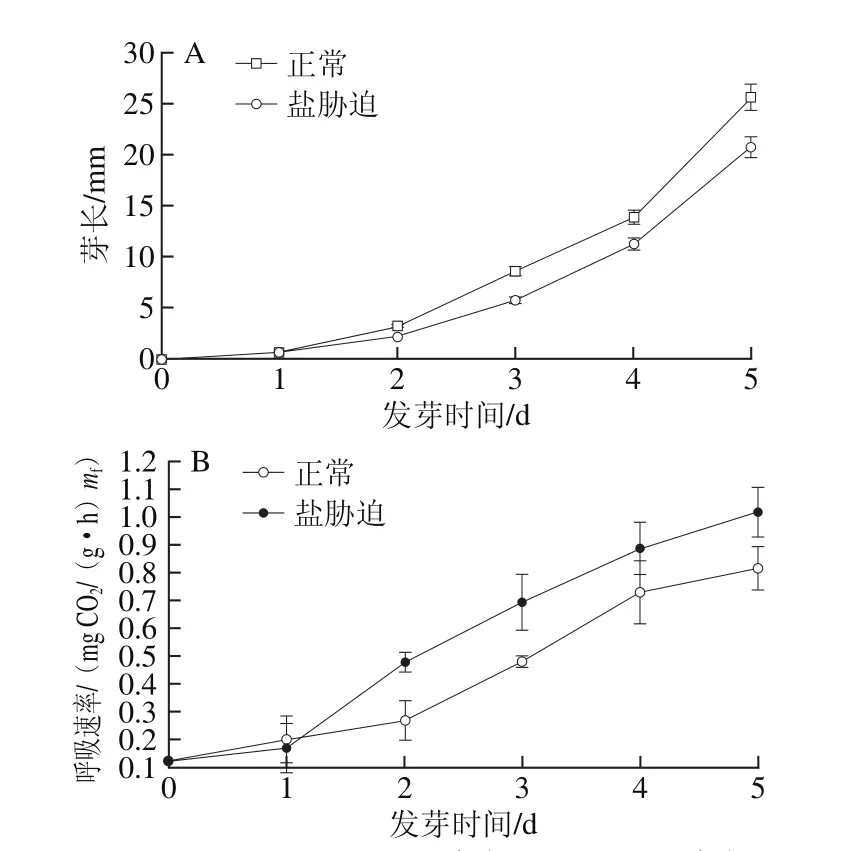
图1 盐胁迫糙米发芽过程芽长(A)及呼吸速率(B)的变化Fig.1 Changes in sprout length (A) and respiratory rate (B) of germinating brown rice under salt stress
呼吸速率的大小可反映生物体代谢活动的强弱[19-20]。如图1A所示,糙米经过发芽后,随着发芽时间的延长,其芽长呈现增长的趋势。发芽1 d左右,糙米芽长增长较缓慢,盐胁迫糙米芽长仅为0.679 mm。发芽2 d后正常和盐胁迫增长趋势明显加快,至发芽5 d,盐胁迫糙米芽长达到20.762 mm,比正常发芽糙米降低18.93%,盐胁迫抑制了糙米生长,这可能是因为盐胁迫降低了种子贮藏物质的分解和转化速率,延迟糙米的发芽时间,使其生长迟缓[20]。由图1B可知,糙米经过正常发芽和盐胁迫发芽2 种方式培养后,呼吸速率均呈现增长的趋势。在30 ℃的条件下,糙米经过盐胁迫处理后,发芽至1 d,呼吸速率增长缓慢,盐胁迫发芽呼吸速率仅达0.173 0 mg CO2/(g·h) mf,比正常发芽降低了14.05%,在发芽2~3 d内呼吸速率明显加快,显著高于正常发芽(P<0.05)。发芽3 d时盐胁迫发芽呼吸速率达0.692 7 mg CO2/(g·h) mf,为发芽0 d的6.63 倍,正常发芽3 d的1.74 倍。发芽5 d时盐胁迫与正常发芽呼吸速率差异极显著(P<0.01),盐胁迫发芽呼吸速率达1.015 1 mg CO2/(g·h) mf,为发芽0 d的8.27 倍,正常发芽5 d的1.24 倍。这可能是因为低盐胁迫条件下,植物合成、有机渗透等一系列过程均需要消耗大量的能量[21],从而造成糙米的呼吸速率增加明显。
2.2 盐胁迫糙米发芽过程GAD活力及GABA含量的变化
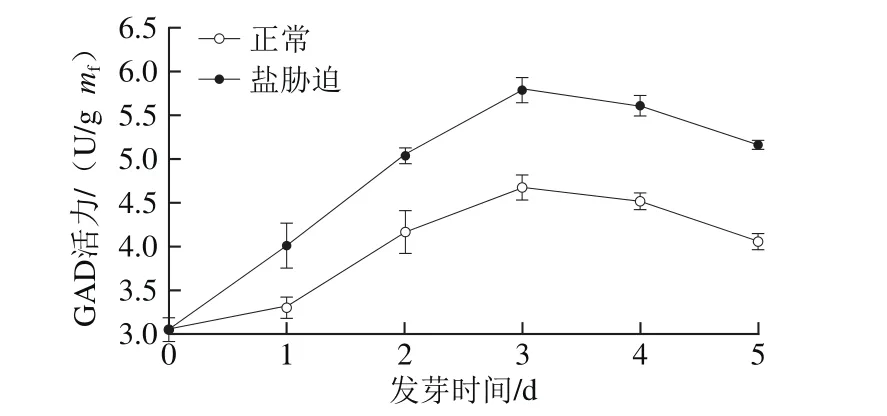
图2 盐胁迫糙米发芽过程中GAD活力的变化Fig.2 Changes in GAD activity of germinating brown rice under salt stress
GAD催化谷氨酸脱羧形成GABA,外源NaCl处理能刺激GAD活性,从而积累GABA[22]。如图2所示,随着发芽时间的延长,发芽糙米GAD活力呈现先快速增加再缓慢下降的趋势,发芽至3 d时,盐胁迫以及正常发芽糙米的GAD活力都达到最大值,盐胁迫发芽糙米的GAD活力为5.784 5 U/g mf,是正常发芽糙米GAD活力的1.24 倍,这可能是因为盐胁迫逆境处理引起细胞液中的Ca2+浓度提高,进而提高钙调蛋白(calmodulin,CaM)的转录水平,激活CaM调控的一系列生理反应,从而促进内源酶GAD活力提高[23]。
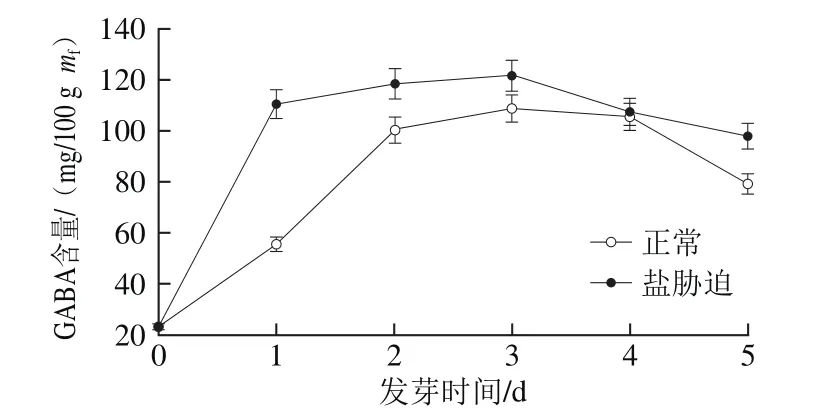
图3 盐胁迫糙米发芽过程中GABA含量的变化Fig.3 Changes in GABA content of germinating brown rice under salt stress
由图3可知,2 种糙米发芽过程中,GABA含量均呈现先增加后下降的趋势,发芽3 d时盐胁迫发芽糙米的GABA含量达最大值,为121.714 9 mg/100 g mf,是未发芽时的5.16 倍,是正常发芽糙米同期的1.12 倍,盐胁迫发芽糙米积累的GABA含量显著高于正常发芽糙米的含量(P<0.01)。GABA的含量与GAD活力(r=0.810)之间呈极显著正相关(P<0.01),其回归方程为y=0.023 1x+2.543 4,决定系数R2=0.655 4。在发芽过程中GABA含量和GAD活力之间存在密切联系,随着GAD活力的增强,GABA含量增大。
2.3 盐胁迫糙米发芽过程中4 种蛋白含量的动态变化规律
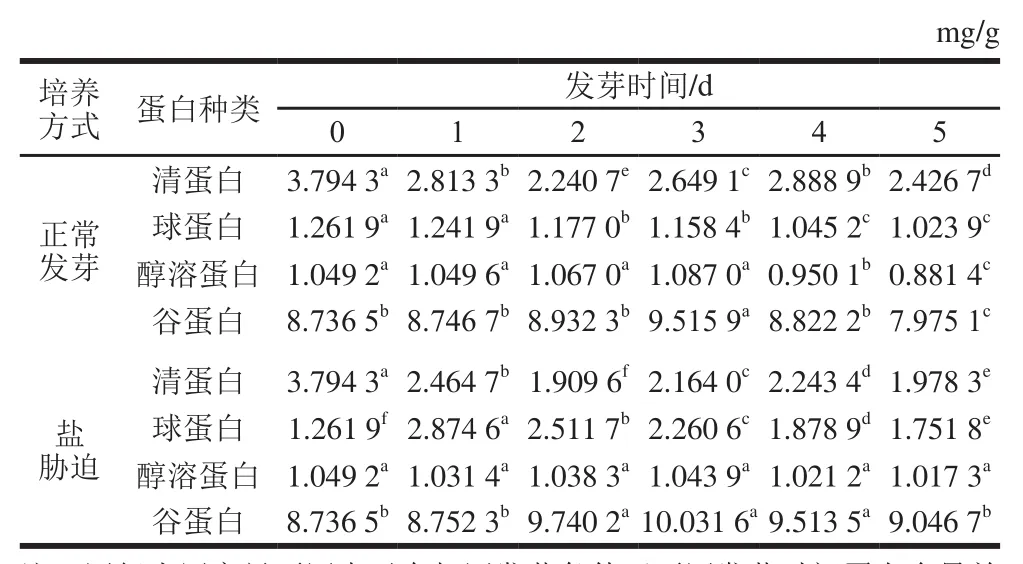
表1 盐胁迫糙米发芽过程中4 种蛋白组分含量的动态变化Table1 Changes in four proteins in germinating brown rice
糙米萌发过程中,最明显的变化是酶系统形成,各种内源酶被激活,其贮存的蛋白质和淀粉等大分子质量物质因无法透过细胞膜被利用,则在酶的作用下降解成小分子物质,为呼吸等生命活动提供底物。糙米蛋白在蛋白酶的作用下降解、合成及相互转化,导致蛋白组分发生变化[24]。由表1可知,正常以及盐胁迫糙米发芽过程中,清蛋白含量都呈现先下降后增长再下降的趋势。发芽2 d时下降到最低,分别为2.240 7、1.909 6 mg/g,而后增长到第4天时达到较高水平(2.8 8 8 9、2.243 4 mg/g),但仍然低于0 d的清蛋白含量3.794 3 mg/g,发芽5 d时又呈下降趋势(2.426 7、1.978 3 mg/g),但均稍高于发芽2 d时的含量。这种变化趋势可能由于清蛋白属生理活性蛋白,在种子萌发早期起作用[24],发芽2 d时种子中包括酶在内的蛋白合成速率加快,清蛋白含量降至最低,但随着蛋白酶活力达到最大,清蛋白的降解无法满足糙米发芽的需要,贮藏蛋白被分解,清蛋白的消耗量小于合成量,最终表现为4 d时清蛋白含量较2 d时有所增加。盐胁迫条件下糙米清蛋白含量低于正常发芽,表明盐胁迫条件可以促进种子发芽,这与盐胁迫条件下呼吸速率加强的结果一致。与正常发芽球蛋白含量逐渐降低不同,盐胁迫球蛋白含量先增加后减少,这可能是由于盐胁迫逆境处理促使发芽糙米呼吸速率加强,种子内部合成新的球蛋白,而随着时间的延长作为主要氮源的球蛋白又被蛋白酶水解[25]。醇溶蛋白含量在正常发芽条件下0~3 d基本保持不变,3 d后逐渐下降;而在盐胁迫条件下醇溶蛋白含量基本不变,这可能是因为醇溶蛋白为贮藏蛋白,发芽后期才逐渐被水解,而盐胁迫抑制了醇溶蛋白酶的活性[26]。糙米谷蛋白在正常及盐胁迫发芽条件下含量变化趋势一致,均为先增加再降低,发芽第3天时谷蛋白含量达到峰值,分别为9.515 9、10.031 6 mg/g,这可能与盐胁迫球蛋白含量变化原因相似,均为发芽糙米呼吸速率加强引起[26]。对比盐胁迫和正常发芽5 d后糙米中4 种蛋白的含量发现,除了清蛋白在盐胁迫条件下含量低于正常发芽条件下的含量外,其余蛋白含量均高于正常发芽,这可能由于清蛋白主要由酶和酶的抑制剂及种子发育所需要氮源(肽类和氨基酸)组成,盐胁迫条件下呼吸速率增加,清蛋白消耗加快所致[27]。
2.4 盐胁迫糙米发芽过程中蛋白质组分的SDS-PAGE分析
2.4.1 盐胁迫发芽糙米清蛋白的SDS-PAGE分析
在作物种子发芽过程中,贮藏蛋白必须转化为清蛋白(水溶性蛋白)才能够被种胚及其发育部分利用[27]。通过软件Band Scan 5.0分析糙米经过盐胁迫发芽处理提取的清蛋白电泳条带如图4所示。
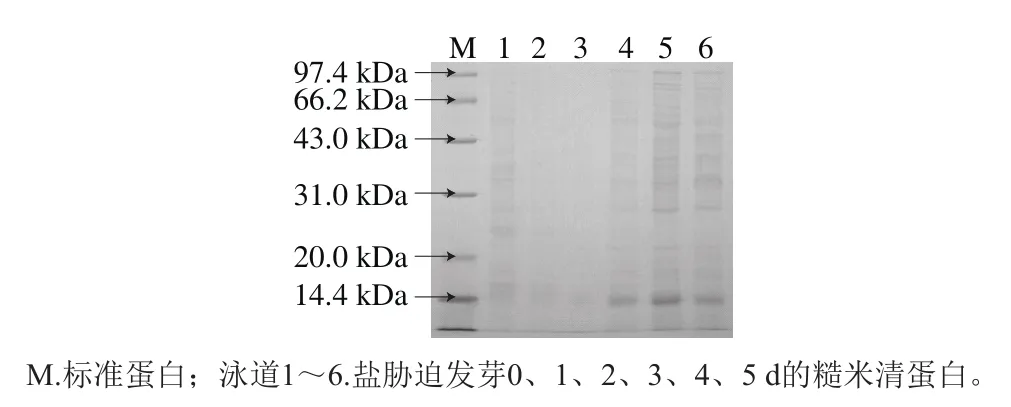
图4 盐胁迫糙米发芽过程中清蛋白SDS-PAGE图谱Fig.4 SDS-PAGE pattern of albumin in germinating brown rice under salt stress
由图4可知,南粳46糙米清蛋白亚基分子质量主要为15.4、23.3、28.6、35.9、45.4、51.1、58.7 kDa(泳道1),这与文献[28]的研究结果一致。其中,28.6、58.7 kDa高分子质量亚基发芽至2 d时基本消失。发芽至3 d,高分子质量的亚基又有不同程度的增加,表现为86.9、75.0、57.5、42.8 kDa的亚基有所增加,可能原因是盐胁迫导致蛋白组分相互转化以及合成速率加快。低分子质量的亚基15.4 kDa(发芽前22.8%),发芽1 d就已经消失,14.2 kDa的亚基发芽4 d相对含量达最高为58.8%,此亚基为新合成的亚基,可能与盐胁迫环境相关[28]。
2.4.2 盐胁迫发芽糙米球蛋白的SDS-PAGE分析
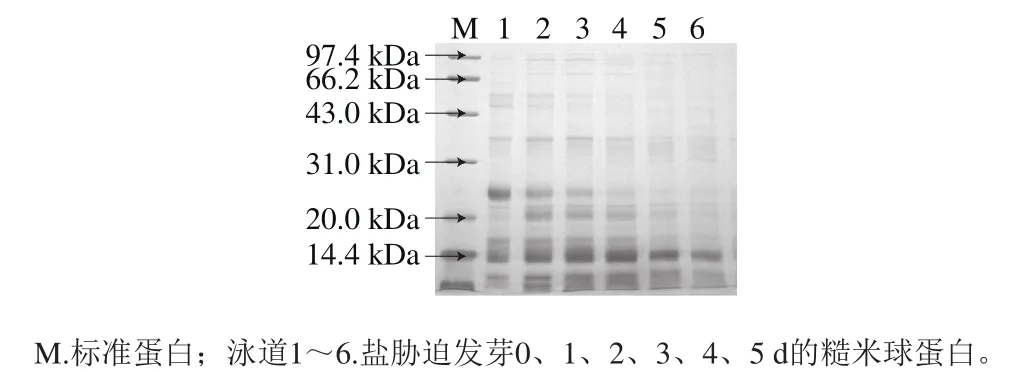
图5 盐胁迫糙米发芽过程中球蛋白SDS-PAGE图谱Fig.5 SDS-PAGE pattern of globulin in germinating brown rice under salt stress
由图5可知,通过软件Band Scan 5.0分析可知,发芽前球蛋白主要亚基的分子质量为11.6、13.9、16.0、24.4、40.0、53.6、58.6、73.3、76.7、82.0 kDa,这与李翠娟等[28]的研究结果一致,盐胁迫糙米发芽时球蛋白中被降解的主要是分子质量为24.4、40.0 kDa的亚基,在发芽前分别占糙米球蛋白相对含量的10.3%和35.5%。发芽4 d时,24.4 kDa亚基消失,40.0 kDa亚基减少至2.7%,5 d后完全降解,可能是由于这2 种亚基与种子发育所需要氮源与酶和酶的抑制剂相关[28]。
2.4.3 盐胁迫发芽糙米醇溶蛋白的SDS-PAGE分析
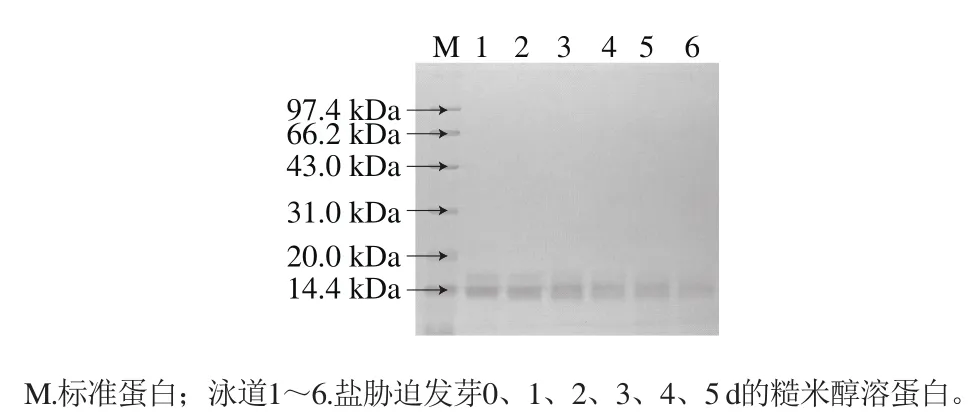
图6 盐胁迫糙米发芽过程中醇溶蛋白SDS-PAGE图谱Fig.6 SDS-PAGE pattern of gliadin in germinating brown rice under salt stress
由图6可知,醇溶蛋白主要为小分子质量的亚基,主要亚基的分子质量为14.0 kDa和15.8 kDa,这与参考文献[29]的研究结果一致。分子质量为14.0 kDa的亚基呈现先增加后减少的趋势,发芽前其相对含量为79.9%,发芽2 d时含量达最大值,为96.9%,而后下降,发芽至5 d时相对含量达79.8%。分子质量为15.8 kDa的亚基降解为小分子质量亚基,直至消失。参考文献[29]的研究结果显示,含量最高的14.0 kDa亚基中含硫氨基酸含量较高,在发芽过程中一般很少被植物自身利用,从而得以积累。
2.4.4 盐胁迫发芽糙米谷蛋白的SDS-PAGE分析
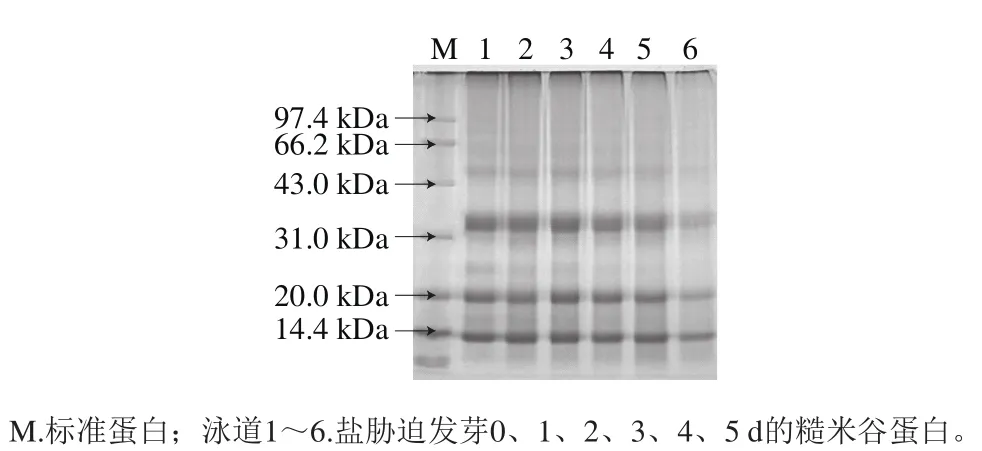
图7 盐胁迫糙米发芽过程中谷蛋白SDS-PAGE图谱Fig.7 SDS-PAGE pattern of gluten in germinating brown rice under salt stress
由图7可知,盐胁迫糙米发芽提取的谷蛋白主要由13.4、18.9、34.6 kDa的亚基组成,这与参考文献[30]的研究结果一致。同时发现含有少量的55.0 kDa亚基(7.8%),在盐胁迫糙米发芽过程中这些亚基均未被降解。结果表明,分子质量为34.6 kDa的亚基变化趋势不明显,发芽后相对含量为18.1%,比发芽前减少了49.16%;18.9 kDa的亚基未发芽时相对含量为26.0%,发芽至4 d时增加到37.3%,之后又减少,发芽5 d时为28.9%;13.4 kDa亚基相对含量的变化趋势为先增加后降低再快速增加,在发芽前的相对含量为23.6%,发芽2 d时增加到24.1%,发芽3 d时又降至22.2%,发芽5 d时相对含量又显著增加到29.6%。文献[30]的研究结果显示,18.9 kDa和34.6 kDa亚基为核糖体中合成前体,可转运至液泡并形成蛋白,这与本实验结果相似。
2.4.5 盐胁迫发芽糙米总蛋白的SDS-PAGE分析
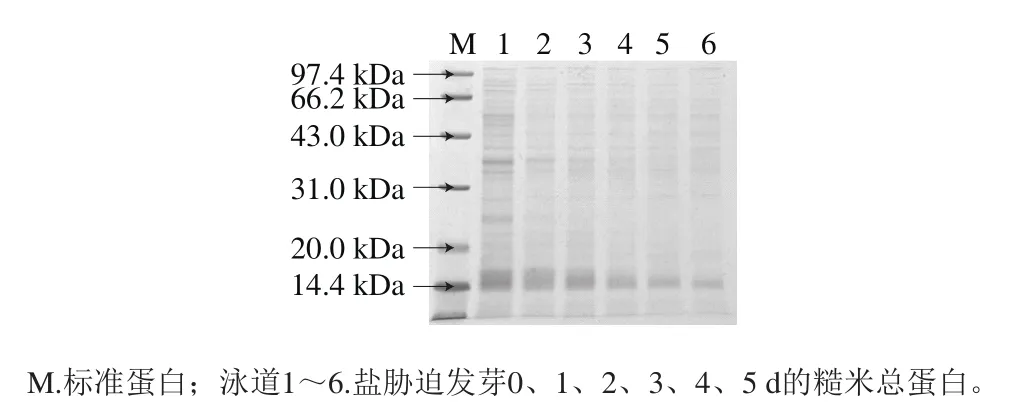
图8 盐胁迫糙米发芽过程中总蛋白SDS-PAGE图谱Fig.8 SDS-PAGE pattern of total proteins in germinating brown rice under salt stress
由图8可知,随发芽时间的延长,盐胁迫糙米发芽过程中,高分子质量的蛋白亚基组分逐渐降解, 67.3、59.4 kDa和54.7 kDa的亚基降解直至消失,分别在发芽至1 d和4 d时消失,这与文献[31]研究结果一致。大多数蛋白在萌发期间发生了改变,部分不溶性蛋白组分逐渐转变为可溶解性,主要是由大分子亚基降解形成的。45.3 kDa的亚基相对含量在发芽前为2.7%,发芽1 d时下降至2.3%,发芽2 d后该亚基相对含量又逐渐增加,发芽至5 d时相对含量达10.7%。发芽前分子质量为40.8 kDa的亚基相对含量为13.4%,发芽4 d时减少为5.2%,发芽至5 d时此亚基完全降解。29.9 kDa亚基组分先增加,在未发芽糙米中相对含量为2.0%,发芽1 d增加至2.5%,发芽至2 d降至2.0%,随着发芽时间延长,此亚基相对含量又增加,发芽5 d时增加至6.2%,这可能是由于降解的这部分蛋白亚基又作为营养物质分泌至胚部用以合成新的蛋白质供根和芽生长[31]。分子质量为14.7 kDa的亚基发芽前相对含量为48.4%,发芽至5 d时相对含量为56.1%,说明盐胁迫对糙米发芽过程中此亚基作用不明显。
3 结 论
实验结果表明,糙米在盐胁迫处理发芽3 d后,GABA含量达到最高,为121.714 9 mg/100 g mf,分别是是未发芽和未胁迫处理同期的5.16 倍和1.12 倍。GAD活力在盐胁迫发芽3 d后活化到最高,为5.784 5 U/g mf,分别是未发芽和正常处理同期的1.9倍和1.24 倍,GAD活力升高后,更多的谷氨酸通过脱羧酶脱羧生成GABA。蛋白组成分析结果表明,正常及盐胁迫发芽条件下糙米清蛋白相对含量变化趋势一致,均为先减少后增加再减少;与正常发芽球蛋白相对含量逐渐降低不同,盐胁迫发芽糙米的球蛋白相对含量先增加后减少;醇溶蛋白相对含量在盐胁迫发芽条件下基本不变;糙米谷蛋白在正常及盐胁迫发芽条件下相对含量变化趋势一致,均为先增加再降低。被降解的主要为清蛋白中28.6、58.7 kDa的亚基和球蛋白中的24.4、40.0 kDa亚基。因此,发芽3 d内,清蛋白和球蛋白水解提供氮源,积累贮藏蛋白。之后谷蛋白被动员,相对含量降低。醇溶蛋白在盐胁迫糙米发芽过程中未被利用。同时,根据相关研究,醇溶蛋白对淀粉黏滞性谱特性有负面影响,而谷蛋白对食味有正面影响,清蛋白则会提高糊化温度和崩解值[32],而本实验中各种蛋白含量的变化相对复杂,所以盐胁迫对于发芽糙米的食用品质的影响还有待于进一步深入研究。另外,盐胁迫糙米发芽后大分子蛋白组分降解,小分子组分增多,这为研究不同蛋白分解代谢过程及其之间的互转关系,甚至相关基因的表达,提供了可能性,对研究盐胁迫发芽糙米生理生化变化和功能性发芽糙米产品具有重要意义。
[1] 肖莲荣, 任国谱. 大米蛋白改性研究进展[J]. 食品与发酵工业, 2012,38(2): 151-156. DOI:10.13995/j.cnki.11-1802/ts.2012.02.032.
[2] 王立, 段维, 钱海峰, 等. 糙米食品研究现状及发展趋势[J]. 食品与发酵工业, 2016, 42(2): 236-43. DOI:10.13995/j.cnki.11-1802/ts.201602041.
[3] 何莹. 水稻谷蛋白的质谱和Western Blot鉴定与贮藏蛋白分析[D].武汉: 武汉大学, 2010: 2-6.
[4] STREETER C C, GERBARG P L, SAPER R B, et.al. Effects of yoga on the autonomic nervous system, gamma-aminobutyric acid,and allostasis in epilepsy, depression, and post-traumatic stress disorder[J]. Medical Hypotheses, 2012, 78(5): 571-579. DOI:10.1016/j.mehy.2012.01.021.
[5] ALBARRACIN M, WEISSTAUB A R, ZULETA A, et al. Extruded whole grain diets based on brown, soaked and germinated rice.effects on the lipid profile and antioxidant status of growing Wistar rats. part II[J]. Food Function, 2016, 7(6): 2729-2735. DOI:10.1039/c6fo00441e.
[6] CHAROENTHAIKIJ P, JANGCHUD K, JANGCHUD A, et al.Germination conditions affect physicochemical properties of germinated brown rice fl our[J]. Journal of Food Science, 2009, 74(9):C658-C665. DOI:10.1111/j.1750-3841.2009.01345.x.
[7] 曹晓虹, 温焕斌, 李翠娟, 等. 糙米发芽过程中蛋白酶活力及含氮物质的变化[J]. 南京农业大学学报, 2010, 33(2): 96-100.
[8] 韩志平, 张海霞, 周凤. 盐胁迫对植物的影响及植物对盐胁迫的适应性[J]. 山西大同大学学报(自然科学版), 2015, 31(3): 59-62.
[9] 吴凤凤. 发芽对糙米主要营养成分、生理功效和加工特性的影响[D].无锡: 江南大学, 2013: 52-56.
[10] 许绰微, 张璐, 赵思明, 等. 发芽糙米热风和微波干燥特性及品质研究[J]. 现代食品科技, 2016, 32(1): 256-260; 135. DOI:10.13982/j.mfst.1673-9078.2016.1.040.
[11] 陈海旭. 益生菌发酵糙米饮料的制作工艺及营养价值研究[D]. 呼和浩特: 内蒙古农业大学, 2014: 2-5.
[12] 胡玲玲, 李春阳, 曾晓雄, 等. 富硒发芽糙米蛋白的抗氧化活性[J]. 食品科学, 2016, 37(1): 99-103. DOI:10.7506/spkx1002-6630-201601018.
[13] 郭元新, 杨润强, 陈惠, 等. 盐胁迫富集发芽大豆γ-氨基丁酸的工艺优化[J]. 食品科学, 2012, 33(10): 1-5.
[14] 叶融, 高嘉玥. 盐胁迫对玉米种子呼吸速率及过氧化物酶活性的影响[J]. 河南农业, 2016, 24(8): 41-42. DOI:10.15904/j.cnki.hnny.2016.24.015.
[15] 朱云辉. 发芽苦荞γ-氨基丁酸高效富集技术及产品开发研究[D]. 凤阳: 安徽科技学院, 2015: 13.
[16] 国家技术监督局. 农作物种子检验规程 发芽试验: GB/T 3543.4—1995[S]. 北京: 中国标准出版社, 1995: 54-73.
[17] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社,2000: 106-110.
[18] GUO Yuanxin, ZHU Yunhui, CHEN Chunxu, et al. Effects of aeration treatment on γ-aminobutyric acid accumulation in germinated Tartary(Fagopyrum tataricum)[J]. Journal of Chemistry, 2016, 2016: 1-9.DOI:10.1155/2016/4576758.
[19] 赵秀娟, 韩雅楠, 蔡禄. 盐胁迫对植物生理生化特性的影响[J]. 湖北农业科学, 2011, 50(19): 3897-3899. DOI:10.14088/j.cnki.issn0439-8114.2011.19.028.
[20] 彭程. 盐胁迫对植物的影响及植物耐盐研究进展[J]. 山东商业职业技术学院学报, 2014, 14(2): 123-128. DOI:10.13396/j.cnki.jsict.2014.02.036.
[21] 孟繁昊, 王聪, 徐寿军. 盐胁迫对植物的影响及植物耐盐机理研究进展[J]. 内蒙古民族大学学报(自然科学版), 2014, 29(3): 315-318;373. DOI:10.14045/j.cnki.15-1220.2014.03.004.
[22] WU D Z, CAI S G, CHEN M X, et al. Tissue metabolic responses to salt stress in wild and cultivated barley[J]. PLoS ONE, 2013, 8(1):e55431. DOI:10.1371/journal.pone.0055431.
[23] SHEN K P, HAO C L, YEN H W, et al. Pre-germinated brown rice prevented high fat diet induced hyperlipidemia through ameliorating lipid synthesis and metabolism in C57BL/6J mice[J]. Journal of Clinical Biochemistry and Nutrition, 2016, 59(1): 39-44. DOI:10.3164/jcbn.15-117.
[24] 蔡晓锋, 胡体旭, 叶杰, 等. 植物盐胁迫抗性的分子机制研究进展[J]. 华中农业大学学报, 2015, 34(3): 1-3. DOI:10.13300/j.cnki.hnlkxb.20150307.001.
[25] KAYA C, KIRNAK H, HIGGS D. Effects of supplementary potassium and phosphorus on physiological development and mineral nutrition of cucumber and pepper cultivars grown at high salinity (NaCl)[J].Journal of Plant Nutrition, 2001, 24(9): 1457-1471. DOI:10.1081/PLN-100106995.
[26] 杨洪兵. K+和Mg2+对盐胁迫下荞麦幼苗生理特性的效应[J]. 西北农业学报, 2015, 24(5): 102-106. DOI:10.7606/j.issn.1004-1389.2015.05.017.
[27] 张恒, 戴绍军. 植物盐胁迫应答蛋白质组学研究的技术策略[J].应用生态学报, 2011, 22(8): 2201-2210. DOI:10.13287/j.1001-9332.2011.0308.
[28] 李翠娟, 曹晓虹, 温焕斌, 等. 糙米发芽过程中主要生理变化对蛋白质组成的影响[J]. 食品与发酵工业, 2009, 35(7): 54-58.DOI:10.13995/j.cnki.11-1802/ts.2009.07.033.
[29] EWLEY J D, BIACK M. Seeds physiology of development and germination[M]. New York: Plenum Press, 1994: 798-812.
[30] SALEH M I, MEULLENET J F. Effect of protein disruption using proteolytic treatment on cooked rice texture properties[J]. Journal of Texture Studies, 2007, 38(4): 423-437. DOI:10.1111/j.1745-4603.2007.00105.x.
[31] 芮闯, 刘莹, 孙建平,等. 蛋白质与大米食味品质的相关性分析[J]. 食品科技, 2012, 37(3): 164-171. DOI:10.13684/j.cnki.spkj.2012.03.062S.
[32] SUN J, HOU C Y, ZHANG S Y. Effect of protein on the rheological properties of rice fl our[J]. Journal of Food Processing and Preservation,2008, 32(6): 987-1001. DOI:10.1111/j.1745-4549.2008.00228.x.
