细胞因子和血管活性物质与心肌梗死预后相关性分析
2018-03-20王慧莹徐爱茹赵楚敏宋月霞
许 涛,王慧莹,徐爱茹,赵楚敏,宋月霞,李 莉
0 引言
急性心肌梗死(Acute myocardial infarction,AMI)是由于冠状动脉粥样硬化,形成血栓或冠状动脉分支堵塞,从而造成部分心肌失去血液供应或血供相对不足,导致心肌坏死的病症[1]。随着溶栓及介入治疗的应用,AMI患者住院病死率明显降低。然而AMI患者病情不稳定、进展快、死亡率较高,易发生恶性心律失常、心力衰竭、低血压和心源性休克等各种预后不良事件[2-3]。因此,若能早期对AMI患者进行评估,对预后不良高危组进行一级预防,并能有效及时给予相应治疗,可最大限度提高AMI患者的预后生存质量及存活率,并能减轻患者家庭负担。本文回顾性分析AMI患者的血清中细胞因子和血管活性物质等指标,细胞生长因子选取血管内皮生长因子B (Vascular endothelial growth factor,VEGF-B)、白细胞介素-32 (Interleukin-32,IL-32),血管活性物质选取蛋白相关磷脂酶A2(Lipoprotein-associated Phospholipase A2,Lp-PLA2)、儿茶酚抑素(Catestatin,CST),探讨各指标与心肌梗死预后相关性,为临床心肌梗死患者预后评估提供理论依据。
1 对象与方法
1.1 研究对象 选取我院2015年5月1日至2016年4月30日以胸痛、胸闷并确诊为急性心肌梗死患者189例。入选患者均符合欧美心脏病协会制定的诊断标准[4-5]。同时选取同期于我院住院并确诊为不稳定型心绞痛(Unstable angina,UA)的患者105例。排除标准:①非新发AMI者;②患有严重肝肾功能不全者;③住院期间死亡患者。本研究经院伦理委员会审核通过,所有患者知情同意并书面签署同意书。
1.2 研究方法
1.2.1 收集所有入选患者一般资料并进行对比。
1.2.2 对所有患者入院后抽血,并送至检验科,由我院检验医师严格按照各试剂盒说明书分别测定血清VEGF-B、Lp-PLA2、CST、IL-32含量,并做相应记录,出院前再次抽血检测上述4种生化因子并记录,对2次结果进行分析。
1.2.3 根据心功能将AMI患者分为KiliipⅠ、KiliipⅡ、KiliipⅢ、KiliipⅣ 4组,并对四组患者血清中上述4种生化因子进行统计分析。
1.2.4 出院后,对患者进行为期6个月的随访,随访形式为门诊随访和电话回访,观察患者随访期间心脏主要不良事件(Major adverse cardiac events,MACE)的发生情况(MACE定义:心源性死亡、非致命性心力衰竭、再发非致命性心肌梗死和因严重心绞痛或心律失常而需要再次住院治疗等)。根据随访期间是否发生MACE事件,将患者分为预后良好组和预后不良组,并对两组患者各项指标进行分析。
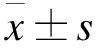
2 结果
2.1 两组患者一般情况比较 AMI组189例,男97例,女92例,年龄35~80岁;UA组105例,男53例,女52例,年龄33~82岁。两组患者年龄、性别组成、吸烟史、饮酒史、高血压病史、糖尿病病史、血胆固醇、血三酰甘油、血肌酐、血尿素氮等一般资料差异无统计学意义(P>0.05),具有可比性。见表1。

表1 两组患者一般情况比较(例,%)
2.2 两组患者血清生化因子比较 治疗前两组患者VEGF-B比较差异无统计学意义(P>0.05),而AMI组患者Lp-PLA2、CST高于UA组(P<0.05),而IL-32低于UA组(P<0.05);治疗后两组患者血清各指标比较差异无统计学意义(P>0.05)。见表2。
2.3 不同心功能分级组别血清中相关因子情况 见表3。各组间VEGF-B比较差异无统计学意义(P>0.05);而患者Lp-PLA2、CST水平随着心功能恶化呈上升趋势;IL-32含量随心功能恶化逐渐降低。
2.4 随访中各指标变化情况 根据随访情况将AMI患者分为预后良好组、预后不良组。预后良好组109例,预后不良组80例,其中发生非致命性心力衰竭23例,心源性死亡8例,再发非致命性心肌梗死15例,心肌梗死后心绞痛19例,恶性心律失常15例,总MACE发生率为42.33%。根据结果,预后不良组患者入院时血清VEGF-B、IL-32明显低于预后良好组(P<0.05),而Lp-PLA2、CST高于预后良好组(P<0.05);治疗后两组患者各项指标差异无统计学意义(P>0.05),两组患者血清各指标见表4。
3 讨论
AMI是一种易损血管冠状动脉硬化斑块破裂形成的血栓阻塞血管腔而导致的心肌细胞急性缺血、缺氧坏死[6]。细胞坏死后可引起炎症反应,坏死心肌会逐渐纤维化,最终导致心室重构,而导致各种并发症及心血管事件。IL-32是一种细胞炎性因子,有研究表明,其可促进IL-6、IL-1β、TNF-α等炎性介质的表达[7-8]。且IL-32与一些炎症性疾病密切相关。此前相关研究认为,IL-32与类风湿关节炎、关节肿胀、大量炎性细胞浸润、软骨损伤等有关[9-11]。但IL-32与心肌梗死预后相关性仍无临床证据。本研究显示,IL-32水平升高提示预后较好,这与陈家林[12]的研究结果一致。
VEGF-B是促进血管生成、营养与保护神经的一种细胞因子,且与脂质代谢密切相关[13]。在AMI患者中,VEGF-B可影响一氧化氮合酶,从而促进心肌血管内皮增殖和新血管生成,对损伤心肌进行微血管灌注、对梗死心肌细胞进行修复并有效抑制左心室重构[14]。因此,VEGF-B可以改善心肌梗死预后并减少MACE事件的发生。血儿茶酚胺分泌与交感神经激活有关,儿茶酚胺毒性可导致心肌细胞死亡、促进心肌间质增生、心室重构,进而导致心脏扩大、心力衰竭。

表2 两组患者血清中4种生化因子水平对比

表3 四组患者血清中各生化指标对比

表4 两组患者血清中各生化因子水平对比
注:*与预后不良组比较,P<0.05;#与治疗前比较,P<0.05
CST是一种由21个氨基酸残基组成的内源性多肽,可作用于神经元烟酸乙酰胆碱受体,后者抑制细胞外Na+及Ca2+内流介导过程,进而减少儿茶酚胺分泌[15]。CST还具有保护心肌、改善缺血后左心室功能、减少缺血再灌注损伤的作用[16],但本研究提示,患者血清CST升高与预后不良呈正相关,这可能由于心肌梗死患者血清CST分泌增多是血儿茶酚胺水平升高导致,而较高水平血清CST与血儿茶酚胺仍不平衡,或仍不能进一步逆转或改善交感神经和儿茶酚胺毒性给机体带来的损害,因此高水平CST患者预后MACE事件发生率高于低水平CST患者。
Lp-PLA2是由一种炎症细胞分泌的不依赖钙离子的磷脂酶类,Lp-PLA2与LDL相结合形成Lp-PLA2复合物,是动脉粥样硬化的关键原因,该复合物经由血管壁进入内膜,LDL在内膜被氧化,LDL上的卵磷脂变成氧化卵磷脂,氧化卵磷脂随机被Lp-PLA2水解成溶血卵磷脂(Lysopho-sphatidyl choline,Lyso-PC)和氧化型游离脂肪酸(Oxidized free fattyacids,ox-FFA)[17],这两种水解生成物均为促炎介质,可刺激黏附因子和趋化因子的产生,诱导炎症因子的产生,从而促进单核细胞由细胞管腔向内膜聚集。单核细胞在内膜聚集后衍生为巨噬细胞,巨噬细胞吞噬氧化型LDL变成泡沫细胞,而泡沫细胞聚集参与动脉粥样硬化斑块的形成,此类斑块易发生破裂,进而导致血栓形成和冠脉事件的发生[18-19]。因此,高水平Lp-PLA2是冠心病发生的重要因素之一,本研究提示,Lp-PLA2不仅是冠心病的重要危险因素,也是AMI预后不良的因子,这与张振等[20]的研究结果一致。
AMI与UA会导致心肌细胞缺氧受损或死亡,患者体内各种生化因子会发生不同变化。本研究表明,两组患者血清VEGF-B比较差异无统计学意义,AMI患者Lp-PLA2、CST高于AMI组,IL-32低于UA组;治疗后两组患者血清各指标差异无统计学意义。这些不同变化,可能与应激及炎症反应有关,随着病情(Kiliip分级)的变化,各指标变化趋势不同,VEGF-B在各组间差异无统计学意义,Lp-PLA2、CST水平随着心功能恶化呈上升趋势,IL-32含量随心功能恶化而降低,提示上述4种指标对病情的轻重有一定指导意义。
综上所述,IL-32、VEGF-B、Lp-PLA2、CST对评价急性心肌梗死的预后有一定的价值,IL-32、VEGF-B水平升高提示AMI患者预后较好,Lp-PLA2、CST水平升高则与预后不良有显著关系。当然,这些结果还要在大样本中和不同的患者人群中进一步确认。
[1] 金捷.微处理器控制的植入式心脏起搏器专用电路研制[J].中国医疗器械信息,2003,9(5):11-13.
[2] Kirchberger I,Heier M,Kuch B,et al.Presenting symptoms of myocardial infarction predict short- and long-term mortality:the MONICA/KORA Myocardial Infarction Registry[J].Am Heart J,2012,164(6):856-861.
[3] Armas NB,Ortega YY,De la Noval R,et al.Acute myocardial infarction mortality in Cuba,1999-2008[J].MEDICC Rev,2012,14(4):19-25.
[4] Neumar RW,Otto CW,Link MS,et al.Part 8:adult advanced cardiovascular life support:2010 American Heart Association Guidelines for cardiopulmonary resuscitation and emergency cardiovascular care[J].Circulation,2010,122(18 Suppl 3):S729-S767.
[5] Erhardt L,Herlitz J,Bossaert L,et al.Task force on the management of chest pain[J].Eur Heart J,2002,23(15):1153-1176.
[6] Yao HC,Liu T,Meng XY,et al.Effect of basic fibroblast growth factor on the myocardial expression of hypoxia-inducible factor-1α and vascular endothelial growth factor following acute myocardial infarction[J].Heart Lung Circ,2013,22(11):946-951.
[7] Lee S,Kim JH,Kim H,et al.Activation of the interleukin-32 pro-inflammatory pathway in response to human papillomavirus infection and over-expression of interleukin-32 controls the expression of the human papillomavirus oncogene[J].Immunology,2011,132(3):410-420.
[8] Choi JD,Bae SY,Hong JW,et al.Identification of the most active interleukin-32 isoform[J].Immunology,2009,126(4):535-542.
[9] 安新,高利常,孙太起,等.IL-32、MMP-13及IL-10在类风湿关节炎中的表达及意义研究[J/CD].中华临床医师杂志(电子版),2013,7(20):9089.
[10]Moon YM,Yoon BY,Her YM,et al.IL-32 and IL-17 interact and have the potential to aggravate osteoclastogenesis in rheumatoid arthritis[J].Arthritis Res Ther,2012,14(6):R246.
[11]宁长青,冯伟,刘益杰,等.IL-17与类风湿性关节炎的研究进展[J].中国中医骨伤科杂志,2013,21(9):67-69.
[12]陈家林.血清IL-32与急性心梗患者预后的相关性分析[J].安徽医药,2016,20(3):512-515.
[13]宋强,雍海溟,张水华,等畅血管内皮生长因子B生物学功能的研究进展[J].医学研究生学报,2012,25(7):774-777.
[14]Devaux Y,Azuaje F,Vausort M,et al.Integrated protein network and microarray analysis to identify potential biomarkers after myocardial infarction[J].Funct Integr Genomics,2010,10(3):329-337.
[15]Mahapatra NR,Mahata M,Mahata SK,et al.The chromogranin A fragment catestatin:specificity,potency and mechanism to inhibit exocytotic secretion of multiple catecholamine storage vesicle co-transmitters[J].J Hypertens,2006,24(5):895-904.
[16]Theurl M,Schgoer W,Albrecht K,et al.The neuropeptide catestatin acts as a novel angiogenic cytokine via a basic fibroblast growth factor-dependent mechanism[J].Circ Res,2010,107(11):1326-1335.
[17]Lavi S,McConnell JP,Rihal CS,et al.Local production of lipoprotein-associated phospholipase A2and lysophosphatidylcholine in the coronary circulation:association with early coronary atherosclerosis and endothelial dysfunction in humans[J].Circulation,2007,115(21):2715-2721.
[18]Rosenson RS,Stafforini DM.Modulation of oxidative stress,inflammation,and atherosclerosis by lipoprotein-associated phospholipase A2[J].J Lipid Res,2012,53(9):1767-1782.
[19]Winkler K,Winkelmann BR,Scharnagl H,et al.Platelet-activating factor acetylhydrolase activity indicates angiographic coronary artery disease independently of systemic inflammation and other risk factors:the Ludwigshafen Risk and Cardiovascular Health Study[J].Circulation,2005,111(8):980-987.
[20]张振,王海斌,王国龙,等.Lp-PLA2预测急性心梗患者PCI预后的价值[J].临床心电学杂志,2015,24(6):410-415.
