槲皮黄酮对Aβ诱导小神经胶质细胞损伤的保护机制研究
2018-03-20何标,廉果
何 标,廉 果
0 引言
阿尔茨海默症(Alzheimer′s disease,AD)是发生在老年前期及老年期的一种原发性退行性脑病,是一种持续性高级神经功能活动障碍,即在没有意识障碍的状态下,记忆、思维、分析判断、视空间辨认、情绪等方面的障碍。研究显示,在发生该病的机体脑部,存在大量激活的小神经胶质细胞,后者成簇地分布在β淀粉样蛋白沉淀的周围[1],这些激活的小神经胶质细胞高度表达多种与免疫相关的受体蛋白,分泌大量生物活性分子[2]。在阿尔茨海默症的发生发展过程中,会出现β淀粉样蛋白(Aβ)斑块沉积。而小神经胶质细胞则可以通过吞噬作用,帮助清除Aβ斑块沉积。但是,在病症加重或发病后期,小神经胶质细胞会释放一些炎症因子,加重炎症反应,造成神经元的进一步损伤[3-5]。槲皮黄酮(Quercetin,Qu)是一种黄酮类化合物,来源于裸子植物、蕨类植物及被子植物的根茎部位[6]。近年研究表明,槲皮黄酮在临床上的应用越来越受到关注,因其抗氧化和抗炎症反应的效果颇为显著,还可用于神经系统疾病、癌症、糖尿病引起的多种并发症及肥胖症等[7-9]。因此,本文通过体外构建阿尔茨海默症细胞模型,观察槲皮黄酮对β-淀粉样蛋白诱导小神经胶质细胞(BV-2)损伤的保护作用,并对其作用机制进行了初步研究。
1 材料及方法
1.1 材料 小神经胶质细胞(BV-2,上海复祥生物科技有限公司);槲皮黄酮(Sigma,CAS No.117-39-5,≥99%);CCK8试剂盒(上海博谷生物科技有限公司);ELISA试剂盒(南京森贝伽生物科技有限公司);SDS-PAGE凝胶配制试剂盒(巴菲尔生物技术有限公司,批号:131221);BCA蛋白浓度测定试剂盒(上海谷歌生物有限公司,批号:P0010S-01);DMEM高糖培养基(武汉谷歌生物科技有限公司);胎牛血清(Gibco公司);胰蛋白酶(武汉谷歌生物科技有限公司);β-actin、β-分泌酶(BACE)、早老素(PS1)、呆蛋白(NCT)、NEP、IDE一抗均购自美国Sigma公司;二抗羊抗兔IgG购自武汉谷歌生物有限公司。
1.2 仪器 DNM-9602G型酶标仪(北京普朗新技术有限公司);单人超净台(苏州华新空调净化有限公司);细胞培养箱(上海医用分析仪器厂);凝胶电泳仪(北京六一仪器厂);双色红外激光成像系统(BIO-RAD,美国)。
1.3 BV-2细胞复苏、传代培养 预先对超净工作台及相关实验用品进行紫外消毒30 min,将冻存于液氮中的BV-2细胞迅速取出,置于37 ℃温水浴中不断摇晃,使其在1 min内快速溶解,离心后置于超净工作台上,弃去上清,加入新的DMEM完全培养基(10% FBS,1%双抗)重悬细胞,分装于3个培养瓶,摇匀使细胞分散均匀后,置于37 ℃、5% CO2的恒温培养箱中培养。待细胞贴壁生长到90%左右时,便可传代培养,所有操作均在超净工作台上完成。取出细胞,用复温的PBS溶液清洗细胞2遍,加入胰蛋白酶进行消化,在显微镜下观察,待细胞变圆后,加入培养基终止消化,吸出细胞悬液于Ep管中,离心,再重悬细胞后,以1∶3的比例进行传代培养,置于37 ℃、5% CO2的恒温培养箱中培养。
1.4 CCK8试验 将对数生长期的BV-2细胞进行消化、重悬、计数后,取适量数量的细胞接种于96孔板中,每孔终体积为200 μL,每组设置6个复孔。待细胞贴壁生长至80%左右时,取出弃去旧培养基,加入含不同浓度槲皮黄酮(10、20、40 μg/mL)的高糖培养基,置于37 ℃、5% CO2的恒温培养箱中继续孵育24 h。弃去旧培养基,每孔加10 μL CCK8试剂,重新放置于37 ℃、5% CO2的恒温培养箱中培养1 h后,置于酶标仪中于450 nm波长处检测吸光度(OD)值,并计算细胞相对存活率。
1.5 ELISA试验 将对数生长期的BV-2细胞进行消化、重悬、计数后,取适量数量的细胞接种于6孔板中,每孔终体积为2 mL,每组设置6个复孔。待细胞贴壁生长至80%左右时,吸弃旧培养基,加入含低、中、高剂量槲皮黄酮(10、20、40 μg/mL)的高糖培养基,置于37 ℃、5% CO2的恒温培养箱中继续孵育24 h,收集细胞培养基上清及细胞。细胞培养基上清用于炎症因子IL-6、TNF-α检测,具体操作步骤根据ELISA试剂盒操作说明书进行。
1.6 免疫印迹检测蛋白表达水平 将“1.5”项收集的细胞用RIPA裂解液在冰上裂解,待裂解完全后,在预冷的低温离心机中离心(12 000 r/min,12 min),吸取上清并记录体积,加入1/4体积的蛋白上样缓冲液,于100 ℃煮沸7 min。并同时采用BCA试剂盒对蛋白浓度进行检测,计算上样体积。每孔上样量为30 μg蛋白,浓缩胶采用的恒压为70 V,分离胶采用的恒压为120 V,离胶底部1~2 cm停止电泳。采用275 mA恒流进行电转,时间为90 min。采用5%脱脂奶粉封闭,将膜用TBS清洗后置于相应盛装抗体的盒子中,4 ℃孵育过夜;TBST清洗膜3次,室温下孵育二抗。利用Odyssey近红外扫描仪对β-actin、BACE、PS1、NCT、NEP、IDE表达水平进行检测。
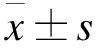
2 结果
2.1 槲皮黄酮对BV-2细胞增殖的影响 采用CCK8试剂对BV-2细胞的增殖情况进行检测,结果如图1a所示,模型组中BV-2细胞经过Aβ刺激后,细胞的相对存活率低于正常对照组(P<0.05)。低、中、高剂量槲皮黄酮处理后,BV-2细胞的相对存活率高于模型组(P<0.05),并且随着槲皮黄酮剂量的增加,相对存活率升高越明显,表现出浓度依赖性。同时,采用中剂量槲皮黄酮对细胞处理0、12、24、48、72 h,发现随着药物作用时间延长,细胞相对存活率越高,见图1b。

图1 槲皮黄酮对BV-2细胞增殖的影响(n=6)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05。
1.正常对照组,2.模型组,3.槲皮黄酮10 μg/mL组,4.槲皮黄酮20 μg/mL组,5.槲皮黄酮40 μg/mL组
2.2 槲皮黄酮对炎症因子IL-6、TNF-α表达水平的影响 低、中、高剂量槲皮黄酮作用BV-2细胞24 h后,药物对细胞分泌炎症因子IL-6、TNF-α水平的影响如图2所示。模型组细胞培养基上清中IL-6、TNF-α的含量高于正常对照组(P<0.05)。经过不同剂量槲皮黄酮处理后,细胞上清液中IL-6、TNF-α的表达水平低于模型组(P<0.05);随着槲皮黄酮剂量的升高,IL-6、TNF-α含量的下降越明显,表现出浓度依赖性。
2.3 槲皮黄酮对BACE、PS1、NCT、蛋白表达水平的影响 采用Western blot检测BV-2细胞中BACE、PS1、NCT蛋白表达,见图3。模型组细胞BACE、PS1、NCT蛋白表达水平高于正常对照组(P<0.05)。低、中、高剂量槲皮黄酮组BACE、PS1、NCT蛋白表达水平低于模型组(P<0.05),并且随着药物浓度增加,其蛋白表达水平降低越明显,表现出浓度依赖性。
2.4 槲皮黄酮对脑啡肽酶(NEP)、胰岛素降解酶(IDE)表达水平的影响 采用免疫印迹技术对BV-2细胞中NEP及IDE蛋白检测结果如图4所示,模型组细胞经过Aβ刺激后,NEP及IDE蛋白表达水平相对于正常对照组而言显著降低,差异有统计学意义(P<0.05)。而经过低、中、高剂量槲皮黄酮处理后,NEP及IDE蛋白表达水平相对于Aβ刺激组显著升高,差异均有统计学意义(P<0.05),并且随着药物浓度增加显著性越明显,表现出浓度依赖性。

图2 槲皮黄酮对BV-2细胞分泌炎症因子的影响(n=6)

图3 槲皮黄酮对BACE、PS1及NCT蛋白表达水平的影响(n=6)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05。
1.正常对照组,2.模型组,3.槲皮黄酮10 μg/mL组,4.槲皮黄酮20 μg/mL组,5.槲皮黄酮40 μg/mL组

图4 槲皮黄酮对NEP及IDE蛋白表达水平的影响(n=6)
3 讨论
BV-2细胞是中枢神经系统内具有免疫活性的巨噬样细胞,其聚集在β淀粉样蛋白斑块周围,这些活化的BV-2细胞能够过度表达多种与免疫相关的受体蛋白,参与阿尔茨海默症的发生、发展[10]。有报道,TNF-α对神经元细胞及小神经胶质细胞具有重要的调节作用,其能够增强小神经胶质细胞的吞噬功能,分泌前炎症细胞因子和抗炎性细胞因子,影响神经元膜电位、细胞内钙离子平衡和长时程增强,并可以协调IL-1诱导IL-6的产生[11]。IL-6是一种具有破坏性的前炎症细胞因子,可以介导中枢神经系统的免疫及炎症反应,引起细胞功能异常。细胞内β淀粉样蛋白的沉积及小神经胶质细胞活化产生的炎症反应均是阿尔茨海默症的发病机制[12],因此,减少小神经胶质细胞内β淀粉样蛋白沉积及炎症反应,可能是治疗阿尔茨海默症的一种方式。
采用Aβ诱导可较好地构建BV-2细胞损伤模型,经过低、中、高3种剂量的槲皮黄酮处理后,BV-2细胞的相对存活率相对于Aβ诱导模型组显著增加。药物处理后,可明显降低炎症因子IL-6及TNF-α的表达水平。并且槲皮黄酮可以明显降低BACE、PS1及NCT蛋白表达水平,说明槲皮黄酮可以抑制Aβ合成酶的表达及与老年痴呆相关蛋白的表达;同时,槲皮黄酮还可以促进Aβ消化酶NEP及IDE的表达,说明槲皮黄酮可以促使Aβ降解,减少其在小神经胶质中的沉积。
综上所述,槲皮黄酮对Aβ诱导的BV-2细胞损伤具有保护作用,其作用的机制可能与抑制Aβ分泌酶表达和激活Aβ消化酶表达相关。
[1] Akiyama H,Barger S,Barnum S,et al.Inflammation and Alzheimer′s disease[J].Neurobiol Aging,2012,21(383):e421.
[2] Wyss-Coray T,Rogers J.Inflammation in Alzheimer disease-a brief review of the basic science and clinical literature[J].Cold Spring Harb Perspect Med,2012,2(1):a006346.
[3] Sheng JG,Bora SH,Xu G,et al.Lipopolysaccharide-induced-neuroinflammation increases intracellular accumulation of amyloid precursor protein and amyloid beta peptide in APPswe transgenic mice[J].Neurobiol Dis,2013,14(4):133-145.
[4] Tomic JL,Pensalfini A,Head E,et al.Soluble fibrillar oligomer levels are elevated in Alzheimer′s disease brain and correlate with cognitive dysfunction[J].Neurobiol Dis,2009,35(3):352-358.
[5] Walter S,Letiembre M,Liu Y,et al.Role of the toll-like receptor 4 in neuroinflammation in Alzheimer′s disease[J].Cell Physiol Biochem,2015,20(23):947-956.
[6] 马云峰,尚富德.黄酮类化合物在药用植物中的分布[J].生物学杂志,2003,20(1):35-39.
[7] Comalada M,Camuesco D,Sierra S,et al.In vivo quercitrin antiinflammatory effect involves release of quercetin,which inhibits inflammation through down-regulation of the NF-κB pathway[J].Eur J Immunol,2005,35(2):584-592.
[8] Dok-Go H,Lee KH,Kim HJ,et al.Neuroprotective effects of antioxidative flavonoids,quercetin,(+)-dihydroquercetin and quercetin 3-methyl ether,isolated from opuntia ficus-indica var saboten[J].Brain Res,2003,965(1-2):130-136.
[9] Lu J,Papp LV,Fang J,et al.Inhibition of mammalian thioredoxin reductase by some flavonoids:implications for myricetin and quercetin anticancer activity[J].Cancer Res,2006,66(8):4410-4418.
[10]Colton CA,Mott RT,Sharpe H,et al.Expression profiles for macrophage alternative activation genes in AD and in mouse models of AD[J].J Neuroinflammation,2006,12(3):27-34.
[11]Liblau RS,Gonzalez-Dunia D,Wiendl H,et al.Neurons as targets for T cells in the nervous system[J].Trends Neurosci,2013,36(6):315-324.
[12]Cameron B,Tse W,Lamb R,et al.Loss of interleukin receptor-associated kinase 4 signaling suppresses amyloid pathology and alters microglial phenotype in a mouse model of Alzheimer′s disease[J].J Neurosci,2012,32(43):15112-15123.
