姜黄素类似物JZ02对LPS诱导的急性肺损伤的影响
2018-03-20董莉莉谢月群陈玲珑林强康
王 蕾,董莉莉,谢月群,陈玲珑,林强康,张 和
0 引言
急性肺损伤(Acute lung injury,ALI)及其严重形式急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)是由心源性以外的各种致伤因素(严重感染、创伤、休克、吸入有毒气体及某些药物中毒等)导致的急性低氧性呼吸功能不全[1-2],进展迅速,发病率、死亡率均高[3],且目前缺乏有效的治疗手段。据报道,姜黄素可缓解细菌脂多糖(LPS)诱导的急性肺损伤,如抑制炎症因子TNF-α的产生、降低肺湿干重比值等。针对姜黄素体内代谢快及不稳定的缺点,课题组前期合成了具有体外抗炎活性的化合物JZ02,在前期的试验中已经在小鼠体内确证了化合物JZ02在一定浓度下能够保护LPS诱导的急性肺损伤[4]。本实验主要探讨JZ02对LPS诱导的大鼠急性肺损伤的药理作用,通过进一步验证,为急性肺损伤的治疗提供新的临床试验候选药物。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级Sprague Dawley(SD)大鼠18只,体重180~220 g,由上海斯莱克实验动物中心提供[实验动物合格证编号:SCXK(沪)2012-0002]。平衡饲养1周后,18只大鼠随机分为对照组(CON组)、模型组(LPS组)和JZ02治疗组(JZ02+LPS组),每组6只。
1.1.2 主要试剂 LPS(Sigma),细胞用DMSO(Solarbio),磷酸盐缓冲液(Hyclone)、动物组织蛋白抽提试剂(博士德生物技术有限公司),大鼠TNF-α ELISA试剂盒(eBioScience,Inc.),anti-CD68抗体(Cell Signaling Technology),Trizol试剂(Invitrogen),M-MLV逆转录试剂盒(Invitrogen),SYBR荧光染料(Bio-rad),苏木素-伊红染液(碧云天生物技术研究所),羟甲基纤维素钠(中国医药上海化学试剂公司),NaCl(浙江中星化工有限公司)。
1.1.3 主要仪器 低温离心机(美国,Thermo),SpectraMax M2酶标仪(美国,MD),超净工作台(美国,Labconco),PCR扩增仪(美国,Bio-rad),落地式离心机(美国,Beckman),定量PCR仪及移液枪(德国,Eppendrof),细胞计数器(美国,Invitrogen),倒置显微镜(日本,Olympus),包埋机及切片机(德国,Leica)。
1.2 方法
1.2.1 急性肺损伤动物模型的建立和干预 对照组、模型组和JZ02治疗组大鼠分别连续7 d灌胃予JZ02 20 mg/kg或等剂量0.5% CMC-Na,气管滴注5 mg/kg LPS或等量生理盐水建立急性肺损伤模型。24 h后0.9%生理盐水灌洗左肺收取肺泡灌洗液,右肺肺组织。
1.2.2 肺湿干重比值(Wet/Dry)的测定 将收取的右肺上叶组织经滤纸吸去组织上的水分后称重(湿重,Wet),然后入60 ℃烘箱中72 h以上烘干至恒重,称取其重量(干重,Dry)。
1.2.3 肺泡灌洗液(BALF)中蛋白浓度的测定 将收集的BALF离心后取上清液,经考马斯亮蓝溶液染色测OD值,计算蛋白浓度。
1.2.4 肺泡灌洗液中细胞计数 BALF离心后,用50 μL 0.9%生理盐水重悬沉淀,细胞计数仪Standard计数肺泡灌洗液中的细胞数。
1.2.5 病理组织学检查 将收取的右肺中叶组织固定、包埋后进行切片,苏木素-伊红(H & E)染色及免疫组织化学显微镜下查看炎症细胞情况。
1.2.6 BALF中炎症因子的表达和释放检测 酶联免疫吸附反应检测BALF中TNF-α的含量,并采用实时荧光定量PCR(RT-qPCR)检测肺组织中TNF-α及IL-6的含量。
2 结果
2.1 化合物JZ02 针对姜黄素自身不稳定及体内代谢快的特点,课题组合成了系列结构稳定的单羰基姜黄素类似物,通过前期体外抗炎活性筛选,我们发现活性化合物JZ02可显著抑制LPS诱导的腹膜巨噬细胞释放炎症因子TNF-α和IL-6,其具体结构如图1所示。

图1 JZ02化学结构图
2.2 化合物JZ02对肺湿重/干重比(Wet/Dry ratio)及BALF中蛋白浓度的影响 ALI/ARDS的特点是炎症所致的肺泡毛细血管内皮细胞和肺泡上皮细胞通透性增加[4]。肺泡-毛细血管之间存在用以交换气体的气-血屏障,经气管内滴注LPS后可导致肺上皮细胞和毛细血管内皮细胞的损伤,进而引起肺泡-毛细血管通透性增加,血管内的蛋白质等以及其他炎症介质可渗出至肺间质和肺泡内[3,5],导致肺水肿和BALF中蛋白浓度的升高。如图2A所示,LPS刺激24 h后,治疗组Wet/Dry值低于模型组。此外,治疗组BALF中蛋白浓度较LPS模型组明显降低(如图2B)。
2.3 化合物JZ02对BALF及肺组织中炎症因子的影响 局部炎症反应是LPS刺激下ALI/ARDS的根本特征,其中炎症介质和细胞因子可进入血液循环,激活炎症细胞,引起系统性炎症反应,导致肺组织内中性粒细胞及巨噬细胞等炎症细胞大量聚集,且炎性细胞聚集产生的大量炎性介质可进一步导致肺组织损伤[4,6],如图3所示,经气管滴注LPS 24 h后,LPS组BALF中的炎性细胞数(图3A)、炎症介质TNF-α(图3B)及组织中TNF-α(图3C)和IL-6(图3D)的表达增加,而经化合物JZ02预处理后,则均有降低。

图2 JZ02对肺湿干重比及BALF中蛋白的影响
2.4 化合物JZ02对肺组织中巨噬细胞浸润的影响 为进一步了解LPS诱导的大鼠急性肺损伤组织中炎症细胞的浸润程度,经气管滴注LPS 24 h后,肺组织免疫组化观察CD68阳性细胞数。CD68是存在于巨噬细胞表面的一种特异性抗原,其阳性细胞数可预测肺组织中巨噬细胞的浸润程度。结果发现,LPS组CD68阳性细胞大量聚集于肺组织中,JZ02+LPS组可以明显缓解巨噬细胞在肺组织中的聚集、浸润。见图4。
2.5 化合物JZ02对肺组病理学改变的影响 如图5所示,LPS组肺组织炎症细胞浸润,明显充血、水肿、肺泡壁增厚,CON组为正常肺组织,而JZ02+LPS组大鼠肺组织损伤明显缓解。
注:与LPS组比较,*P<0.05。A.BALF中炎性细胞数,B.BALF中TNF-α,C.组织中TNF-α,D.组织中IL-6
3 讨论
脓毒血症,尤其革兰阴性菌感染是引起ALI/ARDS发生发展中最主要的原因,并且病情进展较快。LPS刺激下,炎症细胞迅速浸润肺组织,引起中性粒细胞、巨噬细胞浸润等炎症细胞聚集,以及杯状细胞和黏液细胞增多,肺泡间隔增厚,间质充血、水肿,气管壁增厚、充血、水肿等[7],造成气管腔及肺泡缩小,进而影响肺泡和组织的氧合能力。
LPS是革兰阴性菌细胞壁的主要致病成分,是急性炎症有效启动的诱导剂[8]。LPS可促使炎症细胞如中性粒细胞、巨噬细胞等的激活并诱导大量细胞因子和炎症介质的产生和释放,进而损伤肺泡毛细血管膜,导致肺泡毛细血管通透性升高和肺水肿等[3]。因此,本实验采用气管滴注LPS致急性肺损伤动物模型。
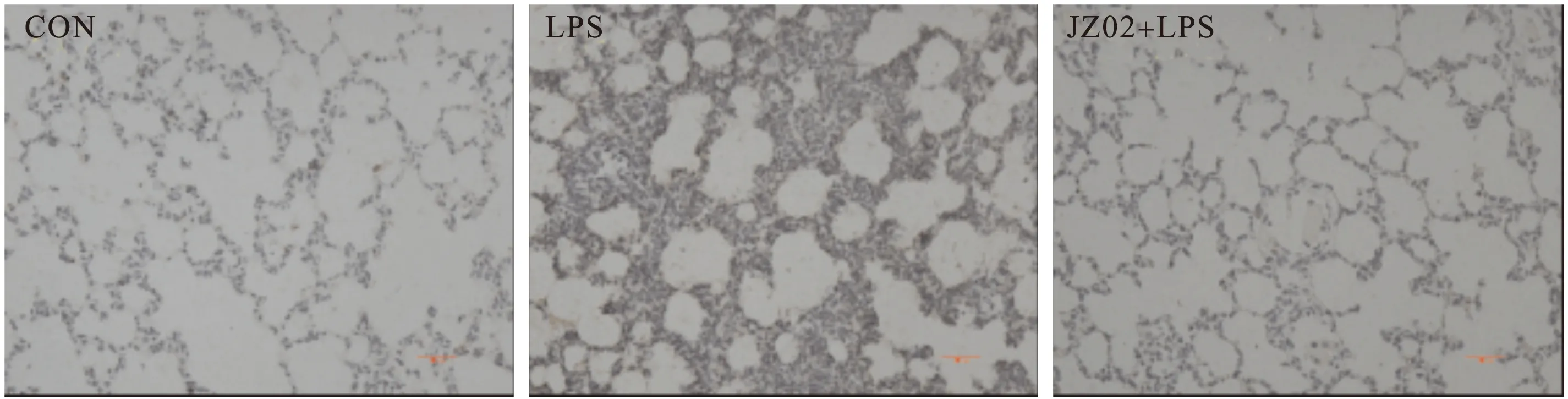
图4 肺组织免疫组化
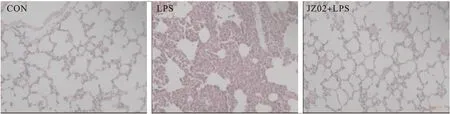
图5 肺组织切片
姜黄素是中药姜黄、郁金和莪术中的主要活性成分,安全性好,不良反应小[9-10]。研究发现,姜黄素具有抗炎、抗血管生成、抗肿瘤、抗菌、抗中枢神经系统疾病等多种药理作用[11]。姜黄素可通过抑制炎症因子TNF-α的产生、降低肺湿干重比值、缓解肺泡壁水肿增厚及炎性细胞浸润等对LPS诱导的大鼠急性肺损伤具有良好的保护作用。
TNF-α和IL-6是重要的炎症介质和促炎因子,可同时刺激其他多种炎症介质的产生[12]。有报道,在LPS诱导的急性肺损伤中,天然化合物通过下调TNF-α和IL-6的产生可以缓解急性肺损伤[13]。本研究表明,JZ02可降低肺泡灌洗液中炎症因子TNF-α的释放及肺组织中炎症基因的表达。研究表明,IL-6基因敲除小鼠不易感染肺炎链球菌所致的肺炎球菌肺炎[14],而IL-6水平上升可见于许多急性反应,如脓毒症、烧伤及重大手术等[15]。在LPS、TNF-α、IL-1β等刺激下,IL-6可由包括单核巨噬细胞、内皮细胞及成纤维细胞等在内的多种细胞产生[16]。本研究发现,新合成的姜黄素类似物JZ02可降低ALI肺组织中IL-6炎症基因的表达。此外,LPS诱导下的ALI发生时,在细胞因子和炎症介质刺激下,肺泡壁损伤可进一步引起炎症细胞浸润,肺泡内蛋白渗出,肺泡及管壁水肿、增厚等一系列病理生理改变,而JZ02组这些改变可明显缓解。
综上所述,新型姜黄素类似物JZ02具有较天然产物姜黄素更稳定的结构及较高的生物利用度,可通过减少炎症细胞浸润、炎症因子释放和基因的表达,缓解LPS诱导下急性肺损伤的进展。
[1] Mason C,Dooley N,Griffiths M.Acute respiratory distress syndrome[J].Clin Med (Lond),2016,16(Suppl 6):s66-s70.
[2] Mac Sweeney R,McAuley DF.Acute respiratory distress syndrome[J].The Lancet,2016,388(10058):2416-2430.
[3] Rubenfeld GD,Caldwell E,Peabody E,et al.Incidence and outcomes of acute lung injury[J].N Engl J Med,2005,353(16):1685-1693.
[4] Zhu H,Xu T,Qiu C,et al.Synthesis and optimization of novel allylated mono-carbonyl analogs of curcumin (MACs) act as potent anti-inflammatory agents against LPS-induced acute lung injury (ALI) in rats[J].Eur J Med Chem,2016,121:181-193.
[5] Mutlu GM,Budinger GR.Incidence and outcomes of acute lung injury[J].N Engl J Med,2006,354(4):416-417.
[6] Lee DY,Choi SI,Han SH,et al.Potential of pseudoshikonin i isolated from lithospermi radix as inhibitors of MMPs in IL-1β-induced SW1353 cells[J].Int J Mol Sci,2016,17(8):1350.
[7] Yu P,Dong L,Zhang Y,et al.Design,synthesis and biological activity of novel asymmetric C66 analogs as anti-inflammatory agents for the treatment of acute lung injury[J].Eur J Med Chem,2015,94:436-446.
[8] DeMarco ML,Woods RJ.From agonist to antagonist:structure and dynamics of innate immune glycoprotein MD-2 upon recognition of variably acylated bacterial endotoxins[J].Mol Immunol,2011,49(1-2):124-133.
[9] Kuriakose MA,Ramdas K,Dey B,et al.A randomized double-blind placebo-controlled phase Ⅱb trial of curcumin in oral leukoplakia[J].Cancer Prev Res (Phila),2016,9(8):683-691.
[10]Blanco-García E,Otero-Espinar FJ,Blanco-Méndez J,et al.Development and characterization of anti-inflammatory activity of curcumin-loaded biodegradable microspheres with potential use in intestinal inflammatory disorders[J].Int J Pharm,2017,518(1-2):86-104.
[11]Fan E,Villar J,Slutsky AS.Novel approaches to minimize ventilator-induced lung injury[J].BMC Med,2013,11:85.
[12]Akdis M,Burgler S,Crameri R,et al.Interleukins,from 1 to 37,and interferon-γ:receptors,functions,and roles in diseases[J].J Allergy Clin Immunol,2011,127(3):701-721,e1-e70.
[13]Chen J,Wang JB,Yu CH,et al.Total flavonoids of Mosla scabra leaves attenuates lipopolysaccharide-induced acute lung injury via down-regulation of inflammatory signaling in mice[J].J Ethnopharmacol,2013,148(3):835-841.
[14]Van der Poll T,Keogh CV,Guirao X,et al.Interleukin-6 gene-deficient mice show impaired defense against pneumococcal pneumonia[J].J Infect Dis,1997,176(2):439-444.
[15]Nijsten MW,Hack CE,Helle M,et al.Interleukin-6 and its relation to the humoral immune response and clinical parameters in burned patients[J].Surgery,1991,109(6):761-767.
[16]Bhatia M.Novel therapeutic targets for acute pancreatitis and associated multiple organ dysfunction syndrome[J].Curr Drug Targets Inflamm Allergy,2002,1(4):343-351.
