罗丹明基类分子荧光探针在丙酮酸细胞内可视化成像中的应用
2018-03-20孙晓艳陈金龙
王 硕,孙晓艳,陈金龙*
(1中国药科大学药学院药物分析系,南京 210009;2中国药科大学药物质量与安全预警教育部 重点实验室,南京 210009;3江苏省中医药研究院分子与细胞生物实验室,南京 210028)
近年来,研究人员基于代表性有机染料,如罗丹明、香豆素、荧光素,设计出许多荧光传感器[1-3],其中罗丹明是一类性能优良的分子荧光染料,具有高荧光量子效率[4-6]。医学工作者将这些传感器用于检测细胞内、外生物分子[7-9],通过检测这些标志物的含量来诊断某些疾病,其中维生素B1缺乏症可通过检测血液丙酮酸(pyruvic acid,PA)来诊断。硫胺素焦磷酸是维生素B1的主要辅酶形式,在细胞内参与PA进一步氧化分解为乙酰辅酶A。维生素B1缺乏时,体内PA的氧化过程受阻,使PA的含量增加,其主要临床表现为自主神经功能紊乱、心力衰竭、共济失调、双下肢周围性瘫痪等[10]。因此,建立一种对该类疾病的检测方法尤为重要。
丙酮酸是连接糖酵解和三羧酸循环的一种重要的有机α-酮酸,维持体内糖、脂肪、氨基酸之间的平衡。α-酮酸与氨基酸之间的转氨作用可在温和生理条件下进行,其中关键步骤氨基酸的氨基与辅酶磷酸吡哆醛(pyridoxal phosphate,PLP)发生席夫碱反应,生成亚胺结构[11](图1),说明活性羰基易与氨基基团发生高效反应和转化。目前检测PA的方法主要有荧光法[12]、比色法[13]、化学发光法[14]、高效液相色谱法[15]、气相色谱法[16]等。化学发光法、色谱法需要复杂的样品处理过程,且检测成本昂贵使其无法得到广泛应用。而PA由于自身化学结构特点,吸收波长短,且消光系数小,羰基显色试剂——二硝基苯肼对PA比色法检测存在专属性差和灵敏度低的不足[17-18]。与这些方法相比,荧光法具有操作简单、检测快速、专属性高等优点。

Figure1 Schiff base reaction occurred between the amino acid and pyridoxal phosphate (PLP)
针对传统检测方法的不足,本文设计3种罗丹明类酰肼探针:RhB-NH2、R6G-NH2、R-101-NH2、(图2)。探针本身无荧光,分子结构中酰肼基团的N原子有孤对电子,易与PA结构中的羰基发生缩合反应,生成席夫碱,所生成的席夫碱共轭体系扩大,诱导吡咯环开环,实现探针荧光信号增强,从而建立一种水相检测PA的新方法(图3)。体内常见生物分子、阴阳离子以及活性氧化物等几乎无干扰,探针分子对PA具有高专属性,成功应用于A549、293T活细胞中丙酮酸的荧光成像。
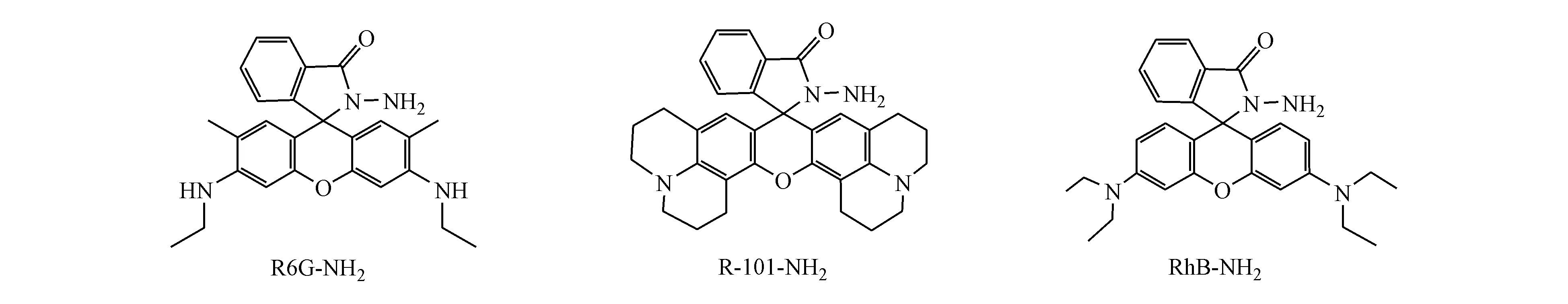
Figure2 Molecular structures of R6G-NH2,R-101-NH2and RhB-NH2

Figure3 Proposed mechanism for the reaction of probe model with pyruvic acid (PA)
1 材 料
1.1 试 剂
丙酮酸、罗丹明B、水合肼(阿拉丁试剂有限公司);罗丹明6G(美国Acros Organics公司);罗丹明101(美国Sigma-Aldrich试剂有限公司);胎牛血清(FBS,美国Gibco公司)、青霉素、链霉素(美国Invitrogen公司)。其他试剂均为市售分析纯;实验用水为二次蒸馏水。
1.2 仪 器
F-4600荧光光谱仪(日本日立公司);UV-1700紫外分光光度计(日本岛津公司);三重四极杆质谱仪(美国Thermo Finnigan公司);Axio Observer A1蔡司倒置荧光显微镜(德国卡尔蔡司公司)。
1.3 细胞系
人非小细胞肺癌细胞细胞系A549、肾上皮细胞系293T(中国科学院上海生命科学研究院细胞资源中心)。
2 方 法
2.1 罗丹明基荧光探针的合成
依据文献[19-20],分别称取一定量罗丹明B、罗丹明6G、罗丹明101溶解于甲醇中配制成100 mmol/L溶液,加入过量水合肼,氮气保护下水浴加热至75 ℃回流搅拌反应4 h至颜色褪去。将反应混合物倒入去离子水中,用乙酸乙酯萃取(25 mL×3)至水层无色,无水硫酸钠干燥,减压蒸馏,得到罗丹明6G酰肼(R6G-NH2,淡黄色固体,产率74.2%)、罗丹明101酰肼(R-101-NH2,粉红色粉末,产率75.8%)和罗丹明B酰肼(RhB-NH2,浅粉色粉末,70.8%)。
2.2 探针储备液的配制
分别准确称取一定量的R6G-NH2、R-101-NH2、RhB-NH2,用乙醇完全溶解,配制成1 mmol/L探针储备液。
2.3 丙酮酸储备液的配制
用二次蒸馏水稀释PA原液,配成不同浓度的PA溶液。
2.4 荧光探针对各种分析物的光学响应
在10 mL具塞刻度试管中,移液管移取乙醇1.00 mL,HEPES-NaOH缓冲液(200 mmol/L,pH 5.40)1.00 mL,适量探针储备液,摇匀,加入一定浓度各分析物,用二次蒸馏水稀释,定容至刻度,摇匀,37 ℃静置,避光反应10 min后进行荧光、紫外吸收测试。
2.5 组织液中丙酮酸检测
称取植物样品5.0 g于研钵中加入少许石英砂,研磨成匀浆,用无水乙醇(5 mL)浸洗4次,转入25 mL量瓶,定容至刻度,室温避光静置30 min,取匀浆液10 mL离心(4 000 r/min)10 min,取上清液备用。在10 mL具塞刻度试管中,移液管移取上清液1.00 mL,HEPES-NaOH缓冲液(200 mmol/L,pH 5.40)1.00 mL,探针储备液(1 mmol/L)70 μL,摇匀,二次蒸馏水定容至刻度,摇匀,37 ℃静置,避光反应10 min后进行荧光测试。
2.6 细胞外源性丙酮酸荧光成像
细胞系A549、293T是用F12K培养基(DMEM)进行培养,其中添加10%胎牛血清、青霉素(100 U/mL)和链霉素(100 μg/mL)。取对数生长期细胞,以每毫升1.5×105个细胞的密度接种在直径为35 mm的细胞培养皿中,培养过夜后,把培养液换成含有10 μmol/L R6G-NH2的培养基,细胞在37 ℃下继续孵育30 min。然后把部分培养液换成添加有50、100 μmol/L PA的培养基,继续孵育30 min。用PBS(0.01 mol/L,pH 7.4)洗涤3次后,细胞放在荧光显微镜(200倍物镜,激发波长488 nm),进行观察、拍摄。
2.7 细胞内源丙酮酸荧光成像
取细胞系293T对数生长期细胞,以每毫升1.5×105个细胞的密度接种在直径为35 mm的细胞培养皿中,培养过夜后,把部分培养液换成含有1 nmol/L双酚A(BPA)的培养基,细胞在37 ℃下继续孵育24 h。然后把部分培养液换成添加有10 μmol/L R6G-NH2的培养基,继续孵育30 min。用PBS(0.01 mmol/L,pH 7.4)洗涤3次后,细胞置荧光显微镜下进行观察及拍摄。
3 结果与讨论
3.1 探针筛选与检测机制
为研究探针分子结构对PA识别能力的影响,通过比较5 μmol/L 3种探针在各自最大发射处的相对荧光强度(F/F0-1)对PA浓度(50,120 μmol/L)响应结果,评价各探针分析性能(图4),探针R6G-NH2对PA各浓度响应最好,因此,选择R6G-NH2为目的探针深入研究。为验证上述推测,采用荧光分光光度法、紫外分光光度法和质谱法对反应机制进行初步探究。
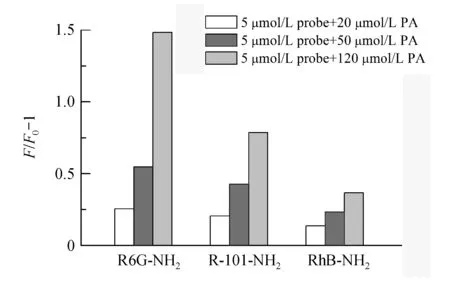
Figure4 Fluorescence responses of the three probes (5 μmol/L) to the different concentration of PA
如图5所示,激发波长为510 nm,探针本身在565 nm处荧光强度较低,且在450~650 nm之间几乎没有紫外吸收,这是因为探针处于螺环状态,芳香环之间没有形成有效共轭结构[21],与PA发生反应后,探针在565 nm处荧光强度显著增强,在533 nm处出现特征吸收峰,溶液由无色变为粉红色,说明探针与PA作用后,吡咯环开环导致荧光和颜色的变化。质谱结果表明,探针本身分子离子峰[M+H]+出现在429.24(理论值429.22),加入PA后,探针峰消失,在499.25处出现新的离子峰,这与探针和PA反应生成产物的理论值499.23吻合。
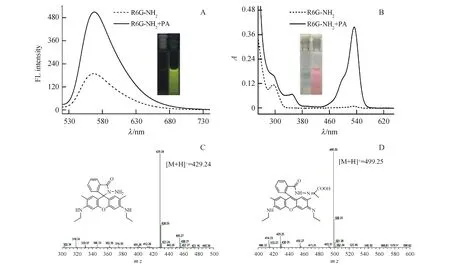
Figure5 Effect of R6G-NH2on PA
A:Fluorescence spectra of R6G-NH2before and after reaction with PA,Inset:photographs under UV light (365 nm);B:UV-Vis spectra of R6G-NH2before and after reaction with PA,Inset:photographs under sunlight;C:ESI-MS results of free R6G-NH2;D:ESI-MS results of the corresponding product of R6G-NH2and PA
3.2 检测条件的优化
从有机助溶剂的种类及比例、探针浓度、pH以及反应温度等方面优化检测条件。由于探针R6G-NH2难溶于水而易溶于有机溶剂,为了实现均相分析的目的,需要加入适量与水互溶有机溶剂。分别以体积比为10%的4种常见溶剂甲醇、乙醇、乙腈、二甲基亚砜(DMSO)为基底,测试加入PA(20、100 μmol/L)前后溶液的荧光强度,比较不同有机相存在条件下,荧光强度增强变化量F/F0-1(图6-A)。结果表明,在体系中加入乙醇检测灵敏度最高,且PA在乙醇-水(1∶9)的体系中对R6G-NH2探针荧光恢复最强(图6-B),因此,选择乙醇作为检测体系的助溶剂。对R6G-NH2探针浓度优化(图6-C),结果发现7 μmol/L探针荧光恢复效果最好,因此最终选择7 μmol/L探针浓度作为分析浓度。
酮类化合物与肼反应一般是在酸催化下进行,羰基氧与质子结合,可以提高羰基的活性,但若酸性过强,肼与质子结合形成盐,会丧失它们的亲和性[22],因此,探针以及产物分子中吡咯环结构的开闭与pH紧密相关。为了优化检测pH,本研究考察了不同pH体系下探针荧光强度恢复能力。如图7-A所示,向探针溶液中分别加入20、100 μmol/L PA,在酸性较强的条件(pH<5.3)下,由于强质子化环境使探针自发开环,出现较强的荧光背景,pH>5.3时,探针在相对较弱的质子化环境中无显著的荧光信号,且当pH=5.4时,体系的荧光增强倍数达到最大。
反应温度也是影响反应速率的重要因素之一,本研究进行一系列平行实验以探究温度对反应结果的影响。通过测试5~70 ℃范围内探针与PA反应前后荧光变化趋势,如图7-B所示,结果表明R6G-NH2与PA反应产物的荧光强度随温度变化并不明显,因此选择一般正常人的体温37 ℃作为检测条件,有利于实现探针的实际应用。

Figure6 Effects of reaction conditions on response of R6G-NH2to PA
A:Organic phase (R6G-NH2:5 μmol/L);B:Ethanol content (R6G-NH2:5 μmol/L);C:R6G-NH2concentration
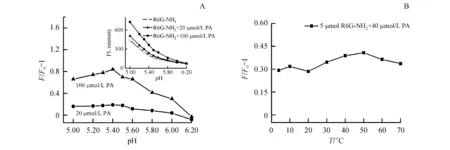
Figure7 Effects of reaction conditions on response of R6G-NH2to PA
A:pH;B:Temperature (R6G-NH2:5 μmol/L)
3.3 探针R6G-NH2分析性能
经优化得到最佳检测条件:7 μmol/L探针R6G-NH2加入到20 mmol/L pH 5.40 HEPES-NaOH缓冲液中,体系中乙醇-水(1∶9),反应温度37 ℃,然后分别加入不同浓度PA溶液。在此条件下,探针R6G-NH2与不同浓度PA反应后荧光光谱曲线如图8-A所示。随PA浓度增大(0~160 μmol/L),探针在565 nm处荧光强度逐渐增强,当PA浓度达120 μmol/L时,探针荧光强度基本保持稳定,呈现出较强的黄色荧光。结果发现,如图8-B所示,探针R6G-NH2在565 nm处荧光强度变化量(F/F0-1)与PA浓度(0.2~120 μmol/L)呈良好线性相关,线性方程为:F/F0-1=0.013 4c(PA)+0.012 5(R2=0.998 7),式中F和F0分别是探针R6G-NH2与PA作用后、以及探针自身的荧光强度,检测下限低至0.1 μmol/L。荧光探针R6G-NH2与不同浓度PA紫外吸收光谱如图8-C所示,探针溶液在450~650 nm之间几乎无紫外吸收,加入PA后,533 nm处出现新的明显吸收峰,溶液颜色逐渐由无色变为红色,这是因为生成物Schiff碱引起吡咯环开环,共轭结构增大。因此,探针R6G-NH2是一种潜在具有比色/荧光双通道识别PA分子的传感器。
3.4 探针选择性考察

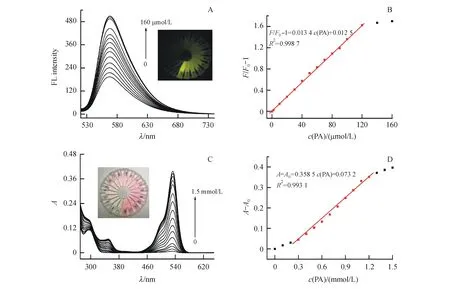
Figure8 Analysis performance of R6G-NH2
A:Fluorescence spectra of R6G-NH2with different concentrations of PA (0-160 μmol/L),Inset:images under UV light (365 nm);B:Linear calibration plot of the various concentrations of PA between the enhancement of fluorescence intensity;C:UV-Vis spectra of R6G-NH2with different concentrations of PA (0-1.5 mmol/L),Inset:images under sunlight;D:Linear calibration plot of the various concentrations of PA between the enhancement of absorbance intensity

Figure9 Selective response of R6G-NH2to pyruvic acid affected by conventional biomolecules and ionic species
A:Fluorescence response of R6G-NH2(7 μmol/L) to different amino acids (500 μmol/L) and PA (100 μmol/L);B:Fluorescence response of R6G-NH2(7 μmol/L) to protein,various anions,ROS and dicarbonyl derivatives (Cu2+,Fe3+:30 μmol/L;BSA,HGB,DNA:50 μg/mL;and other interfering substances concentrations of 500 μmol/L).Inset:images of R6G-NH2and with different amino acids,anions and PA solutions in sunlight (a) and UV light (365 nm,b)
3.5 组织液中丙酮酸的检测
为了验证R6G-NH2纳米探针的可行性,本研究选取洋葱、大蒜、大葱3种植物样品。样品研磨成匀浆溶于乙醇,去除蛋白,经4 000 r/min转速离心,取上清液,用探针与2,4-二硝基苯肼检测各组织液中丙酮酸含量。如图10所示,3种组织液样品中PA含量的两种方法检测结果均高度吻合。说明基于分子荧光探针的分析方法,快速灵敏,准确且不需要繁琐复杂的样品处理过程,操作简单易行。
3.6 细胞成像
PA是糖酵解的主要产物,而糖酵解主要在细胞质中进行,因此细胞中含有丰富的PA[23]。为了探讨R6G-NH2在活细胞中对PA的荧光成像能力,采用倒置荧光显微镜对A549、293T活细胞中外源性PA进行荧光成像。在生物体系内,10%的乙醇浓度并不适合与细胞共培养,为了检测活细胞内丙酮酸,本实验培养基中并未加入乙醇,且由图6-B实验结果可以看出,在无乙醇体系中,探针对丙酮酸响应度高,并不影响检测定性结果。此外,体外条件优化实验结果表明,探针浓度5~10 μmol/L 之间对丙酮酸响应较灵敏,考虑到细胞内环境复杂,适当增大探针浓度可使检测结果更显著。结果如图11、12所示,探针R6G-NH2可以穿过细胞膜并进入细胞质。空白对照组几乎没有荧光信号,向培养基中加入10 μmol/L R6G-NH2孵育30 min,显示较弱的荧光信号。向该培养基中分别加入50、100 μmol/L外源性PA继续孵育30 min,可观察到PA浓度依赖的荧光增强现象。
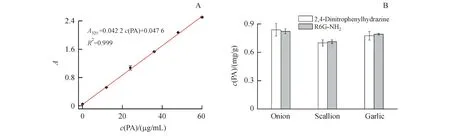
Figure10 Detection of PA in plant tissue
A:Standard curve of pyruvate detected by 2,4-dinitrophenylhydrazine;B:Comparison of the analytical results of onion,scallion and garlic samples determined with the proposed method and 2,4-dinitrophenylhydrazine colorimetry (n=3)
为了考察R6G-NH2对细胞内源PA监测能力,本研究采用低浓度BPA诱导细胞产生PA[24]并进行荧光成像。结果如图13所示,经过BPA诱导的293T细胞荧光显著增强,探针R6G-NH2对细胞内源PA响应灵敏。因此,R6G-NH2有望发展成一种活细胞中PA实时动态荧光成像的分子探针。
4 结 论

启发于细胞内生理环境下α-酮酸与氨基酸之间的转氨作用,以罗丹明为荧光团,肼为识别基团,本研究构建了一类分子开关的“Turn-on”型丙酮酸荧光探针。通过探针分子中酰肼与丙酮酸活泼羰基发生席夫碱反应,诱导吡咯环打开,产生颜色和荧光双重响应。罗丹明6G-酰肼代表探针具有分析灵敏度高、检测快速、选择性好等特点,可消除常见生物分子和阴阳离子、活性氧化物等物质的干扰。体外成功检测了3种生物组织中的丙酮酸。Figure11 A549 Cell fluorescence images of exogenous PA incubated with R6G-NH2
A:Untreated control;B:Cells incubated with R6G-NH2(10 μmol/L);C:Cells incubated with R6G-NH2(10 μmol/L) in the presence of PA (50 μmol/L);D:Cells incubated with R6G-NH2(10 μmol/L) and in the presence of PA (100 μmol/L)

Figure12 293T Cell fluorescence images of exogenous PA incubated with R6G-NH2
A:Untreated control;B:Cells incubated with R6G-NH2(10 μmol/L);C:Cells incubated with R6G-NH2(10 μmol/L) in the presence of PA (50 μmol/L);D:Cells incubated with R6G-NH2(10 μmol/L) and in the presence of PA (100 μmol/L)

Figure13 293T Cell fluorescence images of endogenous PA incubated with R6G-NH2
A:Untreated control;B:Cells incubated with BPA (1 nmol/L);C:Cells incubated with R6G-NH2(10 μmol/L);D:Low-concentrations of BPA (1 nmol/L) induced PA and incubated with R6G-NH2
一定疏水特性的探针分子具有良好的细胞膜穿透性,成功实现了细胞外源性和内源性丙酮酸荧光成像分析。
[1] Li Q,Li S,Chen X,etal.A G-quadruplex based fluorescent oligonucleotide turn-on probe towards iodides detection in real samples[J].FoodChem,2017,230(1):432-440.
[2] Peng T,Chen XM,Gao L,etal.A rationally designed rhodamine-based fluorescent probe for molecular imaging of peroxynitrite in live cells and tissues[J].ChemSci,2016,7(8):5407-5413.
[3] Ma QJ,Zhang XB,Zhao XH,etal.A highly selective fluorescent probe for Hg2+based on a rhodamine-coumarin conjugate[J].AnalChimActa,2010,663(1):85-90.
[4] Li K,Xiang Y,Wang XY,etal.Reversible photochromic system based on rhodamine B salicylaldehyde hydrazone metal complex[J].JAmChemSoc,2014,136(4):1643-1649.
[5] Wu YX,Li JB,Liang LH,etal.A rhodamine-appended water-soluble conjugated polymer:an efficient ratiometric fluorescence sensing platform for intracellular metal-ion probing[J].ChemCommun(Camb),2014,50(16):2040-2042.
[6] Zhou LY,Zhang XB,Wang QQ,etal.Molecular engineering of a TBET-based two-photon fluorescent probe for ratiometric imaging of living cells and tissues[J].JAmChemSoc,2014,136(28):9838-9841.
[7] Gao H,Song J,Shang S,etal.Fluorescent properties andinvitrostudies of new dehydroabietic acid-based diarylamines fluorescent probes[J].FrontAgrSciEng,2017,4(1):106-115.
[8] Liu H,Na W,Liu Z,etal.A novel turn-on fluorescent strategy for sensing ascorbic acid using graphene quantum dots as fluorescent probe[J].BiosensBioelectron,2017,92(15):229-233.
[9] Madrakian T,Maleki S,Gilak S,etal.Turn-off fluorescence of amino-functionalized carbon quantum dots as effective fluorescent probes for determination of isotretinoin[J].SensActuatorsBChem,2017,427:428-435.
[10] Collie JTB,Greaves RF,Jones OAH,et al.Vitamin B1 in critically ill patients:needs and challenges[J].ClinChemLabMed,2017,55(11),1652-1668.
[11] Wu WT.Biochemistry(生物化学)[M].3rd Ed.Beijing:China Medical Science and Technology Press,2015:351-365.
[12] Olsen C.An enzymatic fluorimetric micromethod for the determination of acetoacetate,β-hydroxybutyrate,pyruvate and lactate[J].ClinChimActa,1971,33(2):293-300.
[13] Horowitz A,Meller R,Moortgat GK.The UV-VIS absorption cross sections of theα-dicarbonyl compounds:pyruvic acid,biacetyl and glyoxal[J].JPhotochemPhotobiolAChem,2001,146(1):19-27.
[14] Pérez-Ruiz T,MartíNez-Lozano C,Tomás V,etal.Chemiluminescence determination of citrate and pyruvate and their mixtures by the stopped-flow mixing technique[J].AnalChimActa,2003,485(1):63-72.
[15] Ewaschuk JB,Naylor JM,Barabash WA,etal.High-performance liquid chromatographic assay of lactic,pyruvic and acetic acids and lactic acid stereoisomers in calf feces,rumen fluid and urine[J].JChromatogrB,2004,805(2):347-351.
[16] Hautala E,Weaver ML.Separation and quantitative determination of lactic,pyruvic,fumaric,succinic,malic,and citric acids by gas chromatography[J].AnalBiochem,1969,30(1):32-39.
[17] Li L,Li GX,Dai QW.Analysis of the content of phenylpyruvic acid in mixture by colorimetry[J].ChemReagents(化学试剂),2002,24(1):22-23.
[18] Lou LW,Gao NF.Determination of pyruvate by ultraviolet spectrophotometry[J].AnalLab(分析试验室),2005,24(4):11-13.
[19] Zhang Z,Deng CQ,Guo T,etal.Synthesis and analytical application of a rhodamine-based fluorescent probe for hypochlorous acid[J].JInstrumAnal(分析测试学报),2014,33(7):810-814.
[20] Zhou L,Liu W,Di B,etal.Synthesis and application of a fluorescent molecular probe for rapid detection of sulfur dioxide residues in traditional Chinese herbs[J].JChinaPharmUniv(中国药科大学学报),2015,46(4):444-449.
[21] Jiao CH,He Y,Jin PW,etal.A turn-on fluorescent probe forα-ketoglutaric acid based on rhodamine B[J].ImagSciPhotochem(影像科学与光化学),2015,33(3):195-202.
[22] Wang JT.OrganicChemistry(有机化学)[M].2nd Ed.Tianjin:Nankai University Press,2009:348-350.
[23] Guo AG.BasicBiochemistry(基础生物化学)[M].2nd Ed.Beijing:Higher Education Press,2013:247-254.
[24] Shi XY,Wang Z,Liu L,etal.Low concentrations of bisphenol a promote human ovarian cancer cell proliferation and glycolysis-based metabolism through the estrogen receptor-α pathway[J].Chemosphere,2017,185:361-367.
